戊糖片球菌S44胞外多糖抗氧化活性分析
2019-05-09陈佩党辉郭红军翟彩宁
陈佩,党辉,郭红军,翟彩宁
(1.陕西广播电视大学益生菌功能及应用协同创新中心,陕西 西安 710119;2.陕西师范大学食品工程与营养科学学院,陕西 西安 710119)
乳酸菌胞外多糖(exopolysaccharides of lactic acid bacteria,LAB EPS)是乳酸菌在生长代谢过程中分泌到细胞外的一种糖类化合物,是乳酸菌在长进化过程中适应环境的产物,是无毒的有机体,对人体健康有益[1]。LAB EPS 不仅可以保护菌体而且因其具有调节免疫力、抗肿瘤、抗炎以及抗氧化等作用[2-4],在诸如化妆品、制药、食品等生物技术方面得以应用。
生命体中源源不断地产生活性氧(reactive oxygen species,ROS),包括羟自由基,超氧阴离子自由基和过氧化氢等非自由基。它们在体内可产生一种负面作用,即氧化应激[5]。氧化应激会导致机体的各种组织和器官的功能逐渐下降,加速机体衰老和死亡,因此老化的速度可通过氧化损伤的衰减被延迟[6]。依据自由基老化理论,可以利用抗氧化剂中断产生活性氧的反应[7],但是长期使用抗氧化剂会给机体带来一系列的副作用,如高血糖、高血压和癌症等。因此寻找开发更安全有效的天然抗氧化剂是非常必要的[8]。越来越多的报道表明乳酸菌的胞外多糖具有抗氧化活性,乳酸菌胞外多糖抗氧化研究正逐步兴起。
研究所选用的菌株戊糖片球菌S44,是本实验室从陕南泡菜中筛选出的一株高产胞外多糖的乳酸菌[9],研究主要评价了戊糖片球菌S44 胞外多糖的体外抗氧化活性。
1 材料与方法
1.1 材料与仪器
戊糖片球菌S44:分离自陕南地区农户自制泡菜;人肝癌细胞系HepG2 细胞株:中国科学院上海生命科学研究院细胞资源中心;杜氏改良伊格尔培养基、双抗(青、链霉素)、0.25%胰酶、胎牛血清、L-谷氨酰胺和非必需氨基酸:美国Gibico 公司;乳酸细菌液体培养基(De Man,Rogosa and Sharpe,MRS):青岛海博生物技术有限公司;1,1-二苯基苦基苯肼自由基(1,1-diphenyl-2-picrylhydrazyl,DPPH):美国 sigma 公司;过氧化氢、硫酸亚铁、铁氰化钾、1,10-邻菲罗啉均为分析纯:中国医药(集团)上海化学试剂公司;总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物岐化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)测定试剂盒:武汉博士德生物工程有限公司。
恒温培养箱(DHP9012):上海一恒科技有限公司;CO2细胞培养箱(Thermo Fisher HERAcell150i cell):美国Thermo 公司;超净台(SW-CJ-1CV):苏州安泰空气技术有限公司;冷冻离心机(5415R):德国Eppendorf 公司;紫外可见分光光度计(UV-2100):尤尼科上海有限公司;透析袋(MD16,截留分子量为8 000 D~14 000 D):北京索莱宝科技有限公司;倒置显微镜(CX41-12C02):日本Olympus 公司。
1.2 方法
1.2.1 戊糖片球菌S44 的制备
将冻存于-80 ℃的戊糖片球菌S44 接入MRS 液体培养基中,37 ℃培养18 h,连续活化3 代后用于后续试验。
1.2.2 胞外多糖的制备
将菌种接至200 mL 发酵培养基中,培养24 h 后将发酵液在 4 ℃,10 000×g 离心 20 min,弃沉淀;上清液中加入配制好的三氯乙酸(体积分数为80%)至终浓度(三氯乙酸体积分数)为4%,4℃下静置过夜;再于 4 ℃,10 000×g 离心 20 min,弃沉淀。上清液以旋转蒸发仪于40 ℃浓缩至原体积的1/3,加入4 倍95%的乙醇于4 ℃静置过夜,同上条件下离心20 min 后取沉淀溶于双蒸水(double distilled water,ddH2O)中,并用ddH2O 透析3 d,每8 h 换水,收集透析液后真空冷冻干燥,得到戊糖片球菌胞外多糖。
1.2.3 总糖量的测定
参照文献[10]的方法有所改动。将冷冻干燥后的戊糖片球菌胞外多糖用ddH2O 溶解,利用苯酚-硫酸法测定胞外多糖产量。以葡萄糖为标准品制作标准曲线,得到回归方程,并通过回归方程计算戊糖片球菌的胞外多糖产量。
1.2.4 多糖溶液的制备
根据以上结果,配制1 mg/mL 的多糖母液,梯度稀释,最终浓度为 0.2、0.3、0.4、0.5 mg/mL 备用。
1.2.5 胞外多糖清除DPPH 自由基能力的测定
参考文献[11]的方法稍有修改。反应体系中加入1 mL 样品溶液,再加入1 mL 0.2 mmol/L DPPH 的无水乙醇,震荡充分混匀,室温下(25 ℃)避光静置反应30 min,测定 517 nm 波长处的样品吸光度(OD 值)为A样;用等体积的ddH2O 代替样品溶液作为对照组A对,并以无水乙醇作为空白测定其吸光值为A空,以VC为阳性对照。计算DPPH 自由基清除率如下:
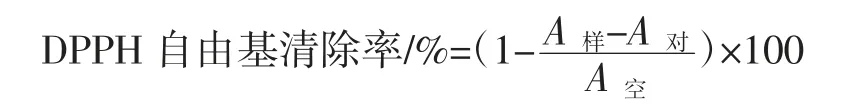
1.2.6 胞外多糖清除羟自由基能力的测定
参照文献[12]的方法稍有修改。1 mL 2.5 mmol/L 的1,10-邻菲罗啉,1 mL pH 7.4 的磷酸缓冲盐溶液(phosphate buffer saline,PBS)和1 mL 水充分混匀后,再加入1 mL 2.5 mmol/L 的硫酸亚铁,充分混匀后,加入1 mL 20 mmol/L 的过氧化氢,37 ℃中水浴1.5 h,在536 nm 处测定其OD 值为A空。把1 mL 水替换为1 mL 样品液记为A样,将1 mL 的过氧化氢替换为1 mL的水记为A对,以VC为阳性对照。按照如下公式计算多糖清除羟自由基的能力:

1.2.7 胞外多糖对超氧阴离子自由基的清除作用
参照文献[13]的方法稍有修改。分别加入浓度为0.2、0.3、0.4、0.5 mg/mL 的样品溶液 1 mL,测定其在320 nm 处的吸光值,以VC为阳性对照。按照如下公式计算多糖对超氧阴离子自由基的清除作用:
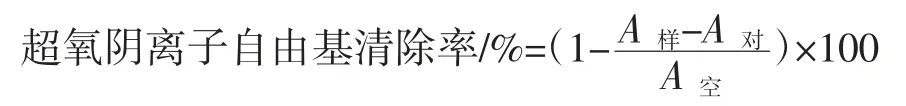
式中:A样为加入样品和邻苯三酚的吸光度;A对为加入样品,但不加邻苯三酚的吸光度;A空为不加样品,但加入邻苯三酚的吸光度。
1.2.8 胞外多糖还原能力的测定
参考文献[14]的方法稍有修改。0.5 mL 不同浓度的样品中加入1 %铁氰化钾0.5 mL,0.5 mL PBS(pH 6.6),震荡充分混匀,于50 ℃中水浴20 min,在冰浴中急速冷却后,加入0.5 mL 10%的三氯乙酸,3 000 r/min离心10 min,取其1 mL 上清后加入1 mL 0.1%的FeCl3,反应10 min 后在700 nm 波长下测定样品的OD 值,以VC为阳性对照。A700nm值越大,代表还原能力越强。
1.2.9 胞外多糖对HepG2 细胞抗氧化能力的影响
细胞培养:将HepG2 细胞按常规方法复苏后,置于含有10%胎牛血清、1%非必需氨基酸、1%L-谷氨酰胺和1 %双抗的低糖DMEM 培养液中,37 ℃,5 %CO2的培养箱中进行培养,隔天更换一次培养液,待细胞贴壁融合率达80%左右时,用含0.02%EDTA 的0.25%胰酶消化细胞,按1∶3 传代。取对数生长期细胞进行试验。
HepG2 细胞氧化损伤模型的建立:参照文献[15]的方法有所改动,将对数生长期中的HepG2 细胞按照2×105个/mL 接种到 96 孔板中,每孔 100 μL,37 ℃,5%CO2的培养箱中培养24 h 后,加入含过氧化氢终浓度分别为0.10 mmol/L 的DMEM 培养液,作用2 h,弃上清,以噻唑蓝比色法检测细胞活力并以此建立氧化损伤模型。
胞外多糖对HepG2 细胞抗氧化功能的影响测定:参照文献[16]的方法有所改动,用0.25%的胰蛋白酶消化收集生长处于对数生长期的HepG2 细胞,以2×105个/mL 的细胞密度接种于6 孔培养板,每孔2 mL培养液,37 ℃、5%CO2,培养 24 h 后,分组处理:空白对照组,加入2 mL DMEM 完全培养液;模型组,加入含过氧化氢的DMEM 培养液;样品组,同时加入含过氧化氢的DMEM 培养液和不同浓度的胞外多糖样品溶液。培养24 h 后,除去培养上清,每孔用PBS 洗涤3 次,然后每孔加1 mL 1%的Triton X-100,用吸管充分吹匀,2 000 r/min 离心15 min,收集上清即为细胞裂解液,-80 ℃冻存备用。
指标测定:测定方法参照MDA、SOD 和T-AOC 测定试剂盒说明书进行。
1.3 数据分析
数据统计采用SPSS 16.0 进行One-Way ANOVA,Tukey's 多重检验(P<0.05),数值以平均值±标准差表示。
2 结果与分析
2.1 总糖量测定
胞外多糖的含量采用苯酚-硫酸法测定,以葡萄糖为标准品得到回归为y=0.068 1x-0.002,R2=0.999 6,曲线拟合良好,戊糖片球菌S44 胞外多糖产量为(190.75±6.24)mg/L。
2.2 胞外多糖清除DPPH自由基的能力
DPPH 是一种人工合成的稳定的自由基,其在517 nm 处具有较强的吸收峰,测定方法简单,反应时间较短。虽然DPPH 并不是人体实际能够生成的一种自由基,但对DPPH 自由基的清除率在一定程度上仍然可以有效的评价抗氧化剂的抗氧化活性。因此测定DPPH 自由基的清除能力是测定抗氧化性的重要方法[17]。戊糖片球菌S44 胞外多糖对DPPH 自由基的清除能力见表1。

表1 胞外多糖清除DPPH自由基的能力Table 1 Scavenging activity of EPS against DPPH radical
表1结果表明戊糖片球菌S44 胞外多糖对DPPH自由基的清除能力与其质量浓度呈正相关,随着胞外多糖浓度的增加,DPPH 自由基的清除率也逐渐增大。当胞外多糖的浓度为0.5 mg/mL 时,其DPPH 自由基的清除率比浓度为0.2 mg/mL时显著增加了85.85 %(P<0.05)。与同浓度的VC相比,胞外多糖对DPPH 自由基的清除率均小于VC。杨晨璐等[3]研究表明植物乳杆菌的胞外多糖表现出较高的DPPH 自由基清除能力,清除率可达90%以上。张玲秀等[18]从家蝇体内筛选出两株高产胞外多糖的芽孢杆菌,其所产胞外多糖对DPPH 自由基具有显著的清除作用,清除率达到20%以上。由此推断,可能是菌株的特异性影响了其所产胞外多糖对DPPH 自由基的清除能力。
2.3 胞外多糖清除羟自由基的能力
羟自由基是活性氧自由基的一种,它具有最强的反应活性,是仅次于氟的一种非选择性氧化剂。能诱导核酸、蛋白质、不饱和脂肪酸等生物大分子发生严重损伤。羟自由基清除剂的加入可以有效降低或缓解这些有害效应,因此清除羟自由是抗氧化中很重要的一个指标[19]。邻二氮菲-Fe2+是一种氧化还原指示剂,Fe2+与过氧化氢反应后产生羟自由基,其具有很强的氧化能力。邻二氮菲-Fe2+被羟自由基氧化后生成邻二氮菲-Fe3+,导致其在536 nm 波长处的最大吸收值减少。加入抗氧化剂之后,因羟自由基的浓度减少,所以体系中的吸光值随之升高[20]。因此羟自由基的变化量可以根据加入样品前后吸光值的大小变化来评价,以此来判定胞外多糖清除羟自由基的能力。戊糖片球菌S44 胞外多糖对羟自由基的清除能力见表2。
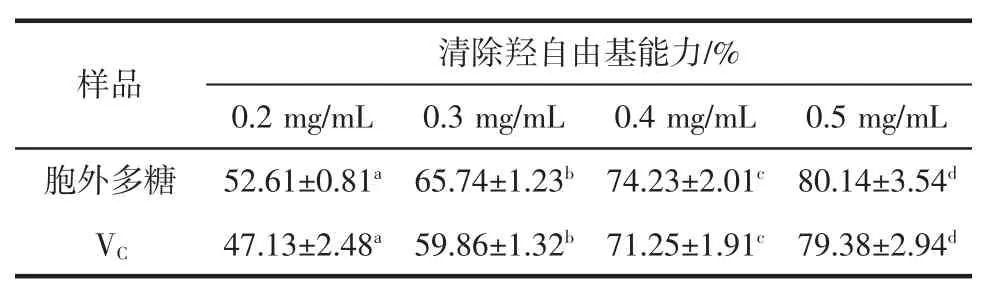
表2 胞外多糖清除羟自由基的能力Table 2 Scavenging activity of EPS against hydroxyl radical
随着胞外多糖的浓度增加,对羟自由基的清除率呈上升趋势,并且具有明显的剂量依赖关系。同浓度胞外多糖对羟自由基的清除率均高于VC的清除率,当样品浓度为0.5 mg/mL 时,胞外多糖对羟自由基的清除率可达80.14%。颜炳祥等[21]通过对乳酸乳球菌亚种的胞外多糖进行硒化,显著增强了胞外多糖对羟自由基的清除能力,使其对羟自由基的清除能力提高了34.99%,并且抑制羟自由基的能力与浓度呈现一定的相关性。故戊糖片球菌S44 胞外多糖在清除羟自由基方面也具有一定的提升空间。
2.4 胞外多糖清除超氧阴离子自由基的能力
超氧阴离子自由基是人体内产生的活性氧自由基,能引发体内脂质过氧化,加快机体的衰老过程,并可诱发一系列病变,严重危害人体健康。利用邻苯三酚在碱性条件下能迅速氧化并释放超氧阴离子自由基,生成有色中间产物的特性进行超氧阴离子自由基清除的活性检测。胞外多糖清除超氧阴离子自由基活性的结果如表3所示。
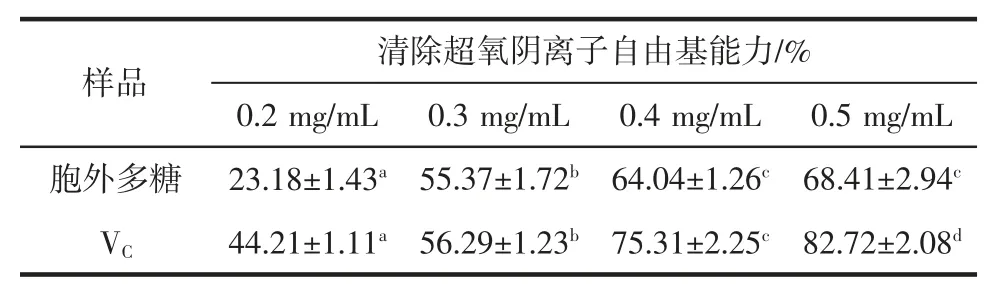
表3 胞外多糖清除超氧阴离子自由基的能力Table 3 Scavenging activity of EPS against superoxide anion free radical
从表3中可看出,随着胞外多糖浓度的升高,其清除超氧阴离子自由基的能力也随之增加,浓度与清除率呈正相关。与同浓度的VC相比,胞外多糖对超氧阴离子自由基的清除率均小于VC。纪鹃[22]从新疆酸奶中筛选到一株瑞士乳杆菌,其所产胞外多糖对超氧自由基的清除活性与其浓度呈剂量依赖性,此结果与我们的研究结果一致。
2.5 胞外多糖的还原能力
还原力是测定抗氧化能力的另一个重要指标,具有还原力的物质是通过提供氢原子来中断过氧化物的形成,破坏自由基反应链,以防止氧化反应[19]。还原能力是以普鲁士蓝的生成量为指标,由赤血盐(铁氰化钾)还原生成黄血盐,再与Fe3+作用后生成普鲁士蓝,在700 nm 波长处测定其吸光值大小判定还原能力。胞外多糖的还原能力见表4。

表4 胞外多糖的还原能力Table 4 The reducing ability of EPS
从表4中可看出,样品的浓度与其还原能力有着剂量依赖关系,即还原力随着浓度的提高而增强。当浓度为0.5 mg/mL 时,胞外多糖的还原能力比浓度为0.2 mg/mL 时提高了88.57%。与同浓度的VC相比,胞外多糖的还原能力均小于VC,浓度为0.5 mg/mL 时,VC的还原力是胞外多糖的2.85 倍。
2.6 胞外多糖对HepG2细胞抗氧化功能的影响
T-AOC 是一个全面反映机体抗氧化能力的指标,涵盖了两种作用体系的综合结果,可以直观地表征细胞抵御氧化损伤的能力。SOD 是一种重要的抗氧化酶,能消除生物体在新陈代谢过程中产生的有害物质,其活性高低可间接反映组织自由基的含量和细胞受损程度[23]。MDA 含量是细胞氧化损伤的一个重要检测指标,可通过测定MDA 的含量,了解机体内膜脂质过氧化的程度。胞外多糖对HepG2 细胞抗氧化活性的影响见表5。

表5 胞外多糖对HepG2细胞抗氧化活性的影响Table 5 The effects of EPS on antioxidant activities in HepG2 cells

续表5 胞外多糖对HepG2细胞抗氧化活性的影响Continue table 5 The effects of EPS on antioxidant activities in HepG2 cells
表5可看出,与对照组相比,模型组的T-AOC 和SOD 的活力分别显著降低了57.70 %和20.83 %(P<0.05),MDA 的含量显著增加了 48.48%(P<0.05),此结果表明,经过过氧化氢诱导的HepG2 细胞氧化损伤明显。与模型组相比,加入不同浓度的胞外多糖后,细胞中T-AOC 的活力显著提高,且随着浓度的增加,活力也随之增大。当胞外多糖浓度为0.3 mg/mL 时,细胞中 T-AOC 的活力恢复至(4.33±0.06)U/mL,与对照组相比已无显著性差异(P>0.05)。当胞外多糖浓度为0.4 mg/mL 时,细胞中SOD 的活力比模型组显著升高30.92%(P<0.05),并与对照组无显著差异。与模型组相比,加入不同浓度的胞外多糖后,细胞中MDA 的含量显著降低。当胞外多糖浓度为0.5 mg/mL 时,细胞中MDA 的含量与对照组相比无显著差异(P>0.05)。Zhang 等[24]研究发现植物乳杆菌C88 的胞外多糖可以抑制过氧化氢诱导的Caco-2 细胞中MDA 的形成,同时提高了SOD 和T-AOC 的活力,此与本研究结果一致。戊糖片球菌S44 胞外多糖能够缓解HepG2 细胞的氧化损伤,推测其可能是胞外多糖增强了细胞中酶和非酶系统的抗氧化活性,减少了脂质过氧化。
3 结论
对戊糖片球菌S44 的胞外多糖在体外的抗氧化能力进行了研究,测定了其胞外多糖对DPPH 自由基、羟自由基和超氧阴离子自由基的清除能力,及其还原能力的大小。同时,评价了胞外多糖对由过氧化氢诱导的HepG2 细胞的氧化损伤的保护作用。结果表明,胞外多糖对DPPH 自由基、羟自由基和超氧阴离子自由基均有较好的清除能力,对羟自由基的清除率可达80%以上。并且,胞外多糖能够缓解由过氧化氢诱导的HepG2 细胞的氧化损伤,提高了细胞中SOD 和TAOC 的活力,抑制了MDA 的形成。因此,戊糖片球菌S44 可作为潜在的抗氧化性能的食品添加剂应用于食品工业生产中。
