不同分子量坛紫菜多糖体内抗氧化活性研究
2019-05-09应苗苗施文正权伟
应苗苗,施文正,权伟
(1.温州科技职业学院,浙江 温州 325006;2.上海海洋大学,上海 201306)
多糖是一种普遍存在于许多植物组织、动物骨骼[1]及真菌体内[2]的大分子活性物质,具有降血糖[3]、抗肿瘤[4]、抗辐射[5-6]、抗氧化[7-8]、增强免疫力[9]等生理活性,因此多糖作为天然抗氧化剂具很高的医药开发价值。当前,海藻功能性类多糖已经成为一个新的研究领域。
坛紫菜是我国及东南亚地区常见的主要紫菜栽培品种之一,研究表明不同分子量的紫菜多糖具有不同的体外抗氧化活性[10-11],但有关不同分子量坛紫菜多糖体内抗氧化活性的报道则较少。作者在前期研究基础上,采用超滤法将坛紫菜粗多糖进行分离,通过4 种不同截留分子量的超滤膜得到5 种不同分子量的多糖:PPⅠ、PPⅡ、PPⅢ、PPⅣ和 PPⅤ,通过对 5 种不同分子量的多糖进行了体外抗氧化活性分析,实验结果表明坛紫菜多糖PPⅡ和PPⅣ对自由基清除能力较强,因此本论文通过建立衰老动物模型,主要研究坛紫菜多糖PPⅡ和PP Ⅳ不同剂量下对实验小鼠肝脏组织、脑组织和血液中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)活性及丙二醛(malondialdehyde,MDA)含量的影响,探讨坛紫菜多糖的体内抗氧化活性,以期为坛紫菜多糖的利用提供理论依据。
1 材料与方法
1.1 材料与仪器
坛紫菜样品:产自浙江省温州市洞头县东海海域。
SOD 试剂盒(WST-1 法)、GSH-PX 测试盒(100T/486 样)、CAT 试剂盒(100T/96 样)、MDA(100T/96 样)试剂盒:南京建成生物工程研究所;三氯乙酸、无水乙醇、D-半乳糖(分析纯):国药集团化学试剂有限公司。
R206 旋转蒸发仪:上海申生科技有限公司;UV/V-16/18-型紫外分光光度计:上海美谱达仪器有限公司;Sartorius天平:北京赛多利斯天平有限公司;HWS-24 数显恒温水浴锅:上海慧泰仪器制造有限公司;H2050R-台式高速冷冻离心机:长沙湘仪离心机仪器有限公司;ALPHA 2-4 真空冷冻干燥机:德国Christ 公司;W100 循环水式多用真空泵:上海申胜生物技术有限公司;JYS-M01 粉碎机:九阳股份有限公司;Vivafiow200 超滤系统:德国赛多利斯生物技术有限公司;冰箱:青岛海尔电冰箱有限公司。
1.2 方法
1.2.1 不同分子量段坛紫菜多糖的提取与制备
称取一定量的坛紫菜粉末,按液料比50∶1(mL/g)加入蒸馏水,100 ℃水浴保温2 h,减压抽滤后滤渣重复上述操作一次,合并两次多糖提取液,三氯乙酸除蛋白后分别透过分子截留量为100 000、50 000、10 000、5 000 Da 的超滤系统(Sartorius stedim,Vivafiow 200),将多糖提取物按分子量大小分为MW≥100 000 Da(PPⅠ)、50 000 Da~100 000 Da(PPⅡ)、10 000 Da~50 000 Da(PPⅢ)、5 000 Da~10 000 Da(PPⅣ)、MW≤5 000 Da(PPⅤ)五部分。各部分在负压0.01MPa、温度50 ℃的条件下旋转蒸发浓缩至原提取液的1/5,加入4 倍体积无水乙醇,边加边搅拌,沉淀多糖,而后置于4 ℃冰箱中过夜,析出的絮状物沉淀4 000 r/min 离心15 min,收集沉淀物后真空冷冻干燥,得到不同分子量段的多糖样品。
1.2.2 动物模型建立
昆明小鼠90 只,饲养一周熟悉环境后将小鼠分为9 组,每组10 只,随机分为正常对照组,衰老模型组,维生素E 组,坛紫菜多糖PPⅡ低剂量组、中剂量组、高剂量组和PPⅣ低剂量组、中剂量组、高剂量组。除正常对照组外,其余8 组每天按时皮下注射D-半乳糖100 mg/(kg·bw·d)建立模型,建模的同时给予相应剂量的多糖溶液灌胃。给药剂量分别为维生素E 组200 mg/(kg·bw·d),坛紫菜多糖PPⅡ和PPⅣ的低剂量组、中剂量组、高剂量组均分别为100、150、200 mg/(kg·bw·d)。正常对照组和衰老模型组根据小鼠体重给予相应体积的生理盐水。每天给药1 次,每周称体重1 次以调整给药剂量,连续给药60 d。最后一次给药后,所有的小鼠均禁食不禁水24 h,眼眶取血于抗凝血管中放入-80 ℃冰箱冷冻,断颈处死后取肝脏组织和脑组织在预冷的生理盐水(0.9%)中漂洗,洗净表面的血迹,滤纸吸干水分,称重后放入50 mL 离心管中。加入体积是组织块重量9 倍的冷生理盐水,用眼科小剪刀迅速剪碎组织,冰水浴组织捣碎机制备组织匀浆液,4 ℃下3 500 r/min 离心10 min,取10%匀浆上清液按照试剂盒说明书测定各抗氧化指标。
1.2.3 各项抗氧化指标的测定
1.2.3.1 谷胱甘肽过氧化物酶(GSH-Px)的测定
1)试剂盒的配制。试剂1:贮备液每瓶2 mL,移液枪准确移取0.1 mL,加入9.9mL 双蒸水,稀释100 倍,现用现配;试剂2:甲粉剂一瓶,乙液每瓶50 mL,甲粉剂加入预先加热至90 ℃~100 ℃的热双蒸水170 mL,充分溶解后加入乙液混合均匀。次为过饱和溶液,取上清进行试验,2 ℃~8 ℃保存;试剂3:粉剂,每瓶加双蒸水至200 mL 溶解;试剂4:粉剂,每瓶加双蒸水至50 mL 溶解,避光冷藏保存;试剂5:粉剂,每支加10 mL 双蒸水充分溶解,避光冷藏保存;试剂6:GSH标准品粉剂,冷藏保存。
2)最佳取样浓度的测定:由于酶的百分抑制率与酶的活力呈抛物线关系,并且样品种类不同,其最佳取样浓度也不同,GSH-Px 的活力也不同。当酶的百分抑制率在45%~55%之间时,样品浓度可认为是最佳取样浓度,所以在测定前要做预实验以确定最佳取样浓度。
分别取10%的组织匀浆用生理盐水稀释成1.0%、0.5 %、0.4 %、0.3 %、0.25 %、0.2 %、0.1 %、0.05 %一系列不同浓度组织匀浆0.2 mL 按表1进行测定。
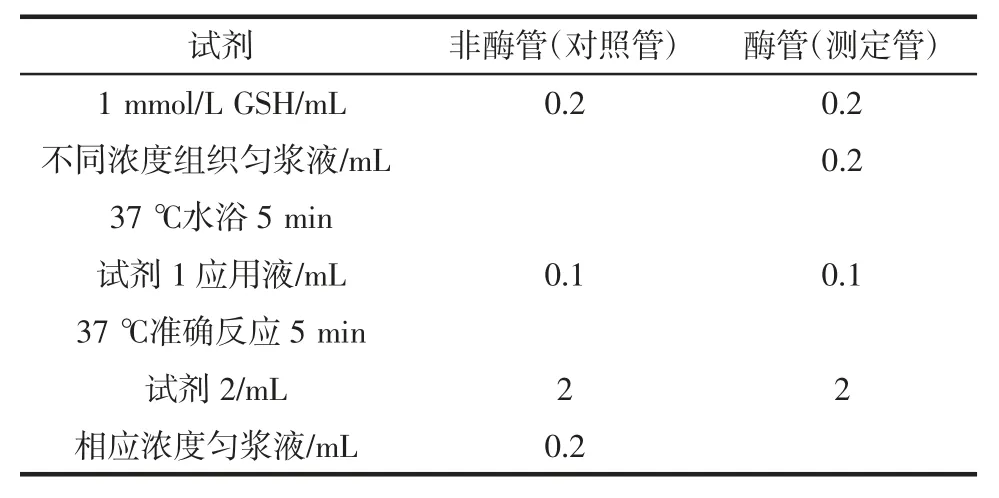
表1 酶反应试剂表Table 1 Reagent of enzyme reaction
混匀,3 500 r/min 离心15 min,取上清液1 mL 做显色反应,见表2。
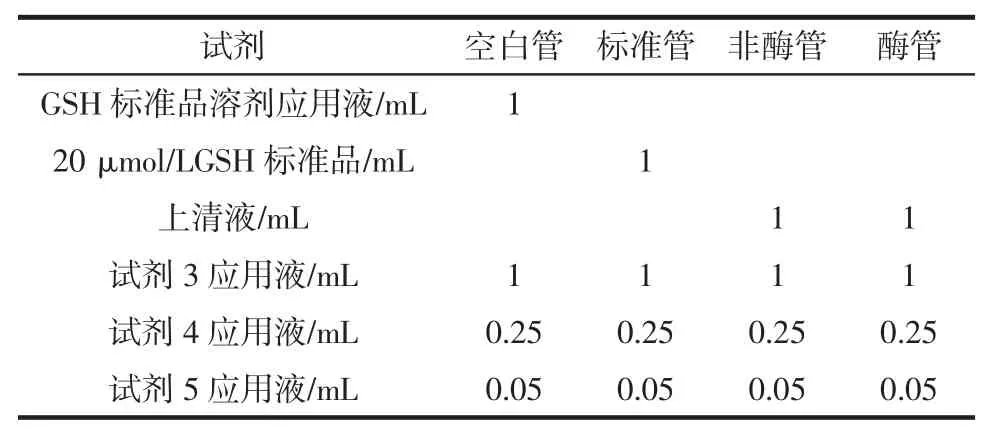
表2 显色反应试剂表Table 2 Reagent of color reaction
充分摇匀,室温静置15 min 后,在波长412 nm下,双蒸水调零,测定各管吸光度值。
抑制率/%=(对照管OD-测定管OD)/对照管OD×100
将测得的各管OD 值带入上述公式计算抑制率,选取抑制率在45%~55%之间的浓度作为最佳浓度进行后续GSH-Px 含量的测定。经计算,肝脏组织和脑组织的最佳取样浓度为0.5%的匀浆液,全血的最佳取样浓度为0.67%。
1.2.3.2 过氧化氢酶(CAT)含量的测定
测定原理:过氧化氢酶(CAT)分解过氧化氢的反应由于钼酸铵的加入而迅速终止,未反应完的过氧化氢与钼酸铵结合产生一种淡黄色的络合物,这种络合物在波长为405 nm 处有最大吸收,测定其吸光度值,可以计算出CAT 的相应活力。
试剂盒的配制:
试剂1:液体 100 mL,4 ℃冷藏。
试剂2:底物液体 10 mL,4 ℃冷藏。
试剂3:显色粉剂,加入100 mL 双蒸水充分溶解,4 ℃冷藏保存。
试剂4:液体 10 mL,4 ℃冷藏。
组织样本(肝脏组织、脑组织)操作步骤见表3。
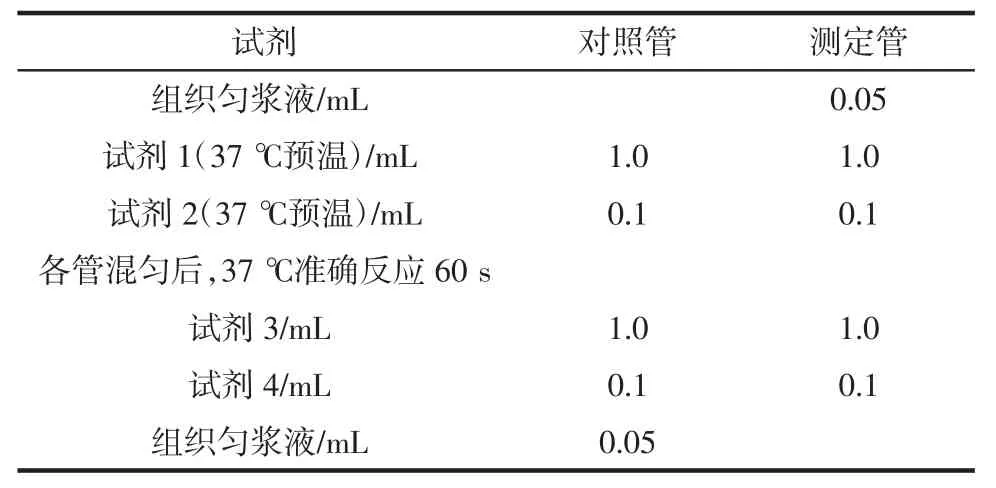
表3 组织样本操作表Table 3 Sample operation of animal tissue
混匀后,405 nm 处测定各管吸光度值,0.5 cm 光程,双蒸水调零。
全血的检测:1%溶血液的制备(取50 μL 全血加双蒸水至5 mL 充分混匀后放置10 min,待测)。操作步骤见表4。
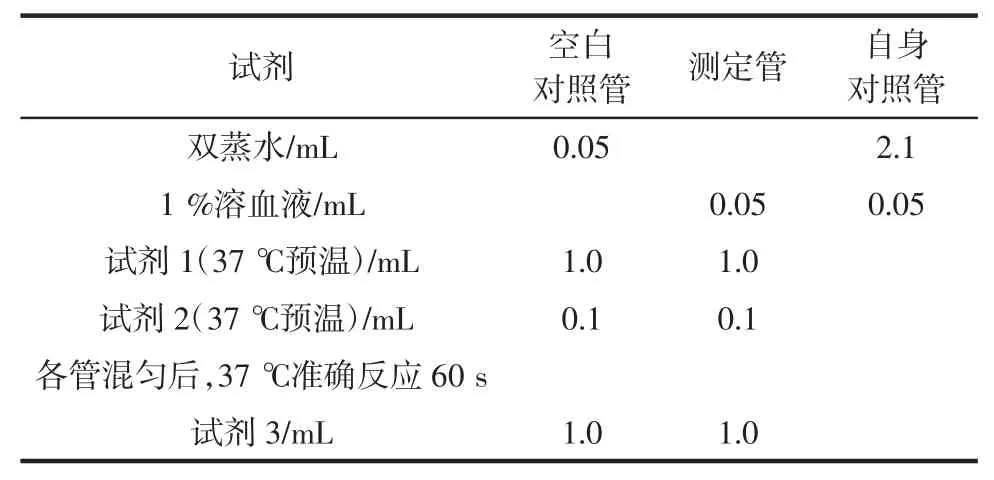
表4 组织样本操作表Table 4 Sample operation of animal blood
混匀后,波长405 nm 处测定各管吸光度值,0.5 cm光程,双蒸水调零。
1.2.3.3 超氧化物歧化酶(SOD)含量的测定
试剂1:缓冲液,15 mL,2 ℃~8 ℃保存。
试剂2:底物贮备液,0.15 mL,2 ℃~8 ℃保存。
试剂3:酶贮备液,0.30 mL,2 ℃~8 ℃保存。
试剂4:酶稀释液,4 mL,2 ℃~8 ℃保存。
操作步骤见表5。
混匀,37 ℃孵育20 min,波长450 nm,酶标仪测定吸光度值。

表5 SOD测定操作表Table 5 Operation of SOD determination
1.2.3.4 丙二醛(MDA)含量的测定
MDA 各试剂配制:试剂1(液体20 mL,室温保存);试剂 2(液体 12 mL,加 170 mL 超纯水混匀,4 ℃冷藏);试剂 3(粉剂,加入 90 ℃~100 ℃的热双蒸水 30 mL,充分溶解后再加入30 mL 的冰醋酸,混合均匀,避光冷藏);标准品(10 nmol/mL 四乙氧基丙烷5 mL,4 ℃冷藏)。
操作步骤见表6。
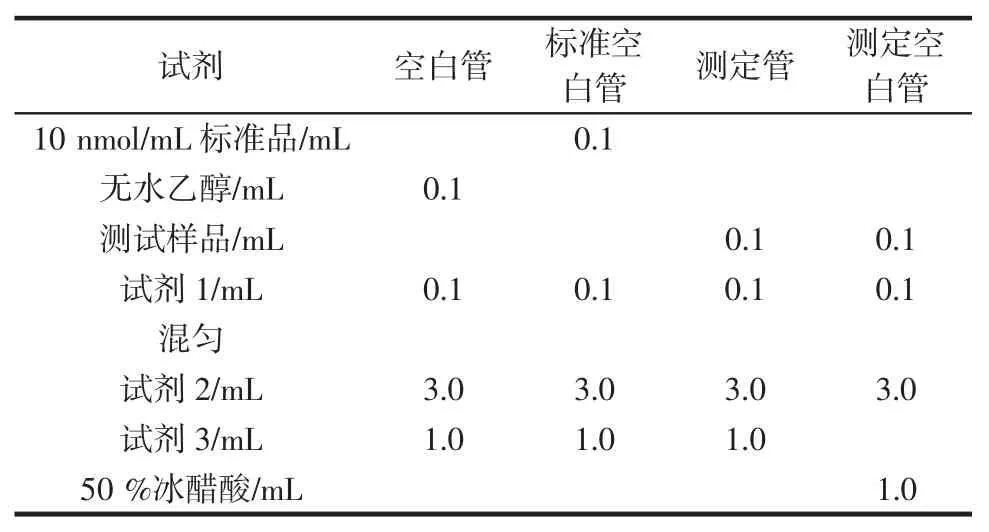
表6 MDA测定操作表Table 6 Operation of MDA determination
各管充分混匀,置于95 ℃水浴锅中保温40 min,取出后自来水淋洗冷却到室温,4 000 r/min 离心10 min,取上清液,测定波长532 nm,1 cm 光径,双蒸水调零,然后测定各管吸光度值。
1.3 数据处理
所有测定结果表示为平均数±标准差(mean±SD)(n≥3),采用SPSS16.0 软件进行单因素方差分析(One-Way ANOVA),以 P<0.05 作为差异的显著性水平。
2 结果与分析
2.1 坛紫菜多糖PPⅡ对衰老模型组小鼠的影响
坛紫菜多糖PPⅡ对衰老模型组小鼠抗氧化活性的影响,如表7所示。给小鼠连续皮下注射D-半乳糖60 d 后,与正常对照组相比,模型组小鼠肝脏组织和脑组织中SOD 和GSH-Px 活性及肝脏组织中CAT 活性显著降低(P<0.05),MDA 含量显著升高(P<0.05),说明模型建立成功。与模型组相比,坛紫菜多糖PPⅡ中剂量组和高剂量组均能显著提高实验小鼠肝脏、脑组织和血液中SOD 活性,且高剂量组SOD 活性与VE组活性相当;PPⅡ中剂量组、高剂量组肝脏组织和脑组织中CAT 含量显著升高,GSH-PX 活性显著升高,MDA含量显著下降,差异均有统计学意义(P<0.05)。坛紫菜多糖PPⅡ在低剂量时,与模型组相比,大部分的抗氧化指标均不具有统计学意义的差异,无明显的抗氧化能力。
表7 PPⅡ对衰老模型组小鼠SOD、CAT、GSH-Px和MDA的影响(±s,n=10)Table 7 Effects of PPⅡon SOD,CAT,GSH-Px and MDA in tested organs in aged mice(±s,n=10)
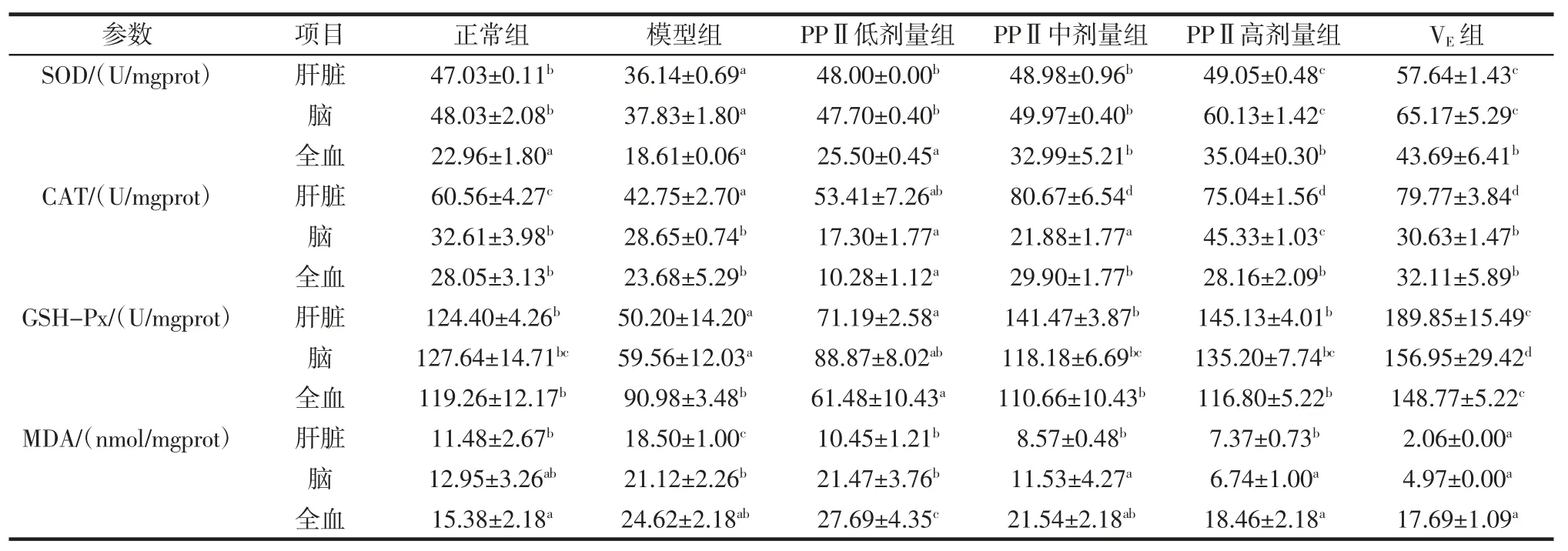
表7 PPⅡ对衰老模型组小鼠SOD、CAT、GSH-Px和MDA的影响(±s,n=10)Table 7 Effects of PPⅡon SOD,CAT,GSH-Px and MDA in tested organs in aged mice(±s,n=10)
注:同一行中不同组别间标以不同字母表示差异显著(P<0.05)。
参数 项目 正常组 模型组 PPⅡ低剂量组 PPⅡ中剂量组 PPⅡ高剂量组 VE 组SOD/(U/mgprot)肝脏47.03±0.11b36.14±0.69a48.00±0.00b48.98±0.96b49.05±0.48c57.64±1.43c脑 48.03±2.08b 37.83±1.80a 47.70±0.40b 49.97±0.40b 60.13±1.42c 65.17±5.29c全血 22.96±1.80a 18.61±0.06a 25.50±0.45a 32.99±5.21b 35.04±0.30b 43.69±6.41b CAT/(U/mgprot)肝脏60.56±4.27c42.75±2.70a53.41±7.26ab80.67±6.54d75.04±1.56d79.77±3.84d脑 32.61±3.98b 28.65±0.74b 17.30±1.77a 21.88±1.77a 45.33±1.03c 30.63±1.47b全血 28.05±3.13b 23.68±5.29b 10.28±1.12a 29.90±1.77b 28.16±2.09b 32.11±5.89b GSH-Px/(U/mgprot)肝脏124.40±4.26b50.20±14.20a71.19±2.58a141.47±3.87b145.13±4.01b189.85±15.49c脑 127.64±14.71bc 59.56±12.03a 88.87±8.02ab 118.18±6.69bc 135.20±7.74bc 156.95±29.42d全血 119.26±12.17b 90.98±3.48b 61.48±10.43a 110.66±10.43b 116.80±5.22b 148.77±5.22c MDA/(nmol/mgprot)肝脏11.48±2.67b18.50±1.00c10.45±1.21b8.57±0.48b7.37±0.73b2.06±0.00a脑 12.95±3.26ab 21.12±2.26b 21.47±3.76b 11.53±4.27a 6.74±1.00a 4.97±0.00a全血 15.38±2.18a 24.62±2.18ab 27.69±4.35c 21.54±2.18ab 18.46±2.18a 17.69±1.09a
2.2 坛紫菜多糖PPⅣ对衰老模型组小鼠的影响
给小鼠连续皮下注射D-半乳糖8 周后,坛紫菜多糖PPⅣ对衰老模型组小鼠抗氧化活性的影响,如表8所示。与正常对照相比,模型组实验小鼠肝脏组织中SOD、GSH-Px 活性和脑组织中CAT 活性显著降低(P<0.05),MDA 含量显著增加。与模型组小鼠相比,坛紫菜多糖PPⅣ低剂量组、中剂量组、高剂量组肝脏组织和脑组织中SOD 活性显著升高,且随着剂量的增加,呈现一定的量效关系;高剂量组肝脏、脑组织和血液中CAT含量显著提高;中剂量组和高剂量组肝脏组织、脑组织、血液中SOD 活性显著升高,MDA 含量显著下降,差异均具有统计学意义(P<0.05)。高剂量组各抗氧化活性指标与VE组活性相当,具有较好的抗氧化活性。
表8 PPⅣ对衰老模型组小鼠SOD、CAT、GSH-Px和MDA的影响(±s,n=10)Table 8 Effects of PPⅣon SOD,CAT,GSH-Px and MDA in tested organs in agedmice(±s,n=10)
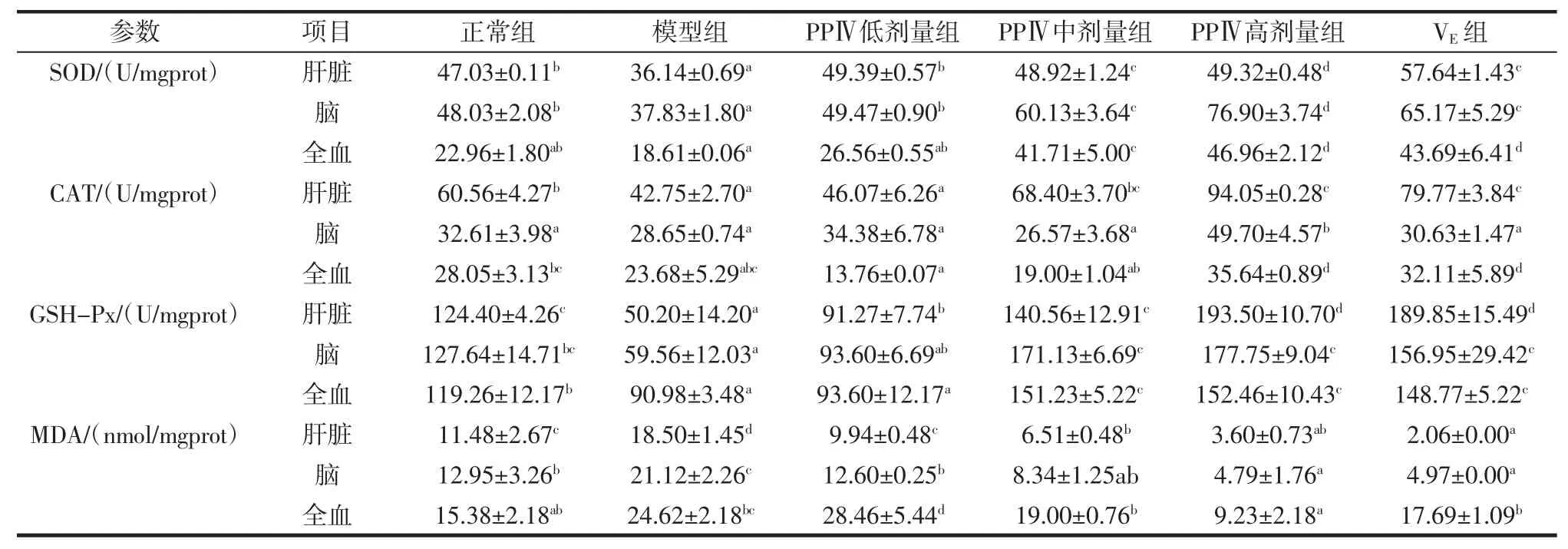
表8 PPⅣ对衰老模型组小鼠SOD、CAT、GSH-Px和MDA的影响(±s,n=10)Table 8 Effects of PPⅣon SOD,CAT,GSH-Px and MDA in tested organs in agedmice(±s,n=10)
注:同一行中不同组别间标以不同字母表示差异显著(P<0.05)。
参数 项目 正常组 模型组 PPⅣ低剂量组 PPⅣ中剂量组 PPⅣ高剂量组 VE 组SOD/(U/mgprot)肝脏47.03±0.11b36.14±0.69a49.39±0.57b48.92±1.24c49.32±0.48d57.64±1.43c脑 48.03±2.08b 37.83±1.80a 49.47±0.90b 60.13±3.64c 76.90±3.74d 65.17±5.29c全血 22.96±1.80ab 18.61±0.06a 26.56±0.55ab 41.71±5.00c 46.96±2.12d 43.69±6.41d CAT/(U/mgprot)肝脏60.56±4.27b42.75±2.70a46.07±6.26a68.40±3.70bc94.05±0.28c79.77±3.84c脑 32.61±3.98a 28.65±0.74a 34.38±6.78a 26.57±3.68a 49.70±4.57b 30.63±1.47a全血 28.05±3.13bc 23.68±5.29abc 13.76±0.07a 19.00±1.04ab 35.64±0.89d 32.11±5.89d GSH-Px/(U/mgprot)肝脏124.40±4.26c50.20±14.20a91.27±7.74b140.56±12.91c193.50±10.70d189.85±15.49d脑 127.64±14.71bc 59.56±12.03a 93.60±6.69ab 171.13±6.69c 177.75±9.04c 156.95±29.42c全血 119.26±12.17b 90.98±3.48a 93.60±12.17a 151.23±5.22c 152.46±10.43c 148.77±5.22c MDA/(nmol/mgprot)肝脏11.48±2.67c18.50±1.45d9.94±0.48c6.51±0.48b3.60±0.73ab2.06±0.00a脑 12.95±3.26b 21.12±2.26c 12.60±0.25b 8.34±1.25ab 4.79±1.76a 4.97±0.00a全血 15.38±2.18ab 24.62±2.18bc 28.46±5.44d 19.00±0.76b 9.23±2.18a 17.69±1.09b
2.3 剂量相同时多糖抗氧化活性的比较
2.3.1 低剂量时抗氧化活性的比较
低剂量时各组实验小鼠肝脏组织、脑组织和血液中 GSH-Px 活性、CAT 活性、SOD 活性及 MDA 含量如图1所示。

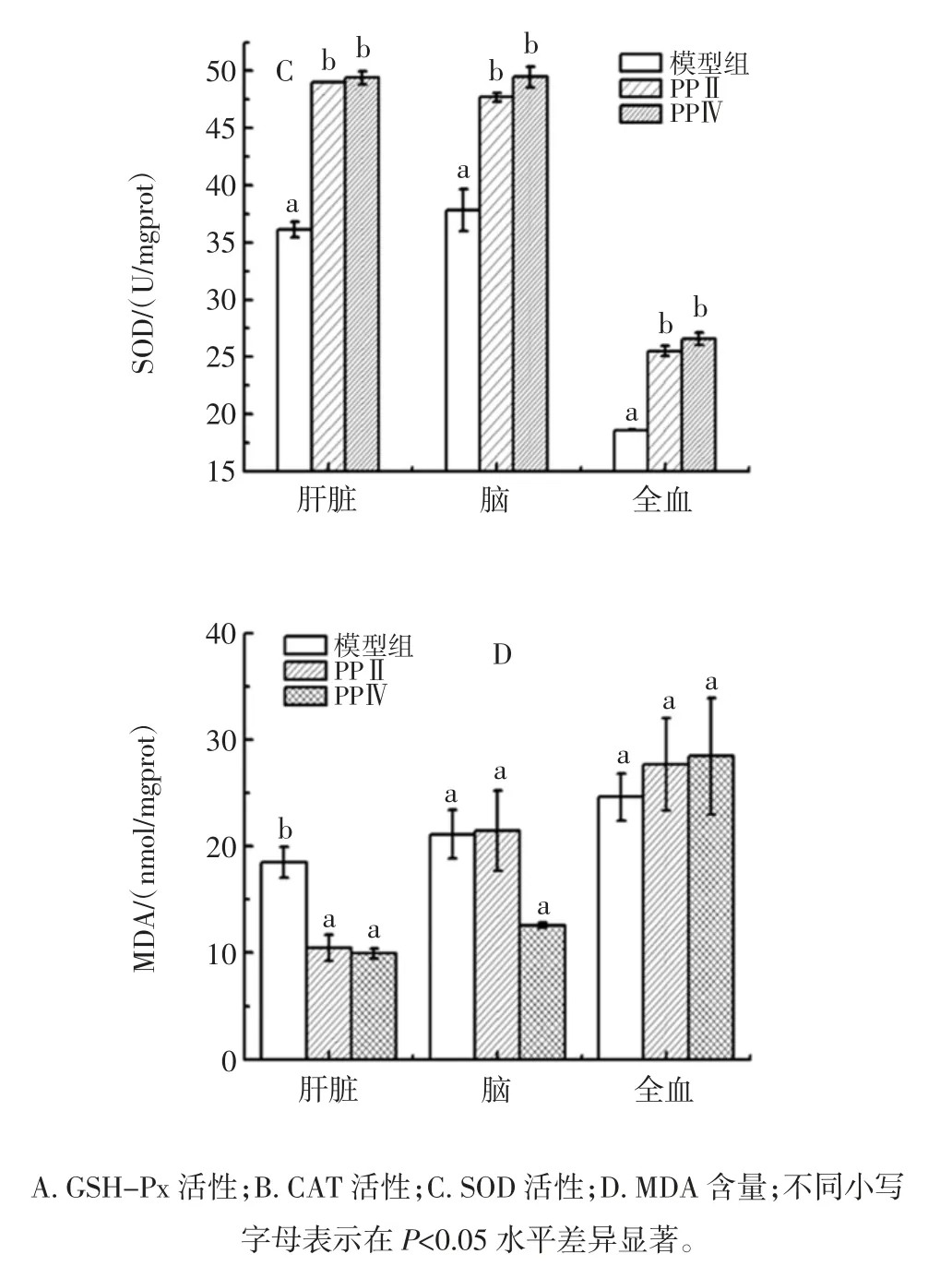
图1 PPⅡ和PPⅣ低剂量组抗氧化活性的比较Fig.1 The antioxidant effect of PPⅡand PPⅣat low dosage
与衰老模型组相比,坛紫菜多糖PPⅡ和PPⅣ低剂量组肝脏组织中GSH-Px、SOD 活性显著升高(P<0.05),MDA 含量显著下降,PPⅡ和PPⅣ低剂量组两组相比,各组织中大部分抗氧化指标均不具有统计学意义上的差异。
2.3.2 中剂量时抗氧化活性的比较
PPⅡ和PPⅣ中剂量组抗氧化活性的比较见图2。
从图2可以看出与衰老模型组相比,坛紫菜多糖PPⅡ和PPⅣ中剂量组肝脏组织、脑组织中GSH-Px、SOD 活性显著升高,MDA 含量显著下降,肝脏组织CAT 含量显著升高;在相同剂量下,PPⅣ中剂量组脑组织和血液中 GSH-Px、SOD 含量显著增加,CAT 和MDA 含量无显著性差异。可见,在中剂量组,PPⅣ组抗氧化活性较高,抗氧化能力显著优于PPⅡ组。
2.3.3 高剂量时抗氧化活性的比较
高剂量时,PPⅡ和PPⅣ组的各项抗氧化指标如图3所示。
与衰老模型组相比,肝脏组织、脑组织和血液中GSH-Px、CAT、SOD 活性均均显著增加,MDA 含量显著下降,差异具有统计学意义(P<0.05)。PPⅣ高剂量组和PPⅡ高剂量组相比,肝脏组织中GSH-Px 活性显著升高、MDA 含量显著下降;脑组织中GSH-Px、CAT、SOD 活性均显著高于PPⅡ组;血液中GSH-Px、CAT、SOD 活性均显著高于PPⅡ组,MDA 含量显著低于PPⅡ组,且具有统计学意义上的差异,综上所述,PPⅣ组各项抗氧化指标优于PPⅡ,显示出较好的抗氧化能力。
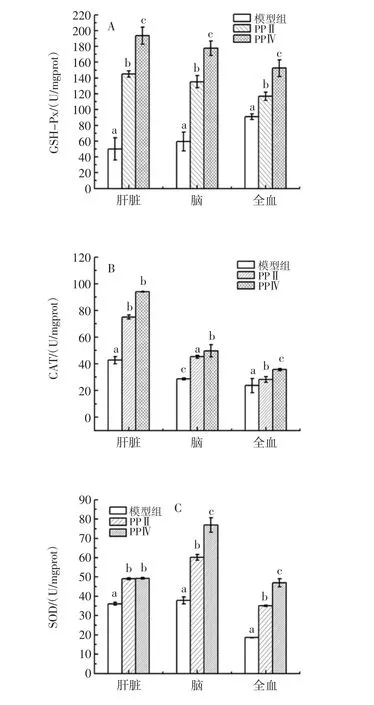
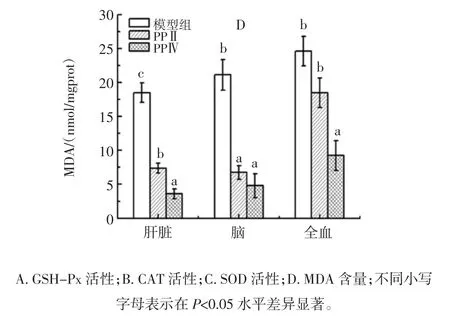
图3 PPⅡ和PPⅣ高剂量组抗氧化活性的比较Fig.3 The antioxidant effect of PPⅡand PPⅣat high dosage
3 结论与讨论
近年来,抗氧化活性是多糖的研究热点之一;自由基是机体氧化反应中产生的一类有害化合物[11],一定情况下会对机体的组织和细胞造成损伤,进而引起慢性疾病及衰老效应[12]。天然多糖作为一种具有抗氧化活性的物质,与化学合成抗氧化剂相比,具有无毒、生物相容性好等优点[13]。
SOD、GSH-Px、CAT 是生物体内几种重要的抗氧化酶,可以有效清除氧自由基,保护生物体细胞避免氧化损伤;MDA 是生物膜脂质过氧化的降解产物,是反映过氧化损伤的常用指标。抗氧化剂可以提高体内抗氧化酶(SOD、GSH-Px、CAT)的活性,清除体内自由基和脂质过氧化物,从而有效减轻自由基引起机体产生癌变、衰老和慢性疾病,增强机体免疫能力,延缓衰老[14]。
张全斌等通过建立衰老模型动物试验,研究坛紫菜多糖的抗氧化能力,结果表明,坛紫菜多糖F1 具有良好的清除自由基的作用,能够明显提高实验小鼠组织内SOD 活性和GSH-Px 的活性。
本研究采用超滤法将坛紫菜粗多糖进行分离,通过4 种不同截留分子量的超滤膜得到5 种不同分子量的多糖:PPⅠ、PPⅡ、PPⅢ、PPⅣ和 PPⅤ,前期实验结果表明坛紫菜多糖PPⅡ和PPⅣ对自由基清除能力较强,故本研究主要探讨这两种多糖的体内抗氧化活性。实验结果表明,衰老模型组小鼠在连续注射D-半乳糖60 d 后,肝脏组织、脑组织和血液中SOD、GSHPx、CAT 活性均显著下降,MDA 含量显著升高,说明本实验中的衰老模型建立成功。PPⅡ和PPⅣ的中剂量组和高剂量均组能不同程度显著提高肝脏组织、脑组织和血液中SOD 活力、GSH-Px 活力和CAT 活力,显著降低MDA 含量,表现出较好的抗氧化作用,但是PPⅣ组大部分抗氧化指标明显优于PPⅡ,坛紫菜多糖抗氧化机制及量效关系还有待进一步研究。
