胡萝卜汁对肌原纤维蛋白凝胶性质的修饰作用
2019-05-09夏民权陈银霞张丹孙卫青
夏民权,陈银霞,张丹,孙卫青
(1.长江大学食品加工与安全系,湖北 荆州 434025;2.华中农业大学食品科学系,湖北 武汉 430070;3.长江大学食品科学与工程系,湖北 荆州 434025;4.长江大学生命科学学院,湖北 荆州 434025)
肌原纤维蛋白是猪肉的骨架蛋白,占猪肉总蛋白质的50%~55%[1]。其特性在肉品的嫩度和多汁性中起着决定性的作用[2]。目前,肌原纤维蛋白凝胶的修饰作用日益成为在肉蛋白研究中最为热门的话题之一,其中很大一部分研究集中在氧化修饰作用对肌原纤维蛋白凝胶的影响上,氧化剂的选择决定其氧化类型的生成[3-4]。也有一部分研究把关注焦点放在抗氧化剂的添加在肌原纤维蛋白凝胶的氧化还原修饰上[5-6]。另一部分则集中在天然生物大分子的添加对肌原纤维蛋白的修饰作用上,如多糖[7-8],草本植物提取物[9]等。
基于对添加物和蛋白提取物纯体系的研究,考虑到蔬菜和肉品作为人们营养物质的基本来源,以及胡萝卜富含多种天然维生素,矿物质等,与肌肉在营养成分上形成有利的互补。因此,本研究选择猪里脊肉和胡萝卜为主要原料,分离提取肌原纤维蛋白和胡萝卜汁,拟向肌原纤维蛋白中添加不同含量的胡萝卜汁(0、0.5、1.0、1.5、2.0、2.5mL每2mL protein),并分别对其进行了凝胶色度,凝胶保水性(water holding capacity,WHC),凝胶流变性,及差示扫描量热法(differential scanning calorimetry,DSC)分析,旨在探究胡萝卜汁的添加对肌原纤维蛋白凝胶的修饰作用,为健康的肉制品的研发提供依据和基础。
1 材料与方法
1.1 材料与仪器
猪里脊肉、胡萝卜:湖北省荆州市荆州区中百仓储,里脊肉经宰后分装,置于4 ℃冰箱48 h 内保鲜备用;氯化钠、磷酸氢二钠、磷酸二氢钠、乙二醇双(2-氨基乙基醚)四乙酸(Ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、氯化镁、浓盐酸、甲醇、标准牛血清白蛋白、氧氧化钠、五水硫酸铜,浓氨水(以上药品均为分析纯):国药集化学有限公司。
BSA224S 电子分析天平:赛多利斯科学仪器有限公司;IKA T25 高速均质机:德国 IKA 公司;X-30R 冷冻离心机:美国贝克曼库尔特有限公司;FE20 实验室pH 计:梅特勒托利多仪器有限公司;Vortex Genie 多用途涡旋混合器:美国Scientific Industries 公司;UV-2450 紫外可见分光光度计:日本岛津公司;Discovery DHR-1 流变仪:美国 TA 公司;DSC 差式热扫描仪:瑞士Mettler-Toledo 公司;CR-400 便携式色差仪:柯尼达美能达公司。
1.2 试验方法
1.2.1 猪里脊肉中肌原纤维蛋白的提取
参考吴满刚等[10-11]的方法,取鲜嫩猪里脊肉,去除脂肪和结缔组织,用刀剁成1 cm3左右大小的方块,放入高速组织捣碎机里绞碎,均匀分装在50 mL 的离心管中,加入4 倍体积的磷酸缓冲液(0.1 mol/L NaCl,10 mmol/L NaH2PO4/Na2HPO4,2 mmol/L MgCl2,1 mmol/L EGTA,pH 7.0)冰水浴匀浆 60 s,同时,除去剩下的结缔组织,4 ℃,4 290 r/min 离心 15 min,取沉淀重复上面步骤2 次。得到沉淀加入4 倍体积的0.1 mol/L NaCl 溶液,用纱布过滤后,4 ℃,4 290 r/min 离心 15 min,重复此操作两遍,沉淀即为粗肌原纤维蛋白,4 ℃冷藏备用,48 h 内用完。
1.2.2 双缩脲法测定蛋白质含量
参考张厚锋[12]和刘燕等[13]等的方法,并稍作修改。
双缩脲试剂配制:称取1.5 g 硫酸铜和6 g 酒石酸钾钠,用500 mL 水溶解,边搅拌边加入300 mL 10 %NaOH 溶液,用水稀至1 L,贮存于塑料试剂瓶中,若瓶中有沉淀出现,则需要重新配制。标准蛋白质溶液用标准的结晶牛血清白蛋白(Bovine Serum Albumin,BSA)配制成10 mg/mL 的标准蛋白溶液,可用BSA 溶液浓度1 mg/mL 的280 nm 处的吸光度为0.66 来校正其纯度。
标准曲线:准备 6 支试管依次加入:0、0.2、0.4、0.6、0.8、1.0 mL BSA 溶液,用蒸馏水补充到 1 mL。加入4 mL 双缩脲试剂,在25 ℃水浴条件下水浴30 min。在540 nm 波长光测定吸光度值,重复3 次。以3 组的平均值绘制标准曲线。
样品测定:准备5 支试管,2 支试管加入1 mL 磷酸缓冲液,另外3 支加入1 mL 待测蛋白样品,加入4 mL 双缩脲试剂,25 ℃水浴 30 min,540 nm 波长光测定吸光值。因为样品浓度不能超过10 mg/mL,故测定时需配制适当浓度蛋白混合液进行测定。
以蛋白浓度为横坐标(mg/mL),以吸光度为纵坐标(Abs),通过Excel 分析并绘制标准曲线,建立回归方程:Y=0.514 6x+0.004,R2=0.999 1,发现线性关系良好,可以用于本试验的定量分析。
1.2.3 胡萝卜汁-肌原纤维蛋白凝胶的制备
称取25 g 胡萝卜加水榨汁250 mL,粗胡萝卜汁的浓度为200 mg/mL(相对于胡萝卜不加水榨汁而言)。先将肌原纤维蛋白溶于适量的磷酸缓冲液(0.6 mol/L NaCl,50 mmol/L Na2HPO4/NaH2PO4,pH 6.0),取 2 mL蛋白依次加入 0、0.5、1.0、1.5、2.0、2.5 mL 的胡萝卜汁于10 mL 的离心管中,加水使混合物为4.5 mL,调整蛋白浓度约为30 mg/mL,依次编号。蛋白混合物需搅拌5 min 以使蛋白混合均匀。凝胶制备方法参考Zhou等[14]的方法,4 ℃冰箱中静置6 h 后,置于水浴锅中,以大约 1 ℃/min 的速率从 20 ℃线性升温到 70 ℃,在 70 ℃保温20 min 后,将离心管迅速取出,放在冰水中迅速冷却,然后置于4 ℃冰箱冷却过夜,第二天进行样品指标测试。
1.2.4 胡萝卜汁对肌原纤维蛋白凝胶色度的影响
参照杨雪红[15]的方法并作修改,将冰箱中制好的蛋白质凝胶取出,平衡到室温,用刀横向切出5 mm 的圆柱薄片(两面需平整),室温下,用色度仪测出样品的L、a、b 值。白度值(W)和彩度值(C)用下面公式计算:

式中:L 为样品的亮度;a 为红绿值;b 为黄蓝值。
1.2.5 胡萝卜汁对肌原纤维蛋白凝胶保水性的影响
参照Chen 等[16]的方法并做修改,先称离心管重W,将制好的凝胶放入离心管中,称其重量M,然后4 ℃,8 000 r/min,离心 10 min,倒出水分后,称其质量m。保水性用下面公式计算:
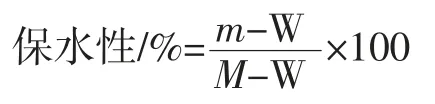
1.2.6 胡萝卜汁对肌原纤维蛋白凝胶流变性的影响
参考彭晓蓓等[17]和余振宇等[18]的方法,通过使用锥板型流变仪测定肌原纤维蛋白在不同剪切速率下的剪切应力变化。流变仪参数设置如下:夹具为50 mm锥转子,狭缝为1.0 mm。所有样品进行3 次平行测定。
1.2.7 胡萝卜汁对肌原纤维蛋白凝胶DSC 变化的影响
方法参考Yao 等[19]和刘长姣等[20]的方法并做适当的调整,取样品约100 mg 加入铝坩埚中,密封。取一个空铝坩埚作为参照,所有样品从25 ℃~160 ℃以5 ℃/min的速率进行扫描。每个处理进行3 次重复测定。
1.3 数据处理
以上试验,每组样品均进行3 次平行试验,采用Excel 计算均值和标准差,结果以“均值±标准差”的形式表示,并用Excel 绘图。
2 结果与分析
2.1 胡萝卜汁对肌原纤维蛋白凝胶色度的影响
胡萝卜汁对肌原纤维蛋白凝胶色度的影响结果如图1所示。

图1 胡萝卜汁添加量对肌原纤维蛋白凝胶色度的影响Fig.1 Effect of carrot juice on the colorimetry of myofibrillar proteins gel
随着胡萝卜汁的添加量的增加,肌原纤维蛋白凝胶的白度值逐渐降低,彩度值逐渐增加,这很大一部分是因为胡萝卜汁本身自带的颜色,也可能是因为胡萝卜汁的某些成分与蛋白质结合,结合越紧密,颜色越深。这一结果可能对肉制品在蒸煮过程中的色素损失,有一定的弥补作用。
2.2 胡萝卜汁对肌原纤维蛋白凝胶保水性的影响
胡萝卜汁对肌原纤维蛋白凝胶保水性的影响如图2所示。

图2 胡萝卜汁添加量对肌原纤维蛋白凝胶保水性的影响Fig.2 Effect of carrot juice on WHC of myofibrillar proteins gel
与空白组相比,随着胡萝卜汁的添加量的增加,当体系中的胡萝汁的量低于1.5 mL 时,凝胶的保水性是逐渐增加的,当超过1.5 mL 时,保水性逐渐变差。两个因素直接影响着凝胶的保水性:一是给水分的存留留出足够的空间,二是存留水分的作用力足够大[21]。本试验中,当胡萝卜汁的量低于1.5 mL 时,胡萝卜汁可能对凝胶形成良好的网状空间结构有着直接的促进作用,也可能存在某些带电荷的离子附着在凝胶上,使其对水的吸附力增加,从而导致其保水性增加。当样品中的胡萝卜汁的量超过1.5 mL 时,过量的胡萝卜汁可能填充了凝胶的网状结构,从而使其持水空间缩小,也可能是因为凝胶微观结构的改变,使疏水基团的过度暴露而导致保水性的降低,这一结果与张慧芸等[22]的研究结果相似。
2.3 胡萝卜汁对肌原纤维蛋白凝胶流变性的影响
胡萝卜汁对肌原纤维蛋白凝胶流变性的影响结果如图3所示。
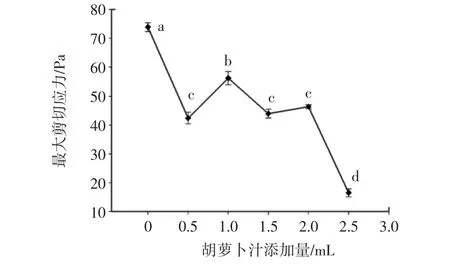
图3 胡萝卜汁添加量对肌原纤维蛋白凝胶最大剪切应力的影响Fig.3 Effect of carrot juice on maximum shear stress of myofibrillar proteins gel
由图3所知,随胡萝卜汁的量的增加,凝胶的最大剪切应力逐渐减小,且当胡萝卜汁超过2 mL 时,最大剪切力急剧下降。
图4为肌原纤维蛋白凝胶的最大黏度随胡萝卜汁的添加量的增加的变化情况,其变化趋势类似于最大剪切应力。
由图4可知,蛋白质的剪切应力和黏度变化能间接反映蛋白质凝胶分子之间的相互作用力,二硫键和疏水作用的大小和稳定性[23]。由此,可以推断出,胡萝卜汁中的某些还原性物质,能还原二硫键,而导致分子间通过二硫键结合的作用力降低,也有可能是胡萝卜汁中的某些带电荷的分子,附着在肌原纤维蛋白凝胶的表面,导致其微观结构发生改变,使其疏水基团的暴露增加,而导致凝胶分子间的作用力的稳定性降低,从而随胡萝卜汁添加量的增加,肌原纤维蛋白凝胶的最大剪切应力和最大黏度值表现出下降的趋势。
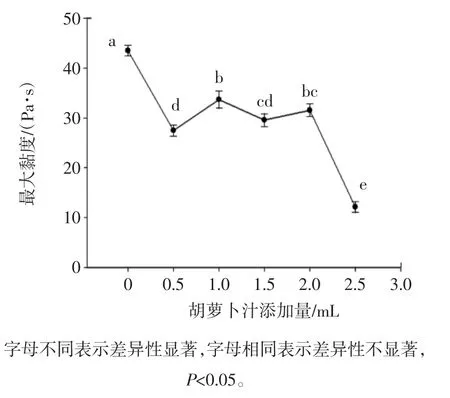
图4 胡萝卜汁添加量对肌原纤维蛋白凝胶最大黏度的影响Fig.4 Effect of carrot juice on maximum viscosity of myofibrillar proteins gel
2.4 肌原纤维蛋白凝胶DSC扫描
肌原纤维蛋白凝胶DSC 扫描结果如图5所示。

图5 肌原纤维蛋白凝胶DSC扫描图谱Fig.5 DSC scanning atlas of myofibrillar proteins gel
肌原纤维蛋白凝胶的DSC 扫描的整个过程表现出放热趋势。分析表1和表2的数据可以得出,随胡萝卜汁的量的增加,凝胶外推起始温度(Teo)和凝胶熔点(Tm)先增加后减少,在1.5 mL 添加量时,Teo最大为102.3 ℃,Tm最大为 125.8 ℃;焓值(Hm)则表现出持续增加的趋势;凝胶玻璃态转变温度(Tg)在2.0 mL 胡萝卜汁的添加量时,有最大值为143.8 ℃。热转变温度能反映肌原纤维蛋白凝胶在温度变化过程中的有关信息的变化情况,如蛋白质空间构象的变化、热稳定性、热变性动力学、热变性的原因等[24]。当胡萝卜汁的添加量少于1.5 mL 时,Teo和Tm的增加,可能是因为低浓度下,胡萝卜汁直接促进了蛋白质凝胶网状结构的形成,也可能是因为胡萝卜汁中某些带电荷分子的附着,使凝胶分子间的作用力增强,使其热稳定性增加,也有可能与形成了热稳定性更好的复合物有关[25]。而当胡萝卜汁的浓度超过1.5 mL 时,过量的胡萝卜汁填充了肌原纤维蛋白凝胶的网状结构,也可能是凝胶表面电荷量的过量增加,导致其微观结构改变疏水基团暴露,疏水性增加,从而使稳定性降低,这一结果与上述保水性的结论一致。焓值反应了整个升温过程中,凝胶体系的整体热量变化。Tg反映出蛋白质凝胶相转变需要的温度,间接反映了蛋白凝胶结构的热稳定性,Tg越大,凝胶体系越稳定。总体来说,当胡萝卜汁的添加量为1.5 mL 时,凝胶的热稳定状态是最佳的。
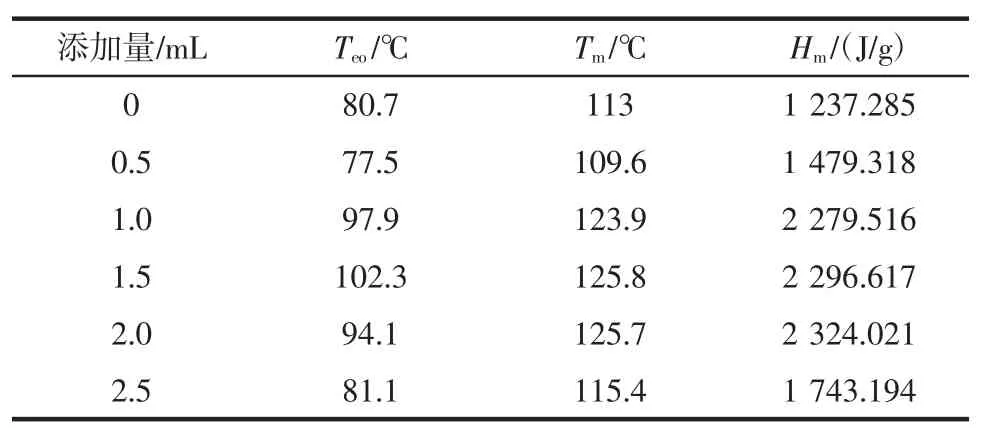
表1 胡萝卜汁添加量对肌原纤维蛋白凝胶熔点(热焓)的影响Table 1 Effect of carrot juice on the melting point(heat enthalpy)of myofibrillar proteins gel

表2 胡萝卜汁添加量对肌原纤维蛋白凝胶转变温度的影响Table 2 Effect of carrot juice on the transformation temperature of myofibrillar proteins gel
3 结论
本研究选择胡萝卜和猪里脊肉为试验原材料,分离提取肌原纤维蛋白和胡萝卜汁,探究不同的胡萝卜汁的添加量对肌原纤维蛋白凝胶性质修饰作用。结果发现,随着胡萝卜汁添加量的增加,凝胶白度值下降,彩度值上升,整体色度趋向于亮橙色,有利于弥补肉品在蒸煮过程中的色度的损失;保水性对胡萝卜汁的剂量依赖关系,表现为先上升后下降的趋势,结合不同比例的胡萝卜汁-肌原纤维蛋白凝胶的最大剪切应力和最大黏度值的变化,以及DSC 的结果,整体反映出当胡萝卜汁的添加量为1.5 mL 时,肌原纤维蛋白凝胶的热稳定性以及保水性和凝胶品质相对较好。
