薏仁米糠多肽的功能特性研究
2019-05-09杨华连卢红梅任勰珂
杨华连,陈 莉*,卢红梅,任勰珂,杨 新
(1.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025)
薏仁米(Coix chinensisTod)是一种集营养、保健、美容等多种功效于一身的原材料[1-5]。贵州省是我国主要的薏仁米生产区之一,黔西南州兴仁县被授予“中国薏仁米之乡”的称号。薏仁米产业为该县带去了前所未有的机遇,促进了当地经济发展。但目前该县的薏仁米加工企业主要还在采用粗放型的加工模式,产品较为单一,精深加工不足,生产设备落后,综合利用率不高,这些短板制约了相关市场的拓展和新兴产品研发,也影响了薏仁米生产加工企业经济效益的提高。薏仁米糠是薏仁米加工过程中的主要副产物[6],富含蛋白质、米糠油、多糖、植酸钙[7]等营养成分,有益于人体健康及某些疾病的预防和治疗。米糠多肽是以米糠蛋白为原料制得的一种天然植物蛋白肽[7],具有抗氧化、降血压、促进发育等功效,安全性较高,在食品、医疗、美容等领域[8]具有很好的研究价值和意义。目前较为常见的植物蛋白原料是玉米和豆类[9],而对米糠蛋白多肽的研究,特别是薏仁米糠多肽的研究较少。
本研究以实验室自制的薏米糠蛋白为原料,通过双酶分步酶解得到薏仁米糠多肽,分析其功能特性指标在不同的pH值和温度条件下的变化趋势,以期为薏米糠多肽在食品工业中的应用奠定基础,促进薏米糠相关产业发展[10-13]。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
薏仁米糠:贵州兴仁县某食品有限公司。
1.1.2 试剂
氢氧化钠、硼酸、浓硫酸、石油醚、硫酸钾、三氯乙酸、十二烷基硫酸钠、盐酸、无水硫酸铜、大豆色拉油、氯化钠等(均为分析纯)、酪蛋白磷酸肽(生化试剂):美国Sigma公司。
双缩脲试剂:将1.5 g硫酸铜及6.0 g酒石酸钾钠溶于500 mL蒸馏水中,搅拌加入300 mL 10%NaOH溶液,加蒸馏水定容至1 000 mL。
1.2 仪器与设备
SH2石墨消解仪:济南海能仪器股份有限公司;K9840自动凯氏定氮仪:济南海能仪器股份有限公司;DHG-9070B电热恒温鼓风干燥箱:上海琅玕实验设备有限公司;HH-b型数显恒温水浴锅、80-2电动离心机:常州奥华仪器有限公司;2D-2A自动电位滴定仪:上海大普仪器有限公司;CJJ-781磁力加热搅拌器;城西晓阳电子仪器厂;FW-80万能粉碎机:上海仕元科学器材有限公司;722S可见分光光度计:上海菁华科技仪器有限公司;XHF-D高速内切式匀浆机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 样品制备
参照参考文献[14]提取薏仁米糠蛋白,具体操作步骤:
脱脂薏仁米糠→碱液浸泡提取→离心→上清液等电点沉淀→静置、离心→沉淀物→水洗至中性→真空干燥→薏仁米糠蛋白
参照参考文献[15]提取薏仁米糠多肽,具体操作步骤:
薏仁米糠蛋白溶液→双酶分步酶解(先加2%中性蛋白酶酶解180 min,再加2%碱性蛋白酶酶解120 min)→灭酶离心分离→薏仁米糠多肽液→真空冷冻干燥→薏仁米糠多肽
1.3.2 薏仁米糠多肽溶解性的测定
采用参考文献[16]的方法,结果以氮溶解指数(nitrogen solubilityindex,NSI)表示。在烧杯中配制1%的多肽液,调节不同梯度的pH(2.0、3.0、4.0、5.0、6.0、7.0、8.0)及温度(20 ℃、25℃、30℃、35℃、40℃、45℃、50℃),恒温水浴30 min后,3000r/min离心15 min,取1 mL上清液于试管中,加入4 mL双缩脲试剂,涡轮混匀器混匀1min,室温条件下放置30min,于波长540 nm处测定吸光度值。用10 mg/mL的酪蛋白磷酸肽(casein phosphopeptides,CPP)溶液在相同条件下测定其吸光度值,绘制标准曲线,得到线性方程为y=0.058 3x-0.0062(R2=0.999 3)。NSI的计算公式如下:

1.3.3 薏仁米糠多肽乳化性及乳化稳定性的测定
参照参考文献[17]的方法,配制1%的多肽溶液,调节不同梯度pH(2.0、3.0、4.0、5.0、6.0、7.0、8.0),取5 mL样液加入5 mL大豆色拉油,调节不同的温度(20℃、30℃、40℃、50℃、60℃、70℃、80℃),恒温水浴30 min。10 000 r/min高速均质30 s,形成均一的乳化液,2 500 r/min离心5 min,测量离心管中乳化层的高度以及液体的总高度。
将乳化后的多肽液,在80℃条件下恒温水浴30 min,2 500 r/min离心10 min,计算样品的乳化稳定性。薏仁米糠多肽的乳化性及乳化稳定性计算公式如下:

1.3.4 薏仁米糠多肽起泡性及泡沫稳定性的测定
采用参考文献[17]的方法。配制浓度为5%的多肽溶液,调节pH(2.0、3.0、4.0、5.0、6.0、7.0、8.0)及温度(20 ℃、25 ℃、30℃、35℃、40℃、45℃),恒温水浴30min,10000r/min高速均质3 min,液面高度计为h1,静置30 min后液面高度记为h2。多肽的起泡性及泡沫稳定性计算公式如下:

1.3.5 薏仁米糠多肽持水性(water holding capacity,WHC)的测定
参照参考文献[18]的方法,结果以每克多肽样品吸附水的质量表示。称取一定质量(m1)的多肽样品于干燥离心管(质量m0)中,加蒸馏水溶解,调节pH值(2.0、3.0、4.0、5.0、6.0、7.0、8.0)及温度(20℃、25 ℃、30℃、35℃、40℃、45 ℃、50 ℃),恒温水浴30 min,然后4 000 r/min离心15 min,除去上清液后称量离心管质量(m2包含残留物),多肽持水力计算公式如下:
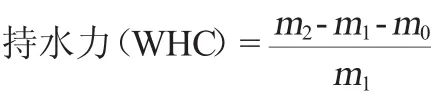
1.3.6 吸油性测定
采用参考文献[20]的方法,结果以每克多肽样品吸附油的质量表示。称取1 g多肽样品于10 mL离心管中,加入大豆色拉油3 mL,将样品和大豆色拉油混匀,于室温条件下静置6 h,在1 000 r/min条件下离心20min,吸去上层未被吸附的色拉油,称质量,参照下式计算样品吸油性:

式中:m0为蛋白质量,g;m1为蛋白质量+离心管质量,g;m2为吸油后蛋白质量+离心管质量,g。
2 结果与分析
2.1 pH值及温度对薏仁米糠多肽溶解性的影响
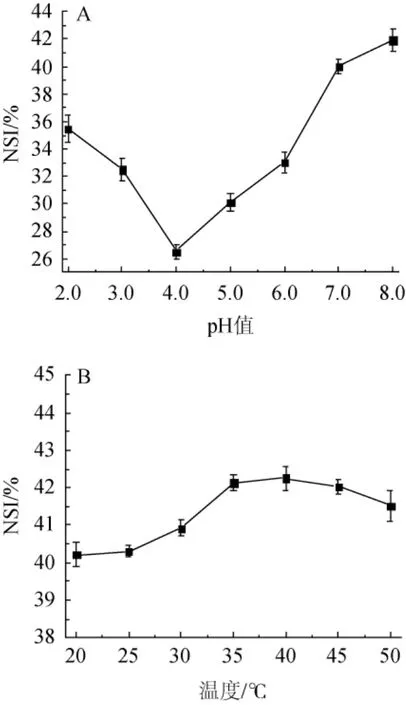
图1 pH值(A)、温度(B)对多肽溶解性的影响Fig.1 Effect of pH(A)and temperature(B)on the solubility of polypeptide
由图1A可知,pH值对多肽NSI的影响很明显,随pH值的增大,多肽的NSI先降低后升高,当pH值为4.0时,多肽溶解性最低,为26.50%。薏仁米糠多肽等电点为pH4.2左右,在等电点附近,仅带有少量电荷的多肽以中性离子的方式存在,多肽与溶剂之间的相互作用较弱,多肽分子间作用频率增加,分子聚合导致了沉淀的产生,因此,溶解性降至较低水平;当调节体系的pH偏离等电点时,带有电荷的多肽分子产生了静电排斥力,分散性能提升,多肽的溶解性增加[20]。
由图1B可知,随着温度的升高,薏仁米糠多肽的NSI呈现出先升高后降低的趋势,35℃时NSI达到最大值,为42.13%,这是因为低温不利于水分子、蛋白质分子间的相互作用,随着温度的升高,多肽分子的立体结构得以伸展,表面积增加,增强了与水分子间的相互作用,溶解度增大;随着温度升至40℃左右时,肽键的特定结构受到破坏[21],疏水基团暴露,产生沉淀,溶解度降低。
2.2 pH值及温度对薏仁米糠多肽乳化性及乳化稳定性的影响
2.2.1 pH值对薏仁米糠多肽乳化性及乳化稳定性的影响
由图2可知,薏仁米糠多肽乳化性随pH值的增大呈先降低后升高的趋势,pH值为5.0时达到最低值,为50.52%;乳化稳定性随着pH值的增大而升高,在pH 5.0~8.0的范围内上升较迅速,在pH值为8.0时达到最大值,为87.15%。这是因为酶解制得小分子多肽,制取过程中疏水性氨基酸侧链外露,碱性条件提高了多肽分子的亲油性,蛋白质分子中静电荷数量上升、分布范围扩大,多肽分子与油滴间吸引力增强,界面张力减小,乳化稳定性增强。
2.2.2 温度对薏仁米糠多肽乳化性及乳化稳定性的影响
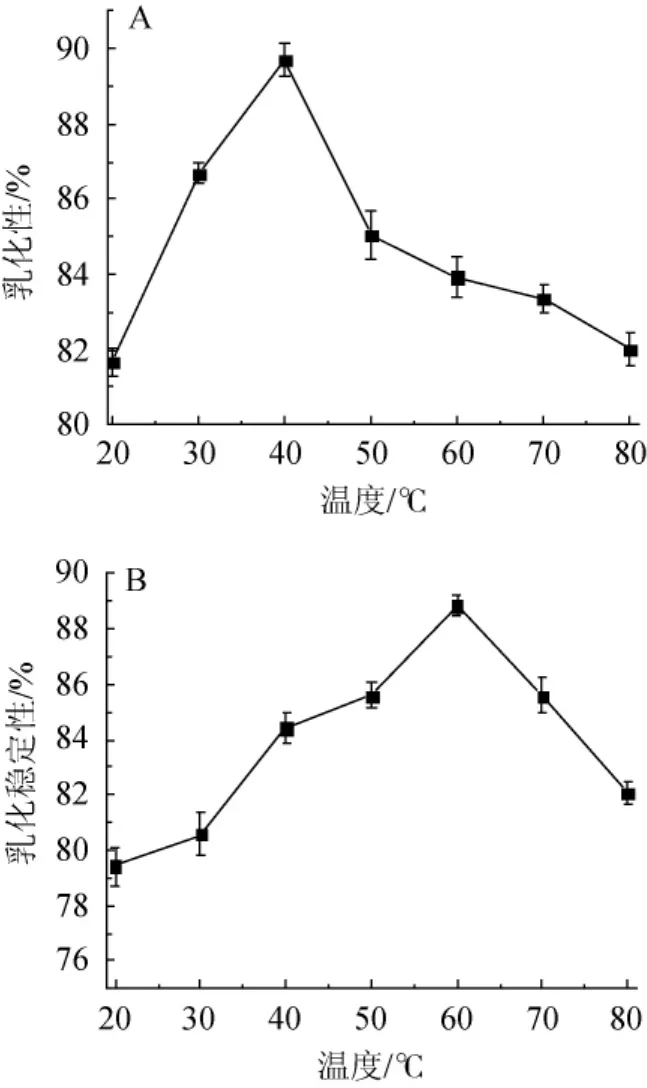
图3 温度对多肽乳化性(A)及乳化稳定性(B)的影响Fig.3 Effect of temperature on polypeptide emulsibility(A)and emulsifying stability(B)
由图3可知,随着温度的升高,多肽的乳化性和乳化稳定性均呈现先升高后降低的趋势。多肽乳化性在20~40℃范围内随温度的升高而升高,在40℃时达到最大值,为89.72%;多肽的乳化稳定性在20~60℃范围内随温度的上升而升高,60℃达到最大值,为88.75%。之后,温度继续上升,多肽的乳化性及乳化稳定性均开始降低。这是由于适度的升温增大了多肽分子的接触表面积,有利于多肽分子吸附在油水界面,但若温度过高,多肽溶解性降低产生沉淀,乳化颗粒的运动频率提高,水油界面上多肽分子的凝胶作用受到阻碍[22],多肽的乳化性和乳化稳定性开始降低。
2.3 pH值及温度对薏仁米糠多肽起泡性和泡沫稳定性的影响
2.3.1 pH值对薏仁米糠多肽起泡性及泡沫稳定性的影响
图4 pH值对多肽起泡性(A)和泡沫稳定性(B)的影响Fig.4 Effect of pH on polypeptide foaming ability(A)and foaming stability(B)
由图4可知,多肽的起泡性随pH增大而升高,这种变化趋势与溶解性有一定的相关性,溶解性随着pH值增大先降低后升高,pH值上升初期(即在等电点附近)溶解度差,蛋白浓度偏低,导致形成的泡沫数量比较少,所以起泡性比较差,当pH>5.0后,随着溶解性的增加,起泡性快速上升。pH值为8.0时,多肽的起泡性达到最大值,为287%。多肽的起泡稳定性则随着pH增大呈现出先降低后增大的变化趋势。酶解制备多肽使得多肽的疏水性氨基酸残基暴露,从而使多肽分子吸附在气-水界面上,界面张力降低,泡沫稳定性较高。酶解作用使得形成的肽链较短,在pH5.0~7.0范围内小分子肽不易在界面形成交联网状结构的稳定液膜,形成的泡沫迅速崩塌,泡沫稳定性较差[23],于pH6.0处达到最低值,为88.07%。
2.3.2 温度对薏仁米糠多肽起泡性及泡沫稳定性的影响
由图5可知,随着温度的升高,多肽的起泡性和泡沫稳定性都呈现出先升高后降低的变化,分别在35℃、25℃达到最大值,分别为410.21%、80.58%。在20~35℃之间时,多肽起泡性随温度的升高而增大,这是由于温度升高,分子运动加剧,溶解性增加,多肽浓度提高,产生的泡沫体积增加,多肽分子界面吸附能力变大,起泡性提高;泡沫稳定性取决于多肽浓度、体系的黏度等,多肽制备过程中蛋白酶作用使得疏水性氨基酸残基暴露于多肽分子外,使多肽泡沫稳定性具有较高的起始值,随着水浴温度提高,泡沫稳定性先升高后降低。

图5 温度对多肽起泡性(A)和泡沫稳定性(B)的影响Fig.5 Effect of temperature on polypeptide foaming ability(A)and foaming stability(B)
2.4 pH值及温度对薏仁米糠多肽持水力的影响
由图6A可知,薏仁米糠多肽持水性随着pH值的增大都呈现先下降后升高的变化趋势,这与多肽的溶解性具有较大的关联。在pH4.0时,分子带电荷少,分子之间的相互作用强,多肽分子和水分子之间的相互作用被削弱,持水力较低,为6.30%;偏离等电点时,多肽分子带的正负电荷之间具有的相互作用力使多肽结构膨胀,与水分子的结合较好,持水力维持一个较高值。
由图6B可知,多肽的持水力随着温度的升高总体上呈一个先缓慢升高后快速下降的变化趋势,薏仁米糠多肽在50℃、60℃时持水力分别为8.52%、8.67%,80℃时持水性降为最低值,为6.81%。随着温度的升高,分子运动加快,促进了多肽分子对水分的吸收,导致持水力增强,当温度超过一定限度之后,部分多肽开始聚集沉淀,多肽分子与水分子之间的有效作用面积减少,因此持水力较低。

图6 pH值(A)、温度(B)对多肽持水力的影响Fig.6 Effect of pH(A)and temperature(B)on polypeptide water holding capacity
2.5 薏仁米糠多肽吸油性
薏仁米糠多肽的吸油性为2.17%,利用薏仁米糠多肽较高的吸油性,可将其添加至食品中,起到促进脂肪代谢,提高人体代谢水平的作用[24]。
3 结论
本实验以实验室自制的薏仁米糠多肽为实验材料,测定6种功能特性指标,研究其在不同的pH值和温度条件下的性质差异。结果表明,多肽溶解性在pH4.0时达到最低值,为26.50%;在35℃时达到最大值,为42.13%;乳化性在pH5.0时达到最低值,为50.52%,在40℃时达到最大值,为89.72%;持水性在pH4时达到最低值,为6.30%,在80℃时达到最低值,为6.81%;而乳化稳定性和起泡性在pH5.0~8.0范围内随pH的升高而增强,均在pH8时达到最大值,为87.15%、287%;乳化性稳定性在60℃时达到最大值,为88.75%,起泡性在35℃时达到最大值,为410.21%;而泡沫稳定性在pH6.0时达到最低值,为88.07%,在25℃时达到最大值,为80.58%;薏仁米糠多肽的吸油性为2.17%。目前,国内外对于薏仁米糠多肽的研究较少,对多肽的功能性质、营养价值、品质改良以及在食品工业中的应用研究都是现阶段极具潜力的研究方向。
