PCR-DGGE法分析酸菜中乳酸菌的多样性
2019-05-09燕平梅魏爱丽李润花赵文婧陈燕飞
燕平梅,魏爱丽,李润花,李 娜,赵文婧,陈燕飞
(1.太原师范学院 生物系,山西 太原 030619;2.土壤消毒活化绿色产业技术创新战略联盟,山西 太原 030619)
酸菜是日常生活中常见的发酵类食品,含有大量的可食用营养成分,浸制的过程能产生天然的植物酵素,具有保持胃肠道正常生理功能的作用[1],酸菜发酵中乳酸菌起重要的作用[2-6]。酸菜发酵过程中会产生硝酸盐和亚硝酸盐,亚硝酸盐是一种化学致癌物,医学研究证明,人体摄入的硝酸盐在细菌的作用下,可以还原成亚硝酸盐,亚硝酸盐可使血液的运氧能力下降,还会形成强致癌物亚硝胺。亚硝酸盐的形成与发酵蔬菜中微生物密切相关[7],因此,微生物多样性是研究酸菜的焦点。
变性梯度凝胶电泳(denaturinggradientgelelectrophoresis,DGGE)是将同一种属的不同长度的脱氧核糖核酸(deoxyribonucleic acid,DNA)片段分开[8],其原理是根据DNA在不同浓度的变性剂中解链行为的不同而导致电泳迁移率发生变化,从而将片段大小相同而碱基组成不同的DNA片段分开[9-11]。在凝胶成像系统中观察到的条带的荧光强度反映了该菌的丰富度,条带越亮,表示该种菌的数量越多[12]。该技术被广泛应用于各种环境微生态的研究,如高温热泉等[13]。DGGE在国外还被广泛用于食品微生态的研究,鉴定微生物种类,评估食品质量,如益生制品、酸面团、干酪等[14]。
有研究报道,酸菜中含有丰富的细菌和真菌,其中,细菌主要有干酪乳杆菌(Lactobacillus casei)、植物乳杆菌(Lactobacillus plantarum)、醋酸杆菌(Acetobacter aceti)等,真菌主要为德巴利汉逊酵母(Debaryomyces hansenii),酸菜发酵过程中真菌种类比细菌种类少[4]。刘晓辉等[15-16]采用传统培养方法从酸菜中分离乳酸菌,并鉴定为短乳杆菌(Lactobacillusbrevis)、植物乳杆菌(Lactobacillusplanetarium)和肠膜明串珠菌(Leuconostocmesen teroides);丛敏等[17]采用聚合酶链式反应(polymerase chain reaction,PCR)结合DGGE技术对发酵第40天的酸菜分析得出,酸菜的主要优势菌群为乳杆菌属,包括植物乳杆菌、鼠李糖乳杆菌(Lactobacillus rhamnosus)、短乳杆菌(Lactobacillus brevis)、干酪乳杆菌、棒状乳杆菌(Lactobacillus coryniformis)、戊糖乳杆菌(Lactobacillus pentosus)、唾液乳杆菌(Lactobacillus salivarius)等。
本研究以市售散装酸菜SA和袋装酸菜SB、SC为研究对象,采用PCR-DGGE的方法分析酸菜中乳酸菌的多样性,为探究酸菜发酵机理奠定研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
散称酸菜(SA)、广乐牌泡酸菜(SB)、松源牌酸菜(SC):均购买于太原美特好超市长风店。
1.1.2 试剂
细菌基因组DNA提取试剂盒:索莱宝生物有限公司;N,N,N',N'-四甲基乙二胺、去离子甲酰、过硫酸铵、尿素(均为分析纯):美国AMRESCO公司;2×TaqMaster Mix、DH5a感受态细胞:天根生物技术有限公司;引物:由上海生物工程公司合成。
1.2 仪器与设备
TC-96(G)H(b)B Life Touch基因扩增仪:杭州博日科技有限公司;DcodeTM凝胶成像系统、DcodeTM浓度梯度电泳仪:美国Bio-Rad公司;DYY-6C电泳仪:北京六一仪器厂。
1.3 方法
1.3.1 酸菜中食盐及亚硝酸盐含量的测定
食盐含量:采用硝酸银滴定法进行测定[18];亚硝酸盐含量:按照国标GB/T 5009.33—2008《食品中亚硝酸盐和硝酸盐的测定方法》进行测定[19]。
1.3.2 酸菜汤汁中细菌总DNA的提取
分别取3种酸菜汤汁32 mL,10 000 r/min离心10 min。弃去废液,收集沉淀,用滤纸小心吸干,按照细菌基因组DNA提取试剂盒的说明书提取3种酸菜中细菌的总DNA。
1.3.3 PCR扩增
分别以3种酸菜中细菌的总DNA为模板,WBAC1(5′-CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCCCCCGGGAACGTATTCACCGCG-3′)和 WBAC2(5′-GTCGTCAGCTCGTGTCGTGAGA-3′)为引物对细菌的16S rDNA V7-V8基因序列进行PCR扩增。
PCR扩增体系:引物WBAC1和WBAC2各1 μL、模板DNA 1.5 μL、2×TaqMaster Mix 12.5 μL,加双蒸水(ddH2O)补充至25 μL。
PCR扩增程序:95℃预变性5 min;95℃变性30 s,50℃退火30 s,72℃延伸30 s,共30个循环;72℃再延伸8 min,最后于4℃保存。
PCR扩增产物经1.2%琼脂糖凝胶电泳进行检测。
1.3.4 变性剂梯度凝胶电泳
变性梯度凝胶的配方见表1。
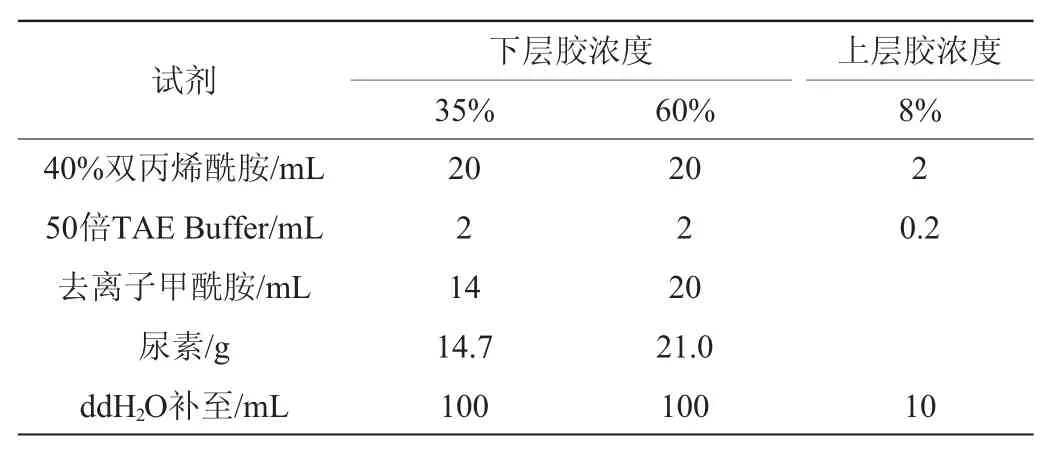
表1 变性梯度凝胶的配方Table 1 Formula of denaturing gradient gel
PCR扩增产物经DGGE后,切割回收电泳条带,将其作为模板进行PCR扩增,16S rDNA V7-V8的PCR扩增产物与pGM-T Vector连接,转化至感受态细胞DH5a。挑取阳性克隆子送至上海生物工程公司测定基因序列。
1.3.5 DGGE图谱分析
DGGE条带结构多样性分析:采用Quantity One软件自动分析确定DGGE图谱上每个条带的位置和相对光密度值。DGGE泳道内的电泳条带数量用以计算物种丰富度(R),运用电泳条带相对密度值计算物种均匀度(E)及物种多样性(H)[19]。多样性指数(H)、均匀度指数(E)及丰富度指数(R)的计算公式:
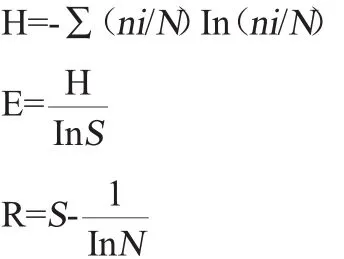
式中:ni为单一条带的峰面积;N为某一泳道所有峰面积;S为某一泳道的总条带数。
2 结果与分析
2.1 食盐含量的测定
3种酸菜食盐及亚硝酸盐含量测定结果见表2。
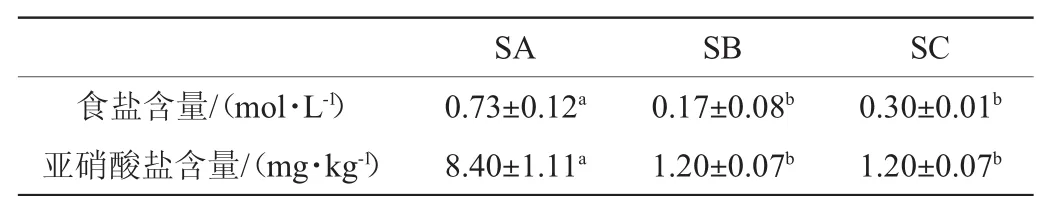
表2 3种酸菜食盐及亚硝酸盐含量Table 2 Salt and nitrite contents in three kinds of sauerkraut
由表2可知,在3种不同厂家的酸菜中,散装酸菜的食盐含量(0.73 mol/L)显著高于两种袋装酸菜(0.17 mol/L、0.30 mol/L)(P<0.05);两种袋装酸菜中食盐含量无显著差异(P>0.05)。散装酸菜的亚硝酸盐含量(8.40 mg/kg)显著高于两种袋装酸菜(1.20 mg/kg、1.20 mg/kg)(P<0.05),是袋装酸菜的7倍。两种袋装酸菜食盐含量无显著差异(P>0.05)。我国国标规定的酱腌菜中的亚硝酸盐含量应≤20 mg/kg[20],说明3种酸菜的亚硝酸盐含量均符合国家标准,均可放心食用。
2.2 PCR-DGGE结果
2.2.1 琼脂糖凝胶电泳分析
对16S rDNA V7-V8片段的PCR扩增产物进行琼脂糖凝胶电泳,结果如图1所示。
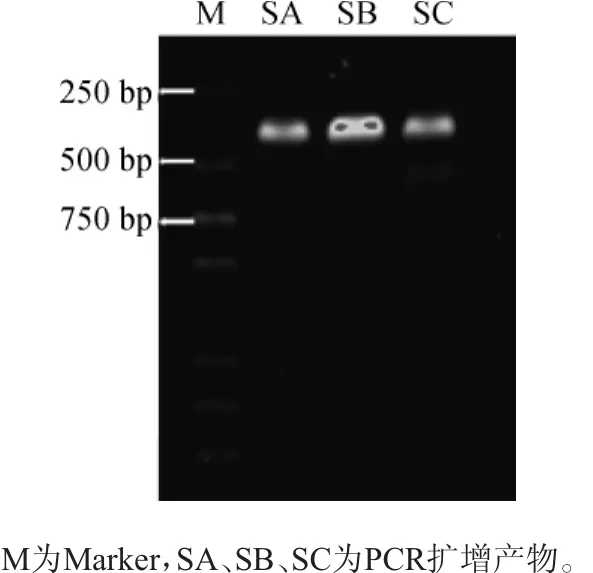
图1 PCR扩增产物琼脂糖凝胶电泳结果Fig.1 Results of agarose gel electrophoresis of PCR amplification products
由图1可知,3种酸菜的16S rDNA V7-V8 PCR扩增产物的琼脂糖凝胶电泳条带清晰,纯度高,说明提取的DNA可以用于DGGE分析。
2.2.2 变性剂梯度凝胶电泳分析
由于PCR扩增产物分别是3种酸菜中所有微生物16SrDNA V7-V8片段基因的混合,为了鉴定酸菜中原核微生物多样性,因此,需要使用DGGE技术进行分离,DGGE结果见图2。

图2 PCR扩增产物DGGE结果Fig.2 DGGE results of PCR amplification products
由图2可知,每个酸菜样品中都有不同的条带,酸菜SA有3条电泳带(SA1、SA2、SA3);酸菜SB有两条电泳带(SB1、SB2);酸菜SC有3条电泳带(SC1、SC2、SC3)。
采用Quantity One软件对8条电泳带进行分析,经过数据处理得到3种酸菜样品DGGE条带的多样性指数(H)、均匀度指数(E)、丰富度指数(R),结果见表3。
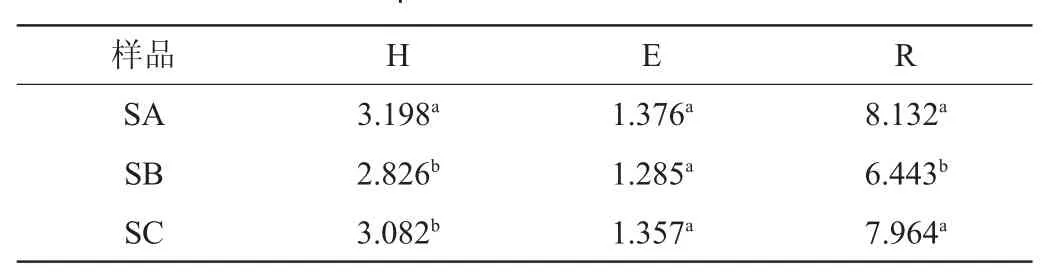
表3 3种酸菜样品DGGE条带的指数分析结果Table 3 Indexes analysis results of DGGE band of three kinds of sauerkraut samples
由表3可知,3种酸菜样品DGGE条带的均匀度指数无显著差异(P>0.05)。散装酸菜样品DGGE条带的多样性指数显著大于两种袋装酸菜(P<0.05),两种袋装酸菜样品DGGE条带的多样性指数无显著差异(P>0.05)。散装酸菜样品DGGE条带的丰富度指数显著大于袋装酸菜SB(P<0.05),与袋装酸菜SC无显著差异(P>0.05)。结果表明,酸菜的包装影响乳酸菌的多样性和丰富性。
2.2.3 测序结果分析
3种酸菜的DGGE条带数量和迁移率均不同,为了研究酸菜中乳酸菌的种类,回收DGGE结果的每个电泳条带,经克隆、测序后,测序结果与美国国立生物技术信息中心(national center for biotechnology information,NCBI)中的GenBank库序列进行比对分析,结果见表4。
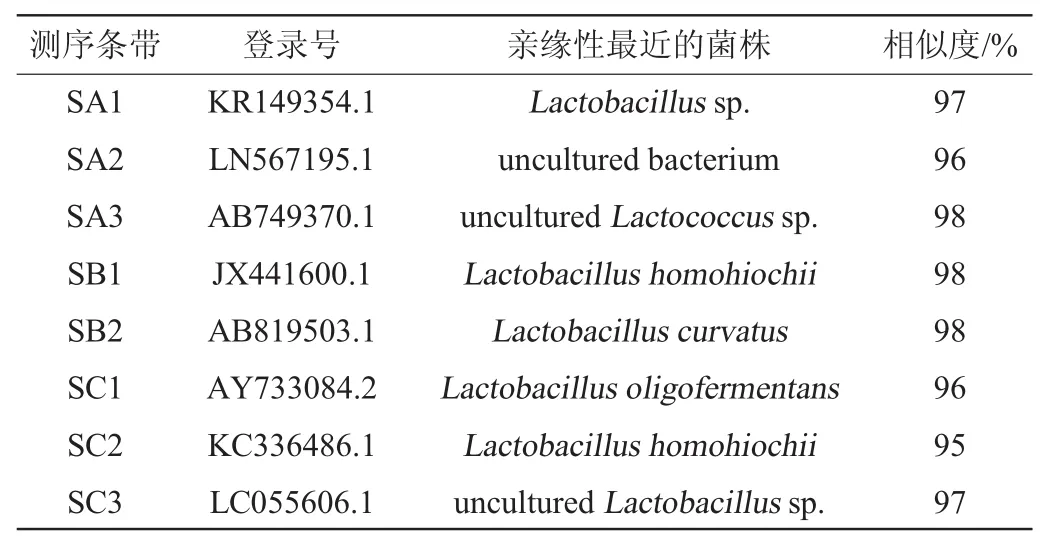
表4 发酵酸菜细菌群落的DGGE图谱条带测序结果Table 4 Sequencing results of DGGE band of bacterial community in fermented sauerkraut
由表4可知,散装酸菜SA的3条回收带即SA1、SA2、SA3分别与乳杆菌属(Lactobacillussp.)、非培养细菌(uncultured bacterium)、非培养乳球菌属(unculturedLactococcussp.)的相似度较高,为97%、96%、98%;袋装酸菜SB的两条回收带即SB1、SB2分别与Lactobacillus homohiochii、弯曲乳杆菌(Lactobacillus curvatus)的相似度较高,为98%、98%;袋装酸菜SC的3条回收带即SC1、SC2、SC3分别与寡发酵乳杆菌(Lactobacillus oligofermentans)、Lactobacillus homohiochii、非培养乳杆菌属(unculturedLactobacillussp.)的相似度较高,为96%、95%、97%。结果表明,散装酸菜中非培养微生物含量比袋装酸菜中多,两种袋装酸菜均含有乳杆菌属(Lactobacillussp.)和Lactobacillushomohiochii,散装酸菜与袋装酸菜乳酸菌系不同。
3 结论
采用PCR-DGGE技术对3种酸菜中乳酸菌的多样性进行研究。结果表明,散装酸菜中乳酸菌的多样性指数显著高于袋装酸菜(P<0.05)。散装酸菜与袋装酸菜乳酸菌系不同,散装酸菜SA中含有Lactobacillussp.、uncultured bacterium、unculturedLactococcussp.;袋装酸菜SB中含有Lactobacillus homohiochii、Lactobacillus curvatus;袋装酸菜SC中含有Lactobacillus oligofermentans、Lactobacillus homohiochii、unculturedLactobacillussp.,两种袋装酸菜中均存在乳酸杆菌属(Lactobacillussp.)和L.homohiochii。
