术前CT/MRI检查指标对肝硬化脾切除术后门静脉血栓形成的预测价值*
2019-05-08潘志华
肖 科,潘志华,涂 波,陈 丽
门静脉高压属失代偿期肝硬化主要表现之一,脾切除术是其关键治疗手段,可降低门静脉压力,纠正血流动力学失衡,切断脾动脉血流,增加肝动脉血供,改善肝功能,防治曲张静脉破裂出血和脾功能亢进症。但有报道称,门静脉高压症患者门静脉血栓形成(portal vein thrombosis,PVT)自然发生率为0.6%~2.1%,而肝硬化门静脉高压症患者在脾切除术后PVT发生率高达22.2%[1]。若对PVT控制不及时,可能会再次增高门静脉压力,诱发曲张血管破裂出血、腹水甚至肝衰竭,而过度抗凝又会导致术后出血[2]。国外报道显示,肝硬化门静脉高压症患者在脾切除术后PVT形成与术后应用抗凝药物、腹水、肝功能 Child-Pugh 分级等因素有关[3,4]。我们观察了术前CT/MRI检查指标对肝硬化脾切除术后PVT形成的预测价值,现报道如下。
1 资料与方法
1.1 一般资料 2016年7月~2018年7月我院收治的乙型肝炎肝硬化脾切除术后患者87例,男54例,女33例;年龄18~78岁,平均年龄为(49.3±10.1)岁。所有患者均符合《美国肝脏研究协会成人肝硬化腹水处理实践指南2012年修订版》[5]相关诊断标准,均经肝脏组织病理学、CT或MRI等检查诊断,并确定为肝硬化门静脉高压,均行脾切除术。排除标准:①术前存在PVT;②脾切除术后伴有严重感染、胰漏、腹腔内出血等并发症;③随访3个月内因非PVT原因死亡者;④伴胰腺癌、胃癌、肝癌等恶性肿瘤患者;⑤伴克隆氏病、溃疡性结肠炎、系统性红斑狼疮等炎性疾病及血液系统疾病;⑥伴其他腹部手术史;⑦合并门静脉海绵状变性、布-加氏综合症、门静脉畸形者。患者对本研究知情且签署知情同意书,本研究获得我院医学伦理委员会批准。
1.2 研究方法 收集患者一般资料,包括性别、年龄、体质指数、吸烟史、饮酒史、高血压、糖尿病、高脂血症、门脉高压性胃病,记录静脉曲张类型、肝功能Child-Pugh分级、术前是否接受内镜下治疗。
1.3 术前CT检查 使用Brilliance iCT164排螺旋CT(飞利浦公司)予以扫描。检查前6~8 h禁食,检查前30 min口服温开水500~800 ml,并于检查前5 min口服温开水300~400 ml,确保胃肠道充盈。检查时,患者取仰卧位,设置参数(电压120 kV,电流25 mA,旋转时间0.5 s,层厚5 mm)。常规平扫,再行三期增强扫描。经肘静脉团注300 mgI/ml的碘海醇注射液(上海通用电气药业,国药准字H20000593)100 ml,3.0 ml/s,再注射生理盐水 30 ml。增强扫描后,采集门静脉期原始图像数据,行1.25 mm薄层重建,重建间隔为0.62 mm,开展多平面重组和容积显示处理。逐层勾画肝叶轮廓,避开胆囊和下腔静脉,自所选区域内选取阈值,计算机自动计算脾脏容积。
1.4 术前MRI检查 使用Brivo MR355光纤超导3.0 T磁共振(GE公司),使用相控阵线圈完成扫描。患者取仰卧位,行肝脏横断面常规扫描,采用双反转自旋回波 T2加权成像(T2 weighted imaging,T2WI)序列,重复时间(repetition time,TR)/回波时间(echo time,TE)4000/80 ms。于肝门层面行横断、冠状、矢状定位扫描。完成扫描后,重建4排图像,包括质子图、相位图、血管图、血流图。采用流速分析软件,于质子图上顺着血管壁边缘,勾画感兴趣区,测量门静脉直径。同时,将质子图感兴趣区范围复制至相位图,采用流速分析软件,显示整个心动周期血流速度,勾画感兴趣区域3次后,读取平均值,计算门静脉血流流速和门静脉流速差(最大流速-最小流速)。另外,采用普通静脉留置针,经胃网膜右静脉置管(插入15 cm左右),确保导管处于门静脉主干内,与测压装置(玻璃管水柱压力表)连接,零点取在腋中线。运用玻璃水柱法,持续测量3次后取平均值,即为门静脉压力,并计算门静脉压力差。
1.5 PVT诊断标准[6]在术后7 d,经超声或增强CT或MRI检查,显示门静脉内回声光团异常,在肠系膜上静脉、脾静脉、门静脉左右分支或主干伴有栓子形成者,则判定为PVT。
1.6 统计学方法 应用SPSS 19.0处理数据,计量资料用(±s)表示,组间行t检验。计数资料的比较采用x2检验;采用多因素Logistic回归分析肝硬化脾切除术后PVT形成的独立影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 术后PVT发生情况 在87例肝硬化脾切除术后患者,随访3个月末,发现有46例(52.9%)发生PVT,均为PVTⅠ级,栓塞程度小于门静脉管腔的50%,局限,未向肠系膜上静脉延伸,无Ⅱ、Ⅲ、Ⅳ级病例;发生门静脉附壁血栓45例(51.7%),其中伴肠系膜上静脉附壁血栓14例(16.1%)。1例门静脉高压伴侧支循环形成(图1)患者,经应用潘生丁50 mg、肠溶阿司匹林150 mg口服,3次/d,给予川芎嗪160 mg、低分子右旋糖苷500 ml静脉滴注,1次/d,低分子肝素2500 U皮下注射,1次/d,血栓消失,未见明显出血倾向。
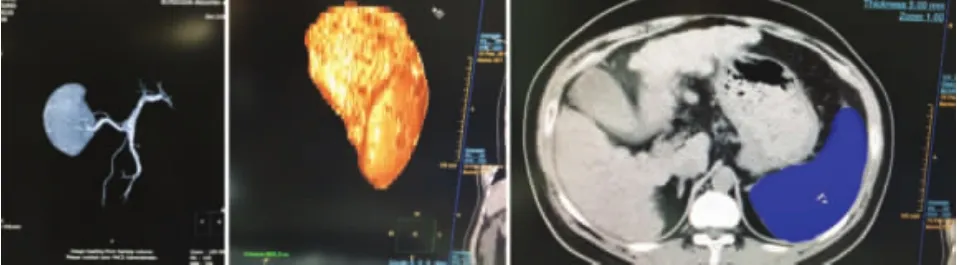
图1 肝硬化门脉高压症患者腹部CT表现 76岁女性,门静脉CTA显示门静脉高压伴侧支循环形成,门静脉主干增粗,直径约17 mm,肝门静脉左右支、肠系膜上静脉、脾静脉、胃左静脉、食管胃底静脉不同程度增粗,胃左静脉见大量侧支循环形成
2.2 PVT组与非PVT组术前CT/MRI检查指标的比较 PVT组门静脉直径、门静脉流速差和脾容积显著大于非PVT组(P<0.05),其它指标与非PVT组比较差异均无统计学意义(P>0.05,表1)。
2.3 影响肝硬化脾切除术后PVT形成的多因素Logistic回归分析 以肝硬化脾切除术后PVT形成为因变量,以上述存在差异的单因素为自变量,依据连续变量赋值,纳入多因素Logistic回归统计分析,以逐步回归方法筛选变量。结果显示,门静脉直径、门静脉流速差和脾容积均是肝硬化脾切除术后PVT形成的独立影响因素(P<0.05,表2)。
表1 PVT组与非PVT组术前CT/MRI检查指标(±s)比较
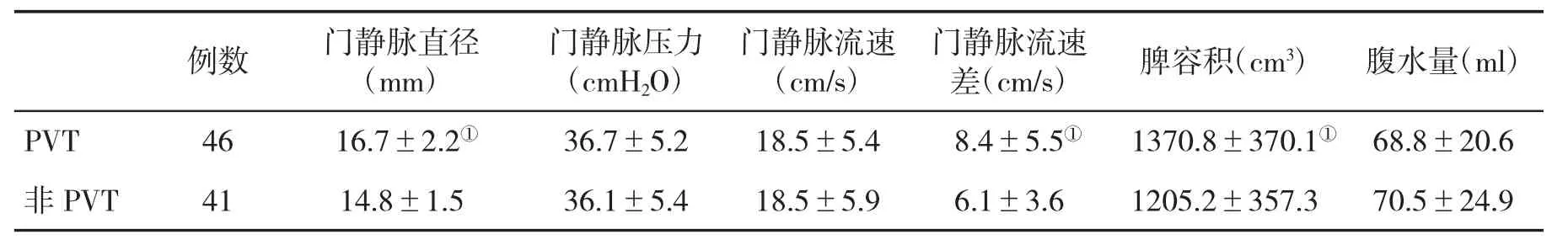
表1 PVT组与非PVT组术前CT/MRI检查指标(±s)比较
与非PVT组比,①P<0.052
例数 门静脉直径(mm)门静脉压力(cmH2O)门静脉流速(cm/s)门静脉流速差(cm/s) 脾容积(cm3) 腹水量(ml)PVT 46 16.7±2.2① 36.7±5.2 18.5±5.4 8.4±5.5① 1370.8±370.1① 68.8±20.6非 PVT 41 14.8±1.5 36.1±5.4 18.5±5.9 6.1±3.6 1205.2±357.3 70.5±24.9
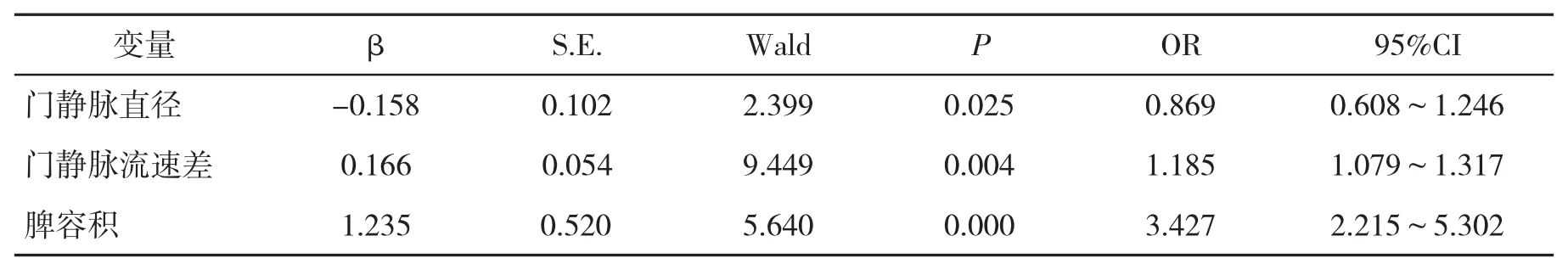
表2 影响肝硬化脾切除术后PVT形成的多因素Logistic回归分析
3 讨论
门静脉血流动力学改变对肝硬化门静脉高压严重程度具有重要的预测价值,而CT和MRI技术具有无创、操作简单、可重复性强等优势,能精准显示门静脉系统及其侧支循环分布状况,发现脾脏大小、腹水、系膜水肿、胃肠道壁增厚等门静脉高压征象,对判断患者预后具有重要的诊断价值。PVT属肝硬化门静脉高压脾切除术后常见的并发症,国外报道肝硬化门静脉高压患者PVT发生率高达0.6%~16.0%,而国内文献报道脾切除术后PVT发生率高达21%~37%[7,8]。本研究结果显示,肝硬化脾切除术后早期PVT发生率为52.9%,明显高于上述报道,多因术后抗凝药物,如华法林、双嘧达莫、阿司匹林等联用会导致出血,如胃肠道出血、女性阴道出血、腹腔引流管出血等风险增加,增加了医生应用的顾虑。目前,关于肝硬化脾切除术后PVT形成机制尚未完全明确,可能与血小板因素有关,术后血小板计数急剧增高,增加了血液粘稠度,CD62p表达增多,易形成PVT。同时,脾切除术后出现门静脉血流瘀滞现象,门脉血流减少,流速下降,PVT发生率上升[9]。另外,血管内皮损伤导致胶原暴露,凝血系统被激活,导致抗凝系统失衡,术后机体合成抗凝血酶Ⅲ和蛋白S等因子能力下降,凝血因子含量增加,促使PVT形成[10]。
本研究结果显示,术前门静脉直径是肝硬化脾切除术后PVT形成的独立影响因素,多因门静脉直径越宽,血液流速越慢,会形成涡流,易诱发PVT。门静脉直径是PVT形成的独立危险因素[11]。有研究发现脾静脉直径与脾脏质量呈线性关系,是PVT形成的独立危险因素。当脾静脉直径大于9.5 mm时,其预测PVT形成的灵敏度高达70%[12,13]。采用MRI技术可客观定量测量肝硬化门静脉高压患者术前血流动力学变化,包括门静脉流速/流速差等指标,显示门静脉系统呈高血流动力学改变。本研究结果显示,脾容积是肝硬化脾切除术后PVT形成的独立影响因素,多因脾脏容积越大,其内储存血量越多,脾切除术对门静脉系统血流动力学的影响越大,会增加术后PVT发生的风险。
本研究发现,术后血小板计数升高的水平与肝硬化脾切除术后PVT形成无关,推测可能是血小板功能变化导致了PVT的形成,而血小板数目变化影响可能较小。肝硬化脾功能亢进和门静脉高压症时,脾内滞留血小板会增加,血小板破坏增加,脾脏产生抑制血小板生成循环因子,导致血小板生成受阻[16,17]。国内外有报道称肝硬化门静脉高压患者在脾切除术后,对PVT形成起重要作用的可能是血小板功能变化而并非血小板数量的变化,与本研究结论相似[18,19]。另外,有报道发现伴腹水患者脾切除术后PVT发生率为无腹水者的2倍,而肝功能Child-Pugh分级每增加一个等级,脾切除术后PVT发生率提高1.3倍,与本研究结论不相符,可能与我们的样本量偏小等因素有关,有待今后深入调查[20]。
