1,25(OH)2D3通过调节 miR-146a水平抑制大鼠肝纤维化的体内和体外观察*
2019-05-08周丽云李校天李丽杨俊超
周丽云,李校天,李丽,杨俊超
肝星状细胞(HSC)的活化在肝纤维化的形成过程中起着重要作用[1-4]。miRNAs是一类长度约18~25 nt的调控转录后基因表达的非编码RNA,广泛存在于真核生物,也包括单细胞生物体内,参与细胞的分化、增殖和凋亡[5]。1,25(OH)2D3是维生素 D在体内的最终代谢形式,是维持机体钙和骨盐平衡的重要成分,在免疫调节、抗氧化、抗炎症反应等方面发挥着重要作用。本研究检测了CCl4诱导的肝纤维化大鼠肝组织miR-146a水平,并在体外检测了转染miR-146a模拟剂/抑制剂并经TGF-β1诱导活化的HSC的增殖和活化情况,以进一步探讨1,25(OH)2D3抗肝纤维化的作用机制。
1 材料与方法
1.1 动物模型的建立 48只SD大鼠【河北医科大学动物实验中心(合格证编号:1602111)】,体质量为(200±20)g,随机分为对照组、CCl4模型组、橄榄油组和1,25(OH)2D3干预组,每组12只。给予大鼠50%CCl4(上海麦克林生物科技有限公司)3 ml·kg-1皮下注射,2次/w,连续8 w,建立肝纤维化模型,在对照组,给予等量的橄榄油溶媒皮下注射。自造模之日开始,在干预组,分别给予橄榄油溶媒或1,25(OH)2D3溶液(美国Peprotech 公司)3 ml·kg-1灌胃,1次/d。在实验第8 w,实验动物禁食12 h,以10%水合氯醛腹腔注射麻醉,经心脏取血,4℃ 12000 r/m离心5 min,分离血清。打开腹腔,取肝组织,4%多聚甲醛固定,用于石蜡包埋制作病理学切片,采用Metavir法行肝纤维化分期评估。另取部分肝组织用液氮快速冷冻,置于-80℃冰箱保存,以备提取miR-146a。
1.2 细胞培养 取HSC细胞(中国科学院上海生命科学院细胞资源中心),用1640培养液加10%小牛血清(FBS,美国Invitrogen公司)、100 U/ml青霉素、100 μg/ml链霉素,培养于37℃含5%CO2培养箱中,每24~48 h换液。待细胞长满至T25培养瓶中约80%~90%时,胰酶消化传代。当传至3~4代时,使用10 pmmol/l TGF-β1(美国Sigma公司)作用细胞24 h,将细胞分为:①TGF-β1刺激组:用含10 pmmol/l TGF-β1/10%FBS的1640培养基培养细胞;②转染miR-146a模拟剂组:用50 nM miR-146a模拟剂(广州锐博生物科技有限公司)/10 pmmol/L TGF-β1/10%FBS的1640培养基培养细胞;③转染miR-146a模拟剂对照组(广州锐博生物科技有限公司):用50 nM miR-146a模拟剂/10 pmmol/l TGF-β1/10%FBS的1640培养基培养细胞;④转染miR-146a抑制剂组:用100 nM miR146a抑制剂(广州锐博生物科技有限公司)/10 pmmol/l TGF-β1/10%FBS的1640培养基培养细胞;⑤转染miR-146a抑制剂对照组:用100 nM miR146a抑制剂对照物(广州锐博生物科技有限公司)/10 pmmol/l TGF-β1/10%FBS的1640培养基培养细胞;⑥1,25(OH)2D3干预组:用 2.5×10-6mmol/l 1,25(OH)2D3/0.1%DMSO 溶剂/10 pmmol/l TGF-β1/10%FBS的1640培养基培养细胞;⑦DMSO组:以 0.1%DMSO溶剂/10 pmmol/l TGF-β1/10%FBS的1640培养基培养细胞。根据我们前期工作基础,设置药物浓度及培养时间,每组设5个复孔,于37℃、5%CO2培养箱中继续培养24 h。
1.3 肝组织miR-146a水平检测 采用qPCR法。采用U6大鼠miR-146a源引物为内参照,采用SYBR Green I实时定量PCR法检测miR-146a相对水平,miR-146a引物为:5’-TGAGAACTGAATTCCATGGG TT-3’,下游引物为 5’-ATCTACTCTCCAGGTCCTCA-3’;内参基因 U6small nuclear RNA(snRNA)的上游引物为:5’-CTCGCTTCGGCAGCACA-3’,下游引物为 5’-AACGCTTCACGAATTTGCGT-3’。
1.4 转染miR-146a模拟剂和miR-146a抑制剂 瞬时离心miR-146a模拟剂、miR-146a模拟剂对照物、miR-146a抑制剂和miR-146a抑制剂对照物。用灭菌ddH2O配制成20 μM储存液,分装保存,用 1×riboFECTTMCP Buffer 30 μl分别稀释 20 μM miR-146a模拟剂、miR-146a模拟剂对照物、miR-146a抑制剂和miR-146a抑制剂对照物1.25 μl,轻轻混匀,加入riboFECTTM CP Reagent 3 μl,轻轻吹打混匀,室温孵育0~15 min。弃掉24孔板中的培养液,加入新的无血清培养基,将CP混合液加入到新的培养基中,轻轻混匀。将培养板置于37℃的CO2培养箱中培养24 h。
1.5 细胞增殖检测 采用CCK8法,将HSC-T6细胞接种于96孔板,体积100 μl,每组做3个复孔,待细胞长至80%时,按照上述分组进行干预。干预24 h后,每孔加入CCK-8溶液10 μl,培养箱内孵育1 h左右,测定450 nm吸光度。细胞增殖率=(实验孔-空白孔)/(对照孔-空白孔)×100%。
1.6 细胞凋亡检测 使用流式细胞术检测,取对数生长的细胞,按上述分组干预24 h,倒去培养液,胰酶消化,用培养液轻轻吹打,4℃ 1200 r/m离心5 min,弃上清,PBS洗2次,用Binding Buffer 500 μl重悬细胞,细胞数为5×105。用孔径为40~50 μm的300目尼龙网过滤细胞,加入AnnexinV-FITC 5 μl和PI 10 μl,轻柔涡旋混匀,室温避光孵育5 min,上机进行细胞凋亡检测。
1.7 统计学方法 应用SPSS 20.0软件进行数据分析,计量资料以(±s)表示,组间显著性差异分析采用单因素方差分析(one-way ANOVA),P<0.05表示差异有统计学意义。
2 结果
2.1 各组SD大鼠血清ALT和AST水平比较 经1,25(OH)2D3处理,动物血清 AST 和 ALT 水平显著低于模型组(P<0.05,表1),说明 1,25(OH)2D3具有保护大鼠肝功能,减轻肝损伤的作用。
表1 各组大鼠血清ALT和AST水平(±s)比较
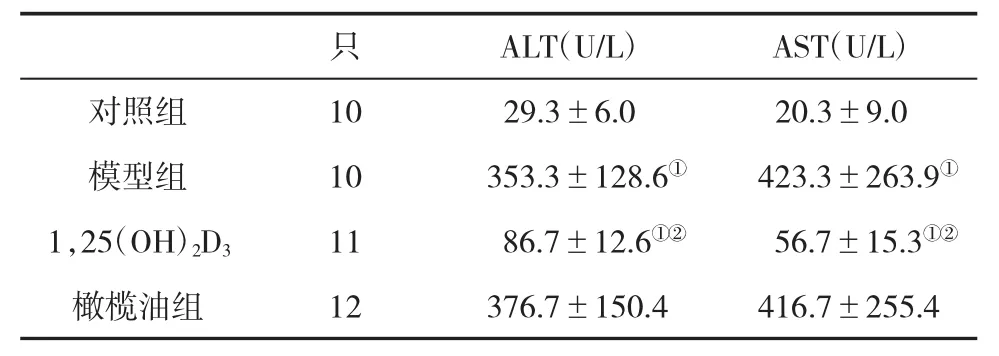
表1 各组大鼠血清ALT和AST水平(±s)比较
与对照组比,①P<0.05;与橄榄油组比,②P<0.05
ALT(U/L) AST(U/L)对照组 10 29.3±6.0 20.3±9.0模型组 10 353.3±128.6① 423.3±263.9①1,25(OH)2D3 11 86.7±12.6①② 56.7±15.3①②橄榄油组 12 376.7±150.4 416.7±255.4只
2.2 各组肝组织病理学表现 Masson染色结果显示,经 1,25(OH)2D3灌胃干预后,SD 大鼠肝组织可见正常的肝小叶结构,炎性浸润情况较橄榄油灌胃组明显减轻,汇管区纤维条索较橄榄油灌胃组明显变细,说明1,25-OH)2D3具有抑制大鼠肝组织炎症反应作用。
2.3 各组大鼠肝组织miR-146a水平变化 经1,25(OH)2D3灌胃干预组大鼠肝组织miR-146a水平较橄榄油处理组明显上调(P<0.05)。
2.4 各组细胞转染miR-146a情况 结果显示转染miR-146a模拟剂组细胞miR-146a相对水平较转染miR-146a模拟剂对照物组显著增高,转染miR-146a抑制剂组miR-146a相对水平较转染miR-146a抑制剂对照物组显著降低,差异均具有统计学意义,提示转染成功。1,25(OH)2D3干预 HSC中miR-146a水平较 DMSO组明显增加(P<0.05),提示 1,25(OH)2D3可上调细胞 miR-146a水平。
2.5 各组细胞增殖率比较 分别以2.5×10-6mmol/L 1,25(OH)2D3和 DMSO 处理细胞,以只含有 1640 培养基组为空白对照,处理 24 h 后,1,25(OH)2D3组细胞增殖率为58.8%,较DMSO组下降了15.9%;转染miR-146a模拟剂组细胞增殖率为46.5%,较转染miR-146a模拟剂对照组下降了53.3%;转染miR-146a抑制剂组HSC增殖率为132.8%,较转染miR-146a抑制剂对照物组升高了约32.8%,提示1,25(OH)2D3可抑制由TGF-β1刺激的HSC增殖。
2.6 各组细胞凋亡情况比较 1,25(OH)2D3干预细胞凋亡率为12.6%,比DMSO组细胞凋亡率提高了5.1%,与对照组比,细胞凋亡率增加了6.3%;转染miR-146a模拟剂组细胞凋亡率为16.8%,与转染miR-146a模拟剂对照物组比,细胞凋亡率增加了8.2%;与对照组比,转染miR-146a模拟剂组细胞凋亡率增加了10.4%;转染miR-146a抑制剂组细胞凋亡率为6.3%,与转染miR-146a抑制剂对照物组比减少了 2.2%,提示 1,25(OH)2D3可促进由 TGF-β1刺激的HSC细胞凋亡(图1)。
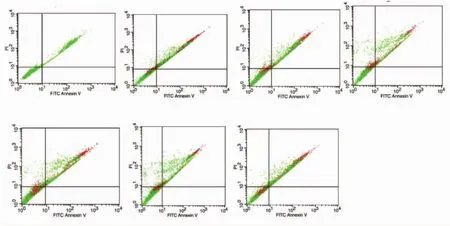
图1 各组HSC凋亡情况
3 讨论
近年研究表明,miRNA参与肝纤维化的发生和发展过程,有望成为肝纤维化诊断及干预的靶点[8]。miR-146a是miRNA家族的一员,位于人类5号染色体LOC285628基因的第二外显子上。2006年,Baltimore团队首先报道了miR-146a可通过NF-κB信号通路抑制机体的免疫反应[9]。随后,不断有研究报告指出其与机体自身免疫、炎症、病毒感染等有着错综复杂的关系。研究发现miR-146a水平的异常与病毒复制、肝细胞再生、炎症反应,甚至肝细胞癌的发生发展有密切的联系[10-14]。
1,25(OH)2D3与各种肝脏疾病的发生、发展有关,在免疫调节、抗炎、抗氧化、抗纤维化等方面均有不同程度的作用。研究发现,1,25(OH)2D3可通过降低miR-27b水平从而抑制肺纤维化进程[15],还可通过调节miRNA表达,诱导皮肤鳞癌细胞凋亡[16]。国内亦有用它来干预硫代乙酰胺诱导的大鼠肝纤维化的报道[17]。我们采用10pmmol/L TGF-β1诱导HSC活化,再转染miR-146a模拟剂或miR-146a抑制剂。结果发现1,25(OH)2D3干预HSC细胞增殖较对照组明显降低,而转染miR-146a模拟剂组HSC增殖较对照组明显降低,转染miR-146a抑制剂组HSC细胞增殖较对照组明显增强,差异均具有统计学意义(P<0.05)。实验还发现 1,25(OH)2D3干预的HSC较对照组凋亡明显增加,差异具有统计学意义(P<0.05),转染 miR-146a模拟剂组 HSC 凋亡较对照组明显增加,转染miR-146a抑制剂组HSC较对照组凋亡减少,上述差异均具有统计学意义(P<0.05),这些结果提示活化的 HSC细胞miR-146a较静息状态下下降,1,25(OH)2D3具有抑制肝纤维化的作用,其机制可能与上调HSC中miR-146a水平有关。
本研究结果显示,1,25(OH)2D3在体内体外均具有抑制肝纤维化形成的作用,并且可能通过上调HSC细胞内miR-146a水平而实现的,但其具体的信号通路还需要进一步的研究。我们将在后续的体内和体外实验中继续探索1,25(OH)2D3抗肝纤维化的作用机制及其miR-146a或其下游通路的作用,以期为1,25(OH)2D3用于抗肝纤维化的干预提供更多的理论和实验依据,也为逆转肝纤维化提供更多的药物干预思路,从而阻断肝纤维化的进展。
