DDX6突变体的构建
2019-05-05周焱琳唐翠兰于秀芝
周焱琳 唐翠兰 于秀芝
RNA解旋酶在多条RNA代谢通路中起到调控作用。在复杂的细胞环境中,它们可与细胞内多种信号通路、蛋白相互作用,参与调控致癌基因或抑癌基因的表达,参与癌症的发生发展。人类细胞表达约70种RNA解旋酶,大多数属于超家族2(superfamily 2,SF2)[1-2]。SF2 包括了 DEAD-box RNA 解旋酶(DEAD-box RNA Helicase,DDX RNA Helicase,DDX)蛋白家族,DDX蛋白是一类在进化中高度保守的ATP依赖的RNA解旋酶,广泛分布于人体的各个组织和器官中,包括肝、肾、心脏、结肠、阑尾、皮肤、唾液腺等等(数据来自 GioGPS,ID:1656)。它参与调节 RNA的多个过程,包括mRNA前体加工、RNA降解、翻译启动、转录调控等[3]。其家族蛋白的结构分为N端区、C端区和核心区。核心区位于N端区和C端区之间,包含9个保守结构域,包括该家族特征性氨基酸序列,即天冬氨酸-谷氨酸-丙氨酸-天冬氨酸(D-E-AD)。由于家族成员在N端区和C端区结构域存在差异,导致其功能也出现了差别。有研究表明,家族中的DDX6在许多恶性细胞系中高度表达,其表达与癌症细胞的生长和分化密切相关。DDX6可在大肠癌、肝癌、胃癌中高度表达。它可以通过增加胃癌细胞中c-Myc表达来促进胃癌进展[4]。此外,它对胶质细胞瘤也有促进作用[5]。沉默DDX6,可以抑制结肠直肠癌细胞体外和体内的增殖[6]。人源DDX6又名RCK/p54,可从B细胞淋巴瘤细胞系RC-K8中克隆而来,其蛋白分子量为54kDa[7]。为了进一步明确DDX6在癌症进展过程中的作用,我们构建了DDX6突变体,使其失去解旋酶活性,或同时失去解旋酶和ATP酶活性,以期在后期实验中深入研究其生物学功能。
1 材料与方法
1.1 材 料 质粒载体和菌株:DDX6-WT和pENTER购自维真生物科技公司(批号CH867745、PD88001)。细胞株:人肝癌Huh7细胞系由本实验室保存。
1.2 试 剂 DH5α感受态细胞购自Simgen(8301010/8301020);QIAGEN Plasmid Midi Kit 和QIAquick Gel Extraction Kit购自QIAGEN公司(批号12145、28704),PCR引物由杭州擎科梓熙生物技术有限公司合成。Pro Ligation-Free Cloning Kit购自 abm 公司(批号 E086)。PrimeSTAR Max DNA Polymerase,DL15,000 DNA Marker和 DL5000 DNA Marker购自 Takara公司(批号 R045Q、3582Q、3428Q)。琼脂糖购自 BIOWEST(批号 111860)。LB 肉汤培养基、LB肉汤琼脂购自生工生物(批号A507002-0250、A507003-0250)。Pierce BCA Protein Assay Kit、AsiSI和 MLμL 购自 Thermo Fisher Scientific (批 号 23225、FD2094、FD0564)。Lipofectine 3000和P3000购自美国Invitrogen(批号L3000015)。DMEM培养基购自Hyclone公司(批号SH30022.01)。胎牛血清、Opti-MEM培养基购自 Gibco(批号10099141、31985062)。0.25%胰酶+0.02%EDTA 溶液购自吉诺生物(批号GNM25200)。SDS-PAGE凝胶配置试剂盒购自碧云天生物技术(批号P0012A)。Monoclonal ANTI-FLAG M2 antibody produced in mouse、Dimethyl sμLfoxide (DMSO) 购 自 sigma-Aldrich(批号 F1804、V900090)。GAPDH(D16H11)XP Rabbit mAb购自Cell Signaling Technology(批号2118S)。Goat Anti-Mouse IgG (H+L)HRP 和 Goat Anti-Rabbit IgG(H+L)HRP购自联科生物(批号70-GAM007、70-GAR007)。
1.3 方 法
1.3.1 突变质粒的构建 DDX6-EQ突变质粒的构建:以DDX6-WT为模板,使用PrimeSTAR Max DNA Polymerase和突变引物扩增整个模板。DDX6-EQ 突变上游引物(5’-3’):TCCAGATGATAGTATTGGATCAGGCAGATAAGTTGCTGTCACAGGA;下游引物(5’-3’)TGACAGCAACTTATCTGCCTGATCCAATACTATCATCTGGACATGA。扩增后进行琼脂糖凝胶电泳后切胶回收,回收产物使用Pro Ligation-Free Cloning Kit试剂盒进行连接。连接产物命名为DDX6-EQ。DDX6-△C突变质粒的构建:以DDX6-WT为模板,使用AsiSI/MLμL进行双酶切,获取约1.4kb的目的片段和约7.5kb的载体片段。使用突变引物扩增目的片段,DDX6-△C突变上游引物(5’-3’):TCCGGTACCGAGGAGATCTGCCGCCGCGATCGCCATGAGCACGGCCAGAACAGAGAAC;下游引物(5’-3’):CCTTATAATCCTCGAGCGGCCGCGTACGCGTCAGGTTAATCTCATAGGG。扩增后进行琼脂糖凝胶电泳,切胶回收约0.9kb的片段,回收产物和载体片段使用Pro Ligation-Free Cloning Kit试剂盒进行连接,连接产物命名为DDX6-△C。
1.3.2 突变体的筛选与序列分析 将突变后的质粒转入感受态细胞,在含有卡纳抗性的LB平板上涂板,37℃过夜后,挑取单菌落于37℃震荡培养过夜,提取质粒。将克隆子送至杭州擎科梓熙生物技术有限公司进行双向测序,并对测序结果使用NCBI网站的BLAST平台进行核实。
1.3.3 突变体酶切鉴定 用AsiSI和MLμL对突变后的质粒进行双酶切鉴定。起反应体系为:质粒DNA 1000ng,AsiSI 0.8μL,MLμL 0.8μL,10 ×Fastdigest buffer 2μL,ddH2O 补足 30μL。
1.3.4 细胞复苏 溶液氮罐中取出Huh7细胞,37℃水浴,迅速融化细胞悬液。
1.3.5 细胞培养 细胞在含10%胎牛血清的DMEM培养基中贴壁生长。细胞培养于37℃、含5%CO2、饱和湿度的细胞培养箱内。每1天换一次液,每两天用含0.25%胰酶+0.02%EDTA溶液的消化液进行传代。
1.3.6 细胞冻存 待细胞生长到一定密度后,消化重悬细胞。将细胞悬液转移至15mL无菌离心管后,以800rpm的速度室温离心3min。离心后去上清,加入 700μL DMEM,200μL 胎牛血清,100μL DMSO,吹打数次重悬后,转移至无菌细胞冻存管中,于液氮中保存。
1.3.7 转 染 将Huh7细胞在6孔板中以0.5×106个/孔的密度铺板,24h后,当细胞融合率达50%~80%时,即可进行转染。转染前,将旧培养基弃去,加入新的血清培养基。将所需要的转染试剂和质粒按照实验量分别加入相应的Opti-MEM培养基中,轻柔吹打混匀,室温孵育5min。将转染混合物均匀逐滴加入细胞中,孵育48h。
1.3.8 蛋白质提取与蛋白印迹(Western Blot)分析使用RIRP裂解液提取蛋白。BCA法测定蛋白浓度后,加入5×SDS Loading dye沸水浴10min变性。使用SDS-PAGE凝胶配置试剂盒配胶。将制备好的蛋白样本加入胶中,恒压电泳90V,当溴酚蓝前缘达到分离胶时,调节恒压电泳至120V,电泳直至溴酚蓝达到胶底部。电泳结束后立即转膜,恒压电流330V,1h。转膜结束后配5%BSA封闭液,室温封闭2h,可适当延长。根据抗体说明书和目的蛋白信号强弱,用5%BSA稀释一抗,一抗4℃孵育过夜。次日回收一抗稀释液,TBST洗膜三次,每次10min后,根据二抗说明书和目的蛋白信号强弱,以合适比例稀释二抗,二抗室温孵育1h。再用TBST洗膜三次,每次10min后,采用ECL发光。观察目的蛋白条带强弱趋势,分析实验结果。
2 结果
2.1 突变质粒的构建与酶切鉴定 DDX6-WT由483个氨基酸组成,其C端带有Flag和His标签蛋白。根据突变位置,分别命名无解旋酶活性的突变体和同时无ATP酶、解旋酶活性的突变体为DDX6-EQ(碱基序列第739位碱基由G突变为C,导致蛋白质序列第247位的谷氨酸(Glu)突变为谷氨酰胺(Gln)),和DDX6-△C(C端截去编码氨基酸的549个碱基,导致C端截去183个氨基酸)。突变体模式见插页图1。在表达载体pENTER的多克隆酶切位点上,DDX6-WT片段两端对应的限制性核酸内切酶位点为AsiSI和MLμL。使用AsiSl/MLμL双酶切后进行琼脂糖凝胶电泳,得到一条约7.5kb的载体pENTER片段和目的片段。目的片段分别约为1.4kb,1.4kb 和 0.9kb,见插页图 2。
2.2 序列分析 将突变体送至杭州擎科梓熙生物技术有限公司进行双向测序,将突变序列在BLAST中进行比较,在Chromas中核实,达到预期设计,见插页图3。
2.3 细胞水平蛋白验证 在蛋白质水平使用Western Blot检测。将DDX6-WT和突变体分别转染入Huh7细胞后,孵育48h,收获细胞蛋白。Western Blot检测可见 DDX6-WT、DDX6-EQ、DDX6-△C 蛋白。DDX-WT和DDX6-EQ蛋白分子量为54kD,DDX6-△C蛋白分子量为34kD。符合预期,提示能正常表达相对应的蛋白,再次证实DDX6突变体构建成功,见插页图4。
3 讨论
RNA在许多细胞过程中发挥着重要作用,包括mRNA的剪切,核糖体生物合成和翻译。RNA分子拥有特异性二级和三级结构,尽管这些结构在调节RNA功能上发挥着至关重要的作用并引导着基因表达的调节,mRNA仍需要具有恰当结构的辅助分子来发挥其功能。特别是复杂的mRNA结构的解旋,这对于mRNA与核糖体结合进而翻译产生蛋白质非常重要。
RNA解旋酶被认为具有展开双链RNA(doublestranded RNA,dsDNA)的能力,或通过ATP水解释放能量来修饰RNA-RNA之间的相互作用[8-9]。DDX家族蛋白表现出典型的SF2的特征。在SF2中,与解旋功能相关的核心氨基酸残基构成共价连接的球状结构域,分别命名为区域1(domino 1,D1)和区域2(domino 2,D2),表现为 RecA-ATP 酶折叠。D1位于N端,包含基序Q、基序Ⅰ、基序Ⅰa、基序Ⅰb、基序Ⅱ和基序Ⅲ。D2位于C端,包含基序Ⅳ、基序Ⅴ、基序Ⅵ。基序Ⅰ和基序Ⅱ能与三磷酸腺苷(nucleoside triphosphate,NTP)和镁离子结合,调节NTP水解的功能。在这两基序中间的基序Ia和基序Ib则能调节核酸的结合。基序Ⅲ与NTP的水解活动相关。基序Ⅳ、和基序Ⅴ与RNA的结合相关。基序Ⅵ则涉及了与NTP水解有关的构象变化[3]。
有临床试验通过免疫组织化学研究发现,28例直肠癌患者中,54%的患者表现出DDX解旋酶过度表达。DEAD box蛋白MrDb是c-Myc基因的一个靶蛋白,可以显著地促进细胞增殖。研究证实,RCK/p54参与了癌基因如c-Myc、E1A或其他生长相关基因的mRNA翻译,这可能是因为RCK/p54本身与癌基因c-Myc、E1A或其他生长相关基因等相关联[10]。MicroRNA(miRNA)在蛋白质合成的过程中起到关键作用,在miRNAs诱导的的沉默复合体(miRNA-induced silencing complex,miRISC) 的影响下,miRNA可靶向mRNA的翻译,加快mRNA的凋亡。mRNA的降解起始于脱腺苷酶复合物CCR4-NOT缩短多聚A尾,随后5’帽结构被移除,mRNA被核酸外切而降解。CCR4-NOT的组分CNOT1与DDX6可直接结合。如果打断DDX-CNOT1之间的结合,可损伤miRISC介导的人类基因沉默[11]。在结肠癌中,miR NA124能直接靶向DDX6,抑制DDX6的翻译,诱导结肠癌细胞的凋亡[12]。DDX家族蛋白eIF4A存在于真核细胞转录起始因子4F(eukaryotic translationinitiation factor 4F,eIF4F)复合体中,能联合p220和帽结合蛋白eIF4E在翻译起始中发挥重要作用。因此,DDX6能够促进基因细胞mRNA的翻译、增殖和恶性转移。另外,miR-143和miR-145作为肿瘤抑制因子,被宿主基因NCR143/145调控,DDX6可以通过下调NCR143/145的表达来促进胃癌的进展,在人胃癌样本中,DDX6表达量远高于正常胃组织[13]。但对于其功能域具体怎样发挥作用尚不清楚。
在本研究中,我们利用引物引入突变,截去DDX6的D2区域,使其失去ATP酶和解旋酶活性,将该突变体命名为DDX6-△C,或使DEAD区域上的碱基发生点突变,使其由编码谷氨酸变为编码谷氨酰胺,失去解旋酶活性,将该突变体命名为DDX6-EQ并用Western Blot检测其蛋白表达水平,这为进一步研究DDX6在癌症进展过程中的作用提供实验基础。

图1 突变体模式图

图 2DDX6-WT、DDX6-EQ、DDX6-△C 双酶切鉴定

图 3DDX6-WT、DDX6-EQ、DDX6-△C 序列比较
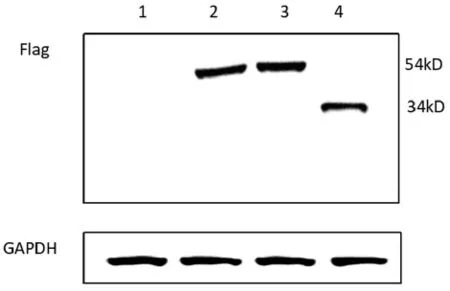
图 4 DDX6-WT、DDX6-EQ、DDX6-△C Western Blot鉴定
