卵巢癌患者外周血Treg细胞和Th1、Th2细胞因子的变化及其与临床病理特征的关系
2019-04-29崔彭华李志艳张玉娟刘莉
崔彭华,李志艳,张玉娟,刘莉
(承德医学院附属医院1.妇科,2.检验科,河北 承德067000)
卵巢癌死亡率在妇科恶性肿瘤中高居首位[1];晚期卵巢癌5年生存率低于30%,而早期高于75%,所以卵巢癌的早期诊断是提高5年生存率的关键[2]。由于当前还没有成熟的诊断措施,大部分卵巢癌发现时已处于晚期,治疗效果差[3]。研究发现,大部分肿瘤的发生和发展与机体的免疫功能状态高度相关[4]。有学者发现,较多肿瘤中存在Th1细胞亚群向Th2细胞亚群偏移的现象[5]。Treg细胞是具有免疫调节作用的抑制性细胞亚群,对肿瘤免疫应答起到抑制作用,能够介导肿瘤的免疫逃逸[6]。本研究主要探讨卵巢癌患者外周血中Treg细胞占T细胞的百分比以及Th1细胞和Th2细胞因子的表达水平,分析其与临床及病理特征的关系。
1 对象与方法
1.1 一般资料
选择2016年9月至2017年9月我院妇科收治的经腹腔镜卵巢癌根治切除手术治疗并经病理确诊的卵巢癌患者60例,设为恶性组,平均年龄(54.75±5.23)岁。FICO分期:Ⅰ期12例,Ⅱ期10例,Ⅲ期33例,Ⅳ期5例。另选择同期医院收治的卵巢良性疾患60例设为良性组,年龄为(52.98±5.35)岁;其中,子宫肌瘤35例,卵巢囊肿16例,子宫内膜异位症4例,良性畸胎瘤5例。另选取同期健康体检妇女60例作为对照组,平均年龄为(53.48±5.73)岁。3组一般资料比较差异无统计学意义,具有可比性。该研究符合伦理学的相关规定,同时在釆集标本前获得受试者的知情同意。
患者纳入标准:年龄20~75岁;经过病理学检查初次确诊为卵巢癌或卵巢良性肿瘤;资料完整;签署知情同意书。排除标准:接受过卵巢癌放疗、化疗或外科手术治疗;卵巢癌为非原发瘤或合并其他肿瘤;合并感染;合并免疫系统疾病;合并严重肝、肾疾病。
1.2 样本收集及检测
采集受试者清晨空腹外周静脉血3 mL,置于肝素钠抗凝管中。采用三色法测定Th1、Th2及Treg细胞数,具体方法步骤参照王丽华等[7]的测定标准:取全血,4℃行6 000 r/min离心10 min,取血清;采用人Th1/Th2/Th17细胞因子试剂盒(购自上海研卉生物科技有限公司)测定IL-2、INF-γ、肿瘤坏死因子-α(TNF-α)、IL-4及IL-10,具体实验步骤参照试剂盒说明书。
1.3 统计学方法
2 结果
2.1 3组外周血Th1和Th2类细胞因子含量和Treg细胞比例比较
对照组和良性组IL-2、IL-4、IL-10、INF-γ、TNF-α以及Treg细胞占外周血CD4+T细胞比例间的差异均无统计学意义(P均>0.05)。恶性组IL-2、INFγ、TNF-α水平明显低于对照组和良性组,而IL-4、IL-10以及Treg细胞比例均明显高于对照组和良性组(P均<0.05)。见表1。
表1 各组外周血Th1和Th2类细胞因子含量和Treg细胞比较 n=60,±s
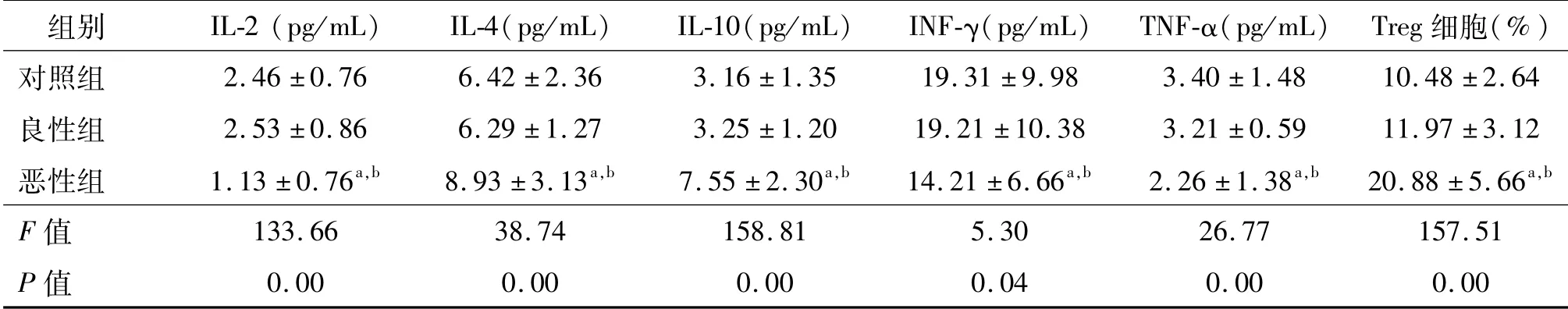
表1 各组外周血Th1和Th2类细胞因子含量和Treg细胞比较 n=60,±s
a:P<0.05,与对照组比较;b:P<0.05,与良性组比较
组别 IL-2(pg/mL) IL-4(pg/mL) IL-10(pg/mL) INF-γ(pg/mL) TNF-α(pg/mL) Treg细胞(%)对照组 2.46±0.76 6.42±2.36 3.16±1.35 19.31±9.98 3.40±1.48 10.48±2.64良性组 2.53±0.86 6.29±1.27 3.25±1.20 19.21±10.38 3.21±0.59 11.97±3.12恶性组 1.13±0.76a,b 8.93±3.13a,b 7.55±2.30a,b 14.21±6.66a,b 2.26±1.38a,b 20.88±5.66a,b F值133.66 38.74 158.81 5.30 26.77 157.51 P值0.00 0.00 0.00 0.04 0.00 0.00
2.2 不同临床分期Th1、Th2细胞因子和Treg细胞的变化
如表2所示,随着恶性卵巢癌临床分期提高,INF-γ、TNF-α细胞因子水平逐渐降低(P<0.05);IL-2水平呈下降趋势,但差异无统计学意义(P>0.05);IL-4(除Ⅱ期外)和IL-10表达水平以及Treg细胞所占的比例逐渐升高(P<0.05)。
表2 不同临床分期Th1、Th2细胞因子含量和Treg细胞比例比较 ±s
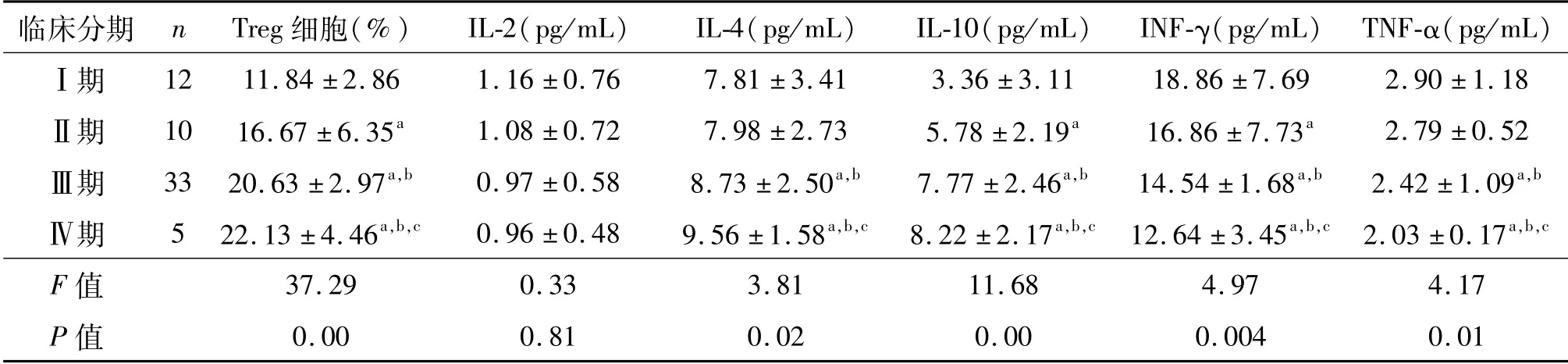
表2 不同临床分期Th1、Th2细胞因子含量和Treg细胞比例比较 ±s
a:P<0.05,与Ⅰ期比较;b:P<0.05,与Ⅱ期比较;c:P<0.05,与Ⅲ期比较
临床分期 n Treg细胞(%) IL-2(pg/mL) IL-4(pg/mL) IL-10(pg/mL) INF-γ(pg/mL) TNF-α(pg/mL)Ⅰ期 12 11.84±2.86 1.16±0.76 7.81±3.41 3.36±3.11 18.86±7.69 2.90±1.18Ⅱ期 10 16.67±6.35a 1.08±0.72 7.98±2.73 5.78±2.19a 16.86±7.73a 2.79±0.52Ⅲ期 33 20.63±2.97a,b 0.97±0.58 8.73±2.50a,b 7.77±2.46a,b 14.54±1.68a,b 2.42±1.09a,bⅣ期 5 22.13±4.46a,b,c 0.96±0.48 9.56±1.58a,b,c 8.22±2.17a,b,c 12.64±3.45a,b,c 2.03±0.17a,b,c F值37.29 0.33 3.81 11.68 4.97 4.17 P值0.00 0.81 0.02 0.00 0.004 0.01
2.3 不同病理特征下Th1、Th2细胞因子浓度和Treg细胞比例的变化
如表3所示,与黏液性和其他组织学分型相比,浆液性卵巢癌IL-4、IL-10及TNF-α水平明显升高(P均<0.05);黏液性与其他组织学分型上述指标间差异无统计学意义(P均>0.05);不同组织学分型卵巢癌的Treg细胞比例差异无统计学意义(P>0.05)。
表3 不同组织学分型Th1、Th2细胞因子含量和Treg细胞比例比较 ±s

表3 不同组织学分型Th1、Th2细胞因子含量和Treg细胞比例比较 ±s
a:P<0.05,与浆液性比较
组织学分型 n Treg细胞(%)IL-2(pg/mL)IL-4(pg/mL)IL-10(pg/mL)INF-γ(pg/mL)TNF-α(pg/mL)浆液性 37 20.87±5.02 1.15±0.58 12.18±1.38 10.37±2.98 14.80±2.69 4.18±1.53黏液性 18 20.66±5.35 1.19±0.73 7.08±0.73a 5.78±1.19a 14.36±5.76 1.89±0.33a其他 5 20.23±4.13 1.07±0.20 6.74±1.12a 5.41±0.79a 14.17±3.87 1.71±0.53a F值2.07 0.743 42.25 56.34 0.42 25.68 P值0.22 0.737 0.00 0.00 0.71 0.00
3 讨论
Treg细胞在肿瘤免疫应答中发挥重要作用,正常生理状态下维持机体自身的稳定,病理状态下可促进肿瘤发生发展。Th1、Th2细胞因分泌的主要细胞因子不同,在肿瘤免疫中发挥着不同作用[2,8-9]。本研究结果显示,卵巢癌患者Treg细胞占CD4+T淋巴细胞百分比明显高于健康者和卵巢良性疾患者,Th1和Th2细胞因子均有异常表达;此外,Treg细胞比例、Th1和Th2细胞因子浓度与临床分期、组织学分型有关。Th1细胞所诱导的免疫应答能够抑制恶性肿瘤的增殖,且其可通过分泌IL-2、IFN-γ、TNF-α等因子,介导细胞毒性T细胞,同时可激活巨噬细胞,影响B细胞功能[10]。若肿瘤患者体内Th1细胞少于Th2细胞,机体细胞免疫功能就会受到影响,从而促进肿瘤的发生发展。Th2细胞主要分泌IL-4、IL-10等因子,可一定程度抑制机体的抗肿瘤免疫能力[11]。本研究结果显示,对照组和良性组Th1、Th2细胞分泌的细胞因子水平无明显差异,但恶性组Th1细胞分泌的细胞因子IL-2、INF-γ、TNFα水平较对照组和良性组明显降低,而Th2细胞分泌的细胞因子IL-4、IL-10较对照组和良性明显增高;由此表明,恶性卵巢癌的发生与Th1和Th2细胞因子的分泌量相关,与以往研究一致[12]。此外,临床分期越高,IL-2、INF-γ、TNF-α水平降低,IL-4和IL-10含量升高,且浆液卵巢癌上皮肿瘤TNF-α、IL-4和IL-10含量也升高;符婕等[13]研究发现,浆液性腺癌患者IL-10及TNF-α表达水明显高于其他组织分型患者;本研究结果与其相似。
研究显示,在喉癌、膀胱癌、肺癌等肿瘤患者的外周血中,存在CD4+T细胞各亚群失衡现象[10,14]。CD4+T淋巴细胞包括Th1、Th2及Treg细胞等,这些细胞亚群有可塑性,能够利用细胞因子之间的相互影响、制约来维持动态平衡[15]。Treg细胞是具有免疫调节功能的抑制性细胞亚群,占CD4+T淋巴细胞5%~15%,在天然免疫和获得性免疫反应中都起到重要的调节效应。本研究发现,对照组和良性组间Treg细胞占比差异不明显,而恶性组明显高于对照组和良性组;对照组和良性组各指标水平比较无统计学差异(P>0.05)。Treg细胞在抗肿瘤免疫应答中发挥抑制效应,介导肿瘤免疫逃逸[16]。以上结果表明,Treg细胞数量上升和Th1/Th2细胞因子失衡与卵巢癌的发生密切相关,并与以往研究一致[17]。另外,不同临床分期Treg细胞比例不同,其可能的原因是临床分期越高,肿瘤细胞增殖越快,Treg细胞的比例也会越高。
综上所述,本研究提示Th1、Th2细胞因子和Treg细胞在卵巢癌的发生、发展过程中发挥重要作用,可应用于卵巢癌的早期诊断及病情监测。Treg细胞与Th1、Th2细胞因子之间如何相互协调,进而影响卵巢癌的发展有待于后续进一步研究。
