宫颈癌组织和Hela细胞中miR-664的表达及其对顺铂化疗敏感性的影响
2019-04-29魏茜雪秦雪陈青青严丽梅
魏茜雪,秦雪,陈青青,严丽梅
(中国医科大学附属盛京医院妇科,辽宁 沈阳110004)
已有研究表明,miRNA可能通过调节基因调节宫颈癌的发生、生长和进展的各个阶段[1]。在众多调节癌症的miRNA中,miR-664涉及癌细胞发生、肿瘤生长、分化和癌细胞凋亡的许多方面。肝细胞癌中的miR-664上调,下调miR-664能抑制肝癌生长[2]。在乳头状甲状腺癌和散发性乳腺癌中miR-664显著下调,但其功能作用尚不清楚[3]。本研究拟探讨miR-664在宫颈癌组织和细胞株中的表达水平及对顺铂化疗敏感性的影响及其机制,为宫颈癌的诊断及治疗提供依据。
1 资料与方法
1.1 临床资料
2011年5月至2014年7月在我院妇科行手术治疗并经病理证实的宫颈癌患者142例,年龄为40~74岁,平均(57.5±17.8)岁,病程为9个月~4年,其中绝经后患者79例,平均绝经年限8年。142例中,鳞癌82例、腺癌60例;人乳头瘤病毒(human papillomavirus,HPV)阳性114例。所有患者行辅助检查:血常规、尿常规、血生化、宫颈病理组织检查。病理分期采用TNM分期(AJCC癌症分期手册)。所有病例均符合美国国家综合癌症网(NCCN)公布的2012版宫颈癌诊断标准[4]。将手术切除标本进行病理学检查以判定临床病理学特征。同时取距宫颈癌组织3 cm以上的宫颈组织作为癌旁组织。患者均自愿提供正常宫颈组织及宫颈癌组织标本进行miR-664表达的检测。
1.2 细胞株、主要仪器与试剂
Hela-229细胞(上海栩冉生物科技有限公司),DMEM培养基(美国Invitrogen),胰酶(美国Gibco公司),四甲基偶氮唑蓝(北京广源恒信科技发展有限公司),miR-664拟似物(上海伯豪生物技术有限公司),吖啶橙(碧云天生物技术公司),胎牛血清(武汉普诺赛生命科技有限公司),Trizol试剂(美国Invitrogen公司),二甲基亚砜(99.9%,美国Sigma公司),Transcriptor first strand cDNA synthesis kit(日本TaKaRa公司),实时荧光定量PCR仪(美国热电公司),One Step PrimeScript miRNA cDNA合成试剂盒(日本TaKaRa公司),SYBR Premix Ex Taq II(日本TaKaRa公司),NanoDrop2000c型蛋白核酸检测仪(美国Thermo公司),BD BiocoatTMMatrigelTM基质(上海伟进生物科技有限公司),聚碳酸酯孔滤膜(上海正晃商贸有限公司),Caspase-3、Caspase-9浓度检测ELISA试剂盒(上海伯豪生物技术有限公司),MK3酶标仪(美国Thermo公司)。
1.3 qRT-PCR检测宫颈癌组织及癌旁组织miR-664的表达
采用Trizol试剂从宫颈癌组织和癌旁组织中提取总RNA。使用One Step PrimeScript miRNA cDNA合成试剂盒将RNA逆转录为cDNA,并使用SYBR Premix Ex Taq II进行定量实时PCR。使用内源性U6小核RNA(U6)进行标准化(U6正向引物,5′-CTCGCTTCGGCAGCACA-3′; 反 向,5′-AACGCTTCACGAATTTGCGT-3′)。通 过2-ΔΔCT方 法 计 算miR-664相对表达水平。PCR引物序列:miR-664正向引物,5′-AGTCTATACAAGGGCAAGCTCTC-3′,反向引物,5′-CCCAATACGACCAAATCCGTT-3′。反应体系:正向引物10μL、反向引物10μL、RNA模版0.6μL、超级酶混合物0.2μL、qRT-PCR缓冲液5 μL、去RNA水3.4μL。循环如下:95℃持续10 min,进行40个循环,60℃持续15 s。根据miR-664表达水平,≤0.95为阴性,>0.95为阳性[5]。
1.4 细胞复苏培养及Hela-229细胞miR-664拟似物转染
将宫颈癌Hela-229细胞株加入到含1%青霉素-链霉素的RPMI 1640中,置于37℃、5%CO2、20%O2培养箱。当细胞融合率达到80%时,用0.5%胰蛋白酶消化传代。
将10 mL Hela-229癌细胞液接种于6孔板,取100 pmol的miR-664拟似物加入到200μL DMEM培养基中,另外取4μL Lipofectamine2000加入,混匀lipofectamine2000和miRNA 液,室温培育30 min,将混合液加入6孔板中,无菌PBS洗涤细胞,6 h后弃混合液,加入含胎牛血清的DMEM培养基培养24 h,流式细胞仪检测转染效率。
1.5 细胞分组
将Hela-229细胞分为3组。对照组:取10 mL(5×106)Hela-229细胞液加入到含10%胎牛血清的DMEM 培养液中,置于CO2培养箱(37℃、5%CO2、20% O2);顺铂组:在与对照组相同量培养液与细胞液中,加入顺铂(5μmol/L)5 mL;顺铂+转染组:取10 mL转染miR-664的Hela-229细胞液,加入顺铂(5μmol/L)5 mL,置于CO2培养箱(37℃、5% CO2、20% O2)。以上各组每孔设6个平行样,培养72 h。
1.6 MTT法检测Hela-229细胞活力及癌细胞单克隆形成数目检测
将各组Hela-229细胞液接种于6孔板,每孔加入MTT溶液(5 mg/mL)10μL,37℃恒温箱孵育4 h,加入150μL的二甲基亚砜,采用酶标仪于490 nm波长处检测光密度(D)值。将细胞培养在含10%胎牛血清的DMEM(12孔板,1×103细胞/孔,每孔设6个平行样)。培养5 d后,用亚甲蓝染色细胞,倒置显微镜计数成像区域中的菌落形成数目(×400)。
1.7 流式细胞术检测Hela-229细胞株凋亡及细胞周期
将Hela-229细胞培养72 h后,通过胰蛋白酶消化收集细胞。然后将细胞用膜联蛋白Ⅴ-FITC和PI溶液在黑暗中染色15 min。最后,采用流式细胞术检测细胞凋亡及细胞周期。
1.8 Transwell细胞迁移实验
将2 mm厚的Matrigel凝胶(8.2 g/L)均匀平铺于聚碳酸酯微孔滤膜上,3组Hela-229细胞液(细胞密度为5×106/mL)各取60μL加入小室,并加入1 000μL含10%胎牛血清的DMEM培养基;室温培育12 h后,使用无菌医用棉签轻微刮除滤膜小室的细胞,4%多聚甲醛固定,0.1%结晶紫染色30 min。高倍镜下选取中心和四周各5个视野,计数每个视野内穿过8μm微孔的细胞数。
1.9 qRT-PCR检测Hela-229细胞miR-664表达
上述3组Hela-229细胞培养结束后,无菌收集细胞。取5 mL细胞液(细胞密度为5×106/mL),5 000 r/min离心5 min,-70℃冻存备用。qRTPCR检测miR-664表达水平,方法同“1.3”。
1.10 ELISA 法检测Hela-229细胞培养液中Caspase-3、Caspase-9的浓度
Hela-229细胞培养72 h后,5 000 r/min离心收集各组细胞,加入PBS制成细胞悬液后,采用ELISA法测定培养液中Caspase-3、Caspase-9的质量浓度。具体步骤按试剂盒说明书进行。
1.11 统计分析
采用Epidata、SPSS 19.0软件对数据进行录入、统计学分析。计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,组间比较采用LSD-t检验,计数资料以率(%)表示,采用卡方检验,检验水准α为0.05。
2 结果
2.1 宫颈癌组织中miR-664表达量
qRT-PCR检测结果显示,宫颈癌组织中miR-664相对表达量为0.95±0.38,明显低于癌旁正常组织(3.53±0.09,t=78.728,P<0.01)。
2.2 miR-664表达与临床病理特征的关系
表1可见,miR-664表达与年龄相关性不明显(P>0.05);与TNM分期、病理学分级、复发、淋巴结转移相关性明显,且TNM分期越高、病理学分期越高、有复发、有淋巴结转移者miR-664阳性表达率越低(均P<0.01)。
2.3 各组Hela-229细胞miR-664表达水平比较
qRT-PCR检测结果显示,顺铂组、顺铂+转染组miR-664的表达均明显高于对照组(均P<0.01),顺铂+转染组miR-664表达也显著高于顺铂组(P<0.01)。见图1。结果表明miR-664转染成功,顺铂能诱导miR-664高表达。
2.4 各组Hela-229细胞存活率
MTT检测结果显示,顺铂组、顺铂+转染组细胞存活率分别为(42.01±8.24)%、(24.36±3.21)%,均明显低于对照组[(78.52±8.25)%,F=19.369,P<0.01];而顺铂+转染组细胞存活率又显著低于顺铂组(t=21.159,P<0.01)。结果表明,miR-664能抑制Hela细胞的增殖。
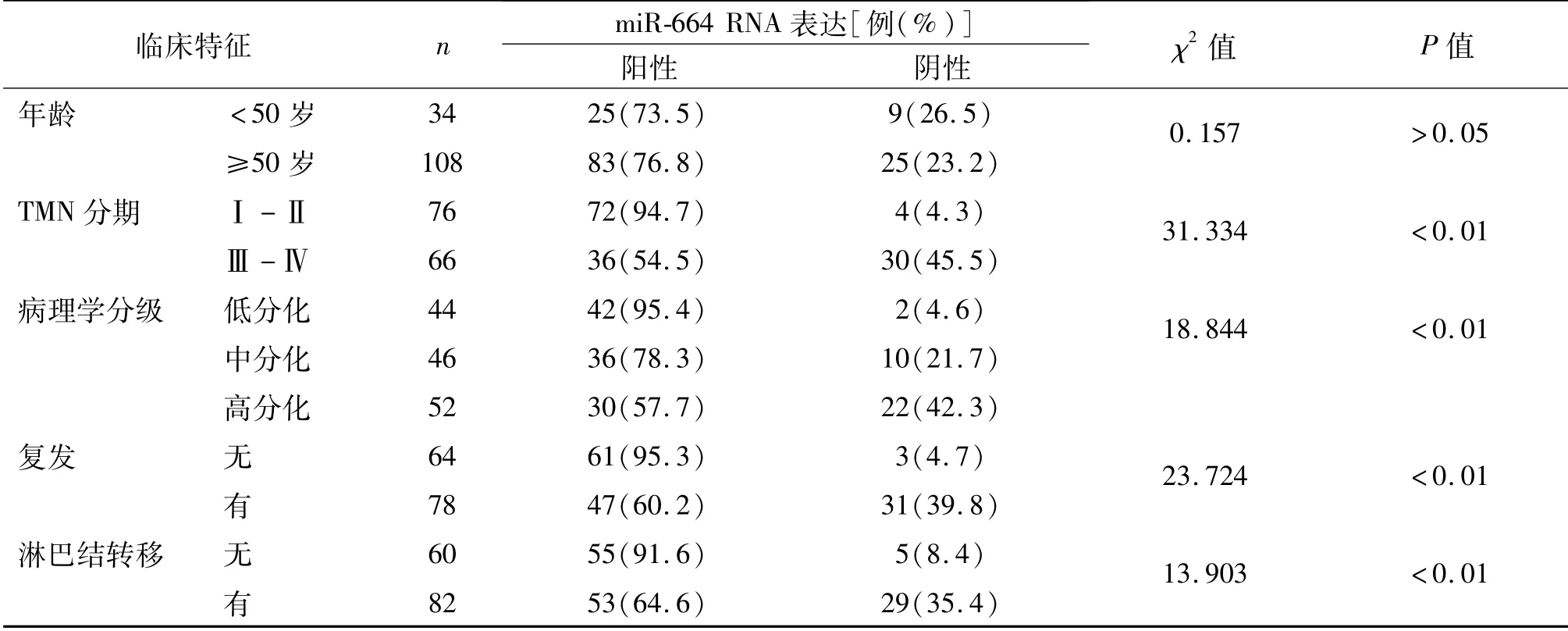
表1 miR-664 RNA表达与宫颈癌患者临床病理特征的关系
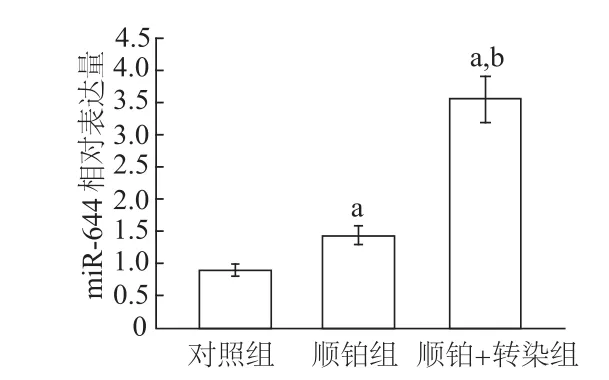
图1 各组Hela-229细胞miR-664表达量比较
2.5 各组Hela-229细胞单克隆形成数目
Transwell实验结果显示,顺铂组、顺铂+转染组细胞单克隆形成数目均显著低于对照组(P<0.01),顺铂+转染组细胞单克隆形成数目又明显低于顺铂组(P<0.01)。见图2。
2.6 各组Hela-229细胞凋亡率比较
流式细胞术检测结果显示,顺铂组、顺铂+转染组细胞凋亡率均显著高于对照组(均P<0.01),顺铂+转染组细胞凋亡率又明显高于顺铂组(P<0.01)。见图3。
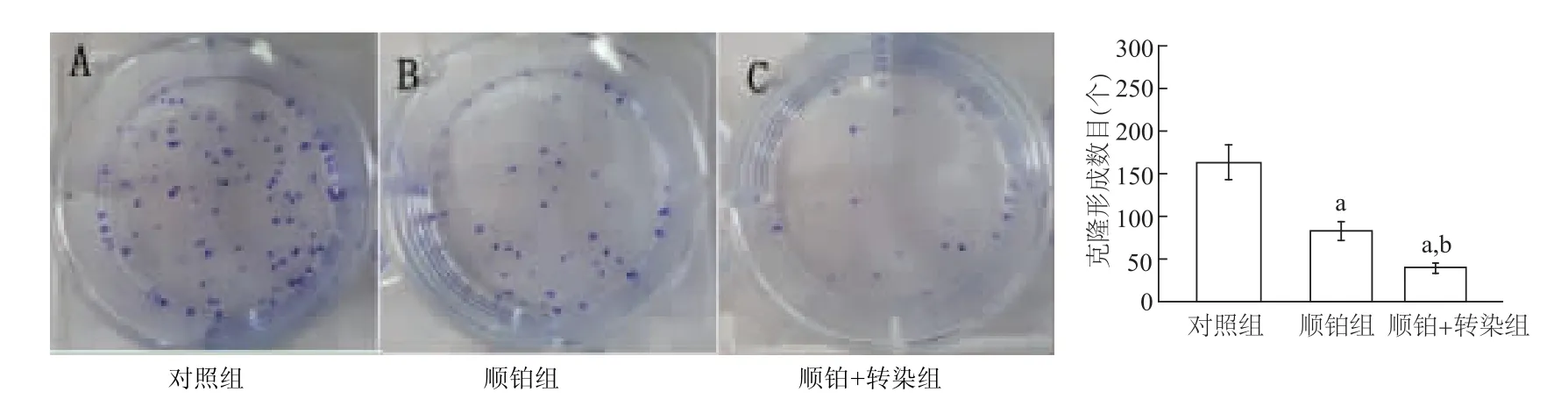
图2 各组Hela-229细胞单克隆形成数目
2.7 各组Hela-229细胞G1期比较
顺铂组、顺铂+转染组G1期细胞比例分别为(55.88±0.95)%、(45.43±0.84)%,均显著低于对照组[(67.96±1.06)%,均P<0.01];顺铂+转染组G1期细胞比例又显著低于顺铂组(P<0.01)。见图4。
2.8 各组Hela-229细胞穿膜数比较
Transwell细胞迁移实验结果显示,顺铂组、顺铂+转染组细胞穿膜数均明显低于对照组(均P<0.01),顺铂+转染组细胞穿膜数又显著低于顺铂组(P<0.01)。见图5。
2.9 各组Hela-229细胞培养液Caspase-3、Caspase-9浓度比较
ELISA检测结果显示,顺铂组、顺铂+转染组细胞培养液中的Caspase-3、Caspase-9质量浓度均显著高于对照组(均P<0.01),而顺铂+转染组细胞培养液Caspase-3、Caspase-9浓度又显著高于顺铂组(P<0.01)。见表2。
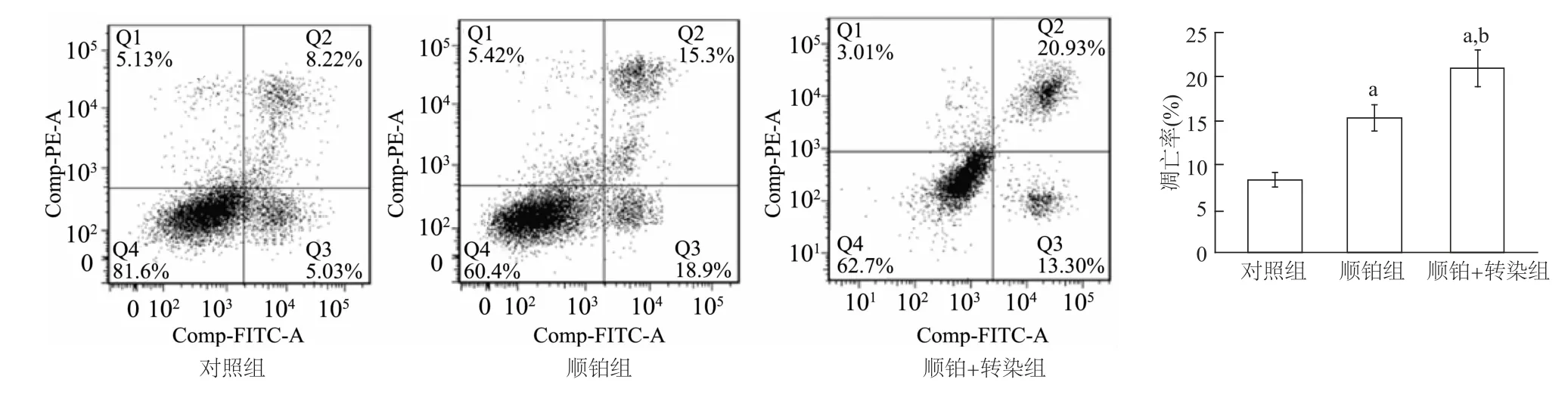
图3 流式细胞术检测各组Hela-229细胞凋亡率
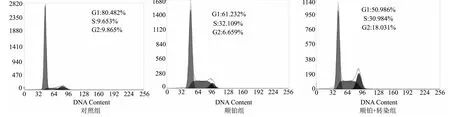
图4 各组Hela-229细胞G1期比较

图5 各组Hela-229细胞穿膜数的比较
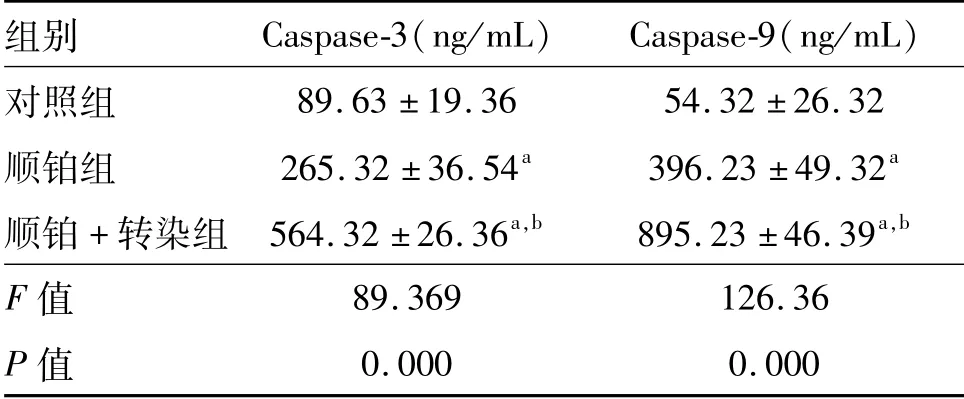
表2 各组Hela-229细胞培养液Caspase-3、Caspase-9浓度n=6
3 讨论
肝癌体外实验表明,NF-κB p65可直接抑制miR-664的转录、表达,进而间接抑制肝癌细胞的迁移和侵袭[6]。此外,在人乳腺癌细胞中,miR-664可抑制Raf激酶蛋白(RKIP)转移相关基因的表达进而抑制细胞的侵袭[7-9]。本研究结果显示,宫颈癌组织miR-664表达明显低于癌旁组织,miR-664与TNM分期、病理学分级、复发、淋巴结转移明显相关,且TNM分期越高、病理学分期越高、有复发、有淋巴结转移病例miR-664表达越低。本实验结果说明miR-664过表达能抑制宫颈癌细胞增殖、浸润,这与上述文献中miR-664抑制肝癌细胞的迁移和侵袭相符合。最近的研究表明,miR-664通过促进细胞凋亡,抑制淋巴管生成和血管生成,从而发挥抑制肿瘤的作用[7]。多项研究显示,miR-664在多种肿瘤中表达下调,miR-664低水平表达与不同癌症的进展相关[2]。上述结果提示miR-664在肿瘤进展和肿瘤发展中发挥关键调控作用。
细胞学实验表明,miR-664抑制肠癌细胞增殖的分子机制与 G1-S相变的加速,p21Cip1 和p27Kip1的下调以及细胞周期蛋白D1的上调有关[10]。miR-664的低表达是PI3K/AKT信号转导以及细胞周期进展至G1期的必要条件。此外,PI3K/AKT的激活增加p21Cip1和p27Kip1的细胞水平,并抑制细胞周期蛋白D1的表达,从而抑制细胞增殖[11]。金属基质酶的失调导致细胞外基质增加,这是许多肿瘤局部侵袭和转移的关键步骤。miR-664能抑制金属基质酶活性,表明miR-664在癌症的生物疗法中具有优势。miR-664抑制癌细胞侵袭,具有用于癌症基因治疗的潜在优势,表达miR-664可诱导肺癌细胞凋亡,上调p53、Fas配体、TNFR1和TNFR2的表达,促进肺癌治疗效果[12]。研究表明,miR-664可通过Caspase依赖性途径诱导细胞凋亡,miR-664的过度表达可诱导细胞色素c的释放并激活Caspase-8和Caspase-9途径,两者均导致癌细胞凋亡[13]。miR-664还可通过Fas相关依赖途径诱导细胞凋亡途径[14]。这一事实表明miR-664可能通过p53途径间接诱导细胞凋亡。本研究结果显示,顺铂组、顺铂+转染组细胞存活率、单克隆形成数目、G1期细胞比例、细胞穿膜数均明显低于对照组,细胞凋亡率、Caspase-3、Caspase-9浓度显著高于对照组;顺铂+转染组细胞存活率、单克隆形成数目、G1期细胞数、细胞穿膜数又显著低于顺铂组,细胞凋亡率、Caspase-3、Caspase-9浓度明显高于顺铂组。该结果说明miR-664能增强顺铂对宫颈癌细胞的化疗敏感性,明显抑制癌细胞增殖、迁移和浸润,其机制可能与其加速宫颈癌癌细胞凋亡、G1进程以及Caspase-3、Caspase-9过表达有关。
