3D打印PLLA/β-TCP复合人工骨及组织相容性研究
2019-04-28岑超德张永罗聪邬均刘福尧吴声忠
岑超德,张永,罗聪,邬均,刘福尧,吴声忠
(1.贵州省骨科医院骨科,贵州 贵阳 550000;2.贵阳市第一人民医院,贵州 贵阳 550000;3.重庆医科大学附属儿童医院骨科,重庆 400014)
由高能量创伤、感染、肿瘤等因素导致的骨缺损,尤其是大段骨缺损,已成为骨科临床上的一大难题,目前发生率较高[1]。传统的治疗方法主要有自体及异体骨移植、骨搬移术、Masquelet技术、人工植骨材料修复等[2-4]。然而,自体骨移植存在供体受限的问题,异体骨存在免疫排斥的弊端[5,6],骨搬移术存在痛苦大、治疗周期长的缺点[7],Masquelet技术被用于各种骨缺损的治疗并取得令人鼓舞的成果,但其存在骨量来源有限的困扰[8]。目前常用的人工植骨材料多为降解缓慢甚至不降解的材料,人工骨内部常出现成骨死角及骨缺损修复不全的情况。可见,寻求理想的人工骨成为治疗骨缺损的关键。
随着材料学的不断发展,应用各种技术制备的纳米仿生人工骨为解决这一问题开辟了一条崭新的途径,理想的人工骨应该尽量仿生天然骨的组成及结构。聚乳酸类材料属于有机高分子材料,因其具备良好的组织相容性、可降解等特性而被美国FDA批准应用于临床,其中左旋聚乳酸具有良好的力学性能,其降解产物呈酸性[9]。β-磷酸三钙具备骨引导性,脆性大,降解产物呈碱性。3D打印又名增材制造,是在计算机控制下,按照预设数据,采用合适的原料层层堆积制作实物的技术。本文结合两者材料的优缺点,基于3D打印技术仿生构建左旋聚乳酸(poly L-lactic acid,PLLA)/β-磷酸三钙(β-tricalcium phosphate,β-TCP)可生物降解复合人工骨,对其性能及组织相容性进行研究,探究其作为体内组织工程骨材料的可行性。
1 资料与方法
1.1 实验材料 左旋聚乳酸(PLLA,Mw=50 000,济南姝远生物科技有限公司),β-磷酸三钙(β-TCP,d50=0.2~5.0 μm,纯度99%,南京埃普瑞纳米材料有限公司)。C3H10细胞(重庆医科大学附属儿童医院干细胞库),DMEM培养基、胎牛血清(Gibco公司),PBS缓冲液(碧云天生物技术研究所),绿色荧光蛋白腺病毒(Ad-green fluorescent protein,Ad-GFP)、骨形态发生蛋白-9腺病毒(Ad-bone morphogenetic protein-9,Ad-BMP9)(芝加哥大学医学中心何通川教授惠赠),茜素红S、碱性磷酸酶(alkaline phosphatase,ALP)定量检测试剂盒、萘酚AS-MX碱性磷酸盐溶液和快速蓝重氮盐(美国Sigma公司)。C3H10细胞(小鼠骨髓来源的间充质干细胞,由重庆医科大学附属儿童医院儿科研究所干细胞实验室提供)。
1.2 实验仪器 3D打印机(型号Bio-Architect®-Lite,杭州捷诺飞生物科技股份有限公司),水银孔率计(AutoPore IV 9500,英国Micromeritics),动静态疲劳试验机(型号3330,美国BOSE公司),扫描电镜(型号S-3000N,日本日立公司)。
1.3 PLLA/β-TCP复合人工骨的制备 先利用三维计算机辅助设计(Computer aided design,CAD)软件设计支架材料。材料属性设置为直径8 mm、壁厚3 mm、长2.0 cm的中空圆柱状结构,孔径为400 μm,孔隙率60%。将设计完成的材料转换成STL格式并输入3D打印机。具体过程:将适量的PLLA(Mw=50 000)和β-TCP溶于1、4-二氧六环中,PLLA与1、4-二氧六环的质量体积比为15%,PLLA与β-TCP的质量比分别为(4︰1,2︰1及3︰2,分别简称为P/T20,P/T30及P/40),磁力搅拌器匀速搅拌形成均一膏状原料备用。调整3D打印机相关属性参数进行材料打印(喷头直径400 μm,速度2 mm/s)。本实验选用的3D打印技术是在熔融沉积造型术(fused deposition modeling,FDM)基础上选用生物挤压方法进行打印PLLA/β-TCP复合人工骨,紫外线消毒后备用。
1.4 PLLA/β-TCP复合人工骨的物理性能检测
1.4.1 PLLA/β-TCP复合人工骨的微观结构 复合人工骨试样经喷金后,于扫描电镜(scanning electron microscopy,SEM)下观察其微观结构。
1.4.2 PLLA/β-TCP复合人工骨的孔隙率 复合人工骨的孔隙率根据以下公式进行测定[10]:孔隙率=(1-ρa/ρt)×100%(其中ρa为复合人工骨的实际密度,将人工骨浸入水银液体中根据阿基米德原理计算出,而ρt为复合人工骨的理论密度,PLLA和β-TCP的理论密度分别为1.3 g/cm3和3.07 g/cm3)。
此外,为了比较不同方法对孔隙率测量造成的误差,用水银孔率计在压力414 Pa至3.7 kPa的范围内对PLLA/β-TCP复合人工骨进行孔隙率的测定。
1.4.3 PLLA/β-TCP复合人工骨的力学性能 人工骨的力学强度由动静态疲劳试验机进行测定。弹性模量检测样品直径为8 mm,壁厚3 mm,长9 mm。弹性模量=应力/应变(EapP=Kh/A,K=F/d,其中F为应力,d为压缩长度,A为材料横切面积,h为材料长度)。将压缩过程的应力作为纵轴、应变作为横轴,通过Matlab软件(The MathWorks)编程生成应力应变关系曲线,较为固定的一段直线区域的斜率即为人工骨弹性模量[11]。三点抗弯强度为在人工骨的两支点之间施加载荷,至试件破坏时的单位面积载荷值,由公式δfmax=8FmaxL/πd3计算出人工骨的抗弯强度(其中Fmax为最大载荷,L为两支点跨度,d为人工骨直径)[12]。其中试验机加载速度为0.1 mm/s(每组测试5个样品)。
1.5 PLLA/β-TCP复合人工骨的细胞培养 PLLA/β-TCP复合人工骨无菌PBS清洗3遍后,于20%血清培养基中提前浸泡2 h取出后放入清洁干燥的培养皿中,将制备好的C3H10细胞悬液(6×106/mL)滴入人工骨,于37 ℃、5%CO2温箱中培养3 h后加入含血清培养基。继续培养3 d后将支架取出,用0.9%生理盐水冲洗支架,4%戊二醛固定过夜,叔丁醇干燥、喷金行扫描电镜(SEM)检测。
1.6 PLLA/β-TCP复合人工骨浸提液的诱导分化作用 将2 g人工骨加入15 mL的血清培养基,37 ℃、5%CO2条件下孵育7d后离心取上清液,经0.22 μm过滤器过滤得到浸提液。按2×103/孔密度将C3H10细胞接种于12孔板中,每组3个复孔,待贴壁后吸去培养基,实验设计分组如下:a)GFP阴性对照组:加入1.5 mL含腺病毒Ad-GFP(20 μg/mL)培养基;b)PLLA组:加入纯PLLA人工骨浸提液1.5 mL;c)P/T30组:加入P/T30人工骨浸提液1.5 mL;d)BMP9(Bone Morphogenetic Protein-9)阳性对照组:加入1.5 mL含腺病毒Ad-BMP9(20 ng/mL)培养基。C3H10细胞诱导分化至第7天,加入萘酚AS-MX碱性磷酸盐溶液和快速蓝重氮盐混合染液250 μL,37 ℃避光孵育30 min,在光镜下观察并成像,阳性染色呈蓝紫色。C3H10细胞诱导分化至第21天,每孔加入300μL的4%多聚甲醛固定10 min,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤3次。每孔加入300 μL现配的0.4%茜素红S染液,37 ℃孵育30 min,在光镜下观察并成像,阳性染色为桔红色沉淀。
1.7 PLLA/β-TCP复合人工骨的组织相容性 选取健康新西兰大白兔30只,体重2.5~3.0 kg,雌雄不限。待戊巴比妥钠(30 g/L)耳缘静脉麻醉生效后制作股四头肌肌袋及臀肌肌袋,肌袋内植入纯PLLA人工骨及P/T30组复合人工骨。植入后1个月行X线透视观察复合人工骨位置及局部炎症反应情况。分别于术后第1个月、第2个月及第3个月将人工骨连同周围0.5 cm范围的组织取出,用10%甲醛固定组织1周,标本常规系列脱水及石蜡包埋固定,常规切片后行VG染色(Van Gieson染色),在光学显微镜下观察组织对材料的反应情况。按照ISO10993-2007和GB/T16886.1-1997中的组织反应分级方法进行评估。

2 结 果
2.1 PLLA/β-TCP复合人工骨的大体观 临界骨缺损即骨缺损自身不能愈合,一般认为是长骨长度的15%或者骨干直径的1.5~2.5倍[13]。根据6月龄新西兰大白兔桡骨的尺寸参数,得到以下制作人工骨的数据。如图1所示,3D打印的PLLA/β-TCP复合人工骨为直径8 mm,长2 cm的中孔圆柱状结构,壁厚3 mm,人工骨呈白色,表面粗糙,质均匀,人工骨成品的尺寸与3D打印设计的几何模型尺寸基本一致。

a 3D打印模型尺寸 b 样品大体观
图1 PLLA/β-TCP复合人工骨
2.2 PLLA/β-TCP复合人工骨的物理性能
2.2.1 PLLA/β-TCP复合人工骨的微观结构 如图2所示,扫描电镜下可见纯PLLA人工骨和含β-TCP人工骨表面粗糙,人工骨内部布满丰富的微孔,微孔直径分布在20~400 μm之间,孔隙之间存在一定的交通率。随着β-TCP含量的增加,人工骨粗糙程度增加。丰富的微孔可增加人工骨的表面积,可为细胞提供足够的生长空间。人工骨一定的孔隙交通率有利于细胞之间的相互作用、营养物质的交换、血管及神经的长入以及钙盐的充分沉积。
2.2.2 PLLA/β-TCP复合人工骨的孔隙率 人工骨的孔隙交通率和研究者的主观性可能会影响孔隙率的测定,因此孔隙率用两种不同的方法测定。如图3所示,用密度法和孔率计法所测得的人工骨孔隙率与3D打印设计的孔隙率存在一定的差距,这能为后期批量打印植入体内的人工骨提供指导性的信息。随着β-TCP含量的增高,人工骨的孔隙率呈下降趋势,用两种方法测得的孔隙率结果趋势一致(P>0.05)。这主要是受生物挤压的影响,挤压减小了人工骨整体孔隙的容积。此外,β-TCP固体颗粒的增多不同程度地提高了人工骨孔壁的厚度,人工骨的孔隙交通率下降不利于水银的渗透,这些因素均对孔隙率的测定存在一定的影响。
2.2.3 PLLA/β-TCP复合人工骨的力学性能 弹性模量是物体弹性变形难易程度的表征,而抗弯强度是外力施压时的强度极限,我们通过测定复合人工骨的弹性模量及抗弯强度来评价其机械性能。图4a所示为人工骨的应力/应变曲线,骨支架的弹性模量在应力/应变曲线上表现为一段直线区域的斜率。图4b所示,β-TCP的加入增加人工骨的韧性,减小其形变,使得弹性模量及抗弯强度相应增加,抗弯强度变化趋势与弹性模量基本一致。3D打印过程中当β-TCP含量为30%时PLLA与β-TCP能达到有效稳固的结合,此时弹性模量可高达21.1 MPa,三点抗压强度可高达9.9MPa。β-TCP的含量超过30%时复合人工骨脆性增加,复合人工骨的弹性模量及抗压强度骤降而不利于体内的应用。
2.3 PLLA/β-TCP复合人工骨的细胞培养 人工骨细胞培养是评价其细胞相容性的重要指标,也是人工骨用于体内的前提之一。如图5所示,纯PLLA人工骨细胞培养几乎未发现C3H10细胞的爬行生长,这可能与材料的疏水性质不利于细胞在材料界面吸收营养物质而增殖有关。人工骨扫描电镜观察发现P/T 20、P/T 30与P/T 40组复合支架均可见不同程度的细胞爬行生长,β-TCP的掺入改善了人工骨的亲水性质和骨引导性,且β-TCP颗粒可增加复合人工骨界面的粗糙度,这些因素是影响细胞能否黏附生长的关键。

a PLLA组 b P/T20组 c P/T30组 d P/T40组
图2 不同组分的PLLA/β-TCP复合人工骨的微观结构(×100)

图3 不同组分PLLA/β-TCP a 应力-应变曲线 b 复合人工骨的力学强度复合人工骨的孔隙率测定 图4 不同组分的PLLA/β-TCP复合人工骨的力学性能
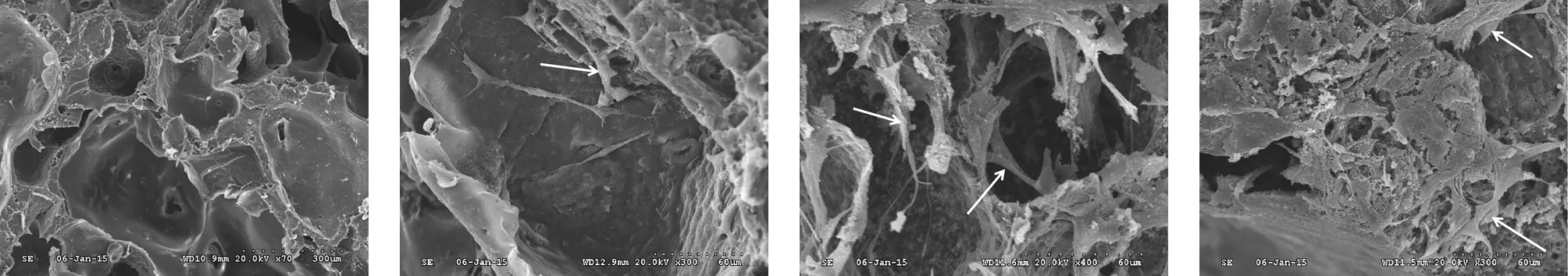
a PLLA组 b P/T20组 c P/T30组 d P/T40组
注:图中箭头所示为C3H10细胞
图5 不同组分的PLLA/β-TCP复合人工骨的细胞培养(×400)
2.4 PLLA/β-TCP复合人工骨的细胞诱导分化 由于P/T 30复合人工骨具备优良的物理性能,我们选择其作为后续的研究材料。目前公认的能诱导细胞成骨分化的因子是骨形态发生蛋白(bone morphogenetic protein,BMP),包括BMP2、BMP9等。β-TCP的掺入能否改善人工骨的细胞骨诱导性,我们将表达BMP9的腺病毒Ad-BMP9感染的细胞作为阳性对照,而将表达绿色荧光蛋白的腺病毒Ad-GFP感染的细胞作为阴性对照(如图6a及图6b)。碱性磷酸酶(alkaline phosphatase,ALP)是细胞成骨分化的早期检测指标,碱性磷酸酶在碱性环境下将体系中的α-磷酸萘酚钠水解为α-萘酚,它与重氮盐偶联后形成难溶性蓝紫色沉淀,沉积于表达酶的细胞处。如图6c所示,各组C3H10细胞经诱导分化至第7天行ALP染色,Ad-GFP组及PLLA组几乎未见蓝染细胞,P/T30组及Ad-BMP9组可见部分紫蓝染细胞,其中Ad-BMP9组较P/T30组有较多的蓝染细胞(P<0.05)。这说明单纯的PLLA人工骨不能诱导C3H10细胞表达碱性磷酸酶,而β-TCP能诱导C3H10细胞表达碱性磷酸酶,此结果一定程度地说明β-磷酸三钙具有一定的成骨诱导活性。
钙盐沉积是细胞成骨分化较晚期的检测指标,茜素红是阴离子染料,可与晚期沉积的钙离子以螯合方式形成桔红色复合物。如图6d所示,各组永生化C3H10细胞经诱导分化至第21天行茜素红染色,Ad-GFP组及PLLA组几乎未见桔红色沉淀,P/T30组及Ad-BMP9组可见部分桔红色沉淀,其中Ad-BMP9组较P/T30组明显(P<0.05),此结果与碱性磷酸酶染色结果一致,更进一步提示β-磷酸三钙具有一定程度的骨诱导活性。

a 荧光显微镜图

b 光学显微镜图

c ALP染色

d 茜素红S染色
2.5 PLLA/β-TCP复合人工骨植入肌袋试验 人工骨的最终研究目的是应用于体内,虽然PLLA的最终降解产物为CO2和H2O,而磷酸三钙降解后释放的钙、磷离子能成为机体钙磷库的成分,单一的成分均已被证实安全而广泛应用于临床,其安全性可靠。但PLLA/β-TCP复合人工骨植入体内后是否存在炎症反应是我们重点关注的问题,因此我们进行了体内植入实验。X线透视可见人工骨与兔子股骨显影效果相当,这可为支架植入体内后降解及新骨沉积的体外摄片评估提供便利(见图7a)。如图7b所示,植入后3个月,纯PLLA人工骨周围可见充血水肿的组织包裹,组织与人工骨关系疏远,较易分离。而P/T30复合人工骨周围组织未见明显充血水肿,组织与人工骨关系密切,不易分离(见图7c)。

a X线透视体内复合人工骨(箭头所示)

b PLLA人工骨连同周围0.5 cm组织大体观
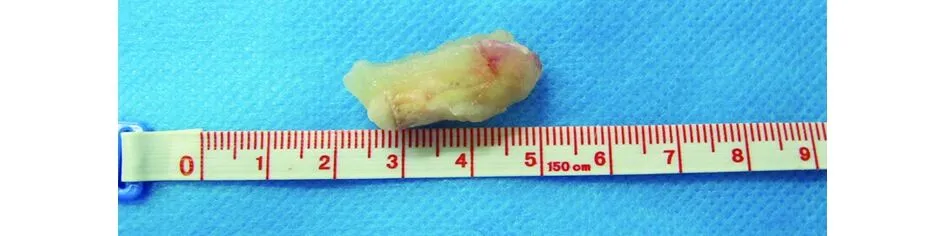
c P/T30复合人工骨连同周围0.5 cm组织大体观
2.6 PLLA/β-TCP复合人工骨的组织相容性 为了进一步研究人工骨的组织相容性,我们对植入的纯PLLA人工骨以及P/T30复合人工骨连同周围1 cm的组织进行了组织学评价。如图8所示,人工骨植入后1个月:PLLA组人工骨初步形成疏松水肿的纤维包囊,包囊组织内可见有大量的中性粒细胞和纤维母细胞浸润。而P/T 30组人工骨周围纤维包囊较疏松,纤维包囊有部分中性粒细胞浸润。人工骨植入后2个月:PLLA组人工骨表面纤维包囊致密且较厚,纤维包囊有部分中性粒细胞、淋巴细胞浸润,周围组织见少量点状充血。而P/T30组人工骨周围纤维包囊致密,纤维包囊有少量的淋巴细胞浸润。人工骨植入后3个月:PLLA组人工骨表面纤维包囊囊壁有变薄趋势,包囊内仍可见淋巴细胞浸润,偶见部分炎症细胞。而P/T30组人工骨表面局部纤维包囊变薄,由1-2胶原纤维和少量纤维细胞组成,包囊内仅见少许淋巴细胞浸润。人工骨与周围组织结合密切,界限模糊(图中单向箭头所示为炎症细胞,双向箭头所示为纤维包囊厚度)。依照国际及国家医疗器械的植入后局部反应试验标准(2003年),PLLA/β-TCP复合人工骨在体内无反应或仅有轻度的组织反应,是一种组织相容性良好的支架材料。

注:图中单向箭头示炎症细胞,双向箭头示纤维包囊厚度
3 讨 论
自1995年Crane等提出骨组织工程的概念以来,组织工程骨的发展为人类骨组织缺损的修复重建带来了全新的希望。而3D打印技术的兴起,为组织工程骨的构建提供了优越的条件。利用电脑进行辅助设计3D生物打印制作的仿生组织工程骨结构更加近似天然骨结构,并可进行个性化定制[14]。
聚乳酸类材料及β-TCP因具备良好的生物学性能常被研究者利用不同的3D打印技术来制作组织工程骨。李树祎等[15]利用低温快速成型技术制备了PLGA/TCP的骨修复支架,其孔隙丰富,生物相容性良好。许国军等[16]采用3D打印直写成型技术制备了不同成分的β-TCP/HA/PLA复合支架,支架表面粗糙而具有通孔,细胞骨诱导性明显。本实验所选用的PLLA/β-TCP复合人工骨是在常用组织工程骨材料的基础上,在熔融沉积造型术基础上选用生物挤压方法制备的新型可生物降解人工骨。
自然骨是无机纳米羟基磷灰石与有机胶原纤维规律结合的产物,具有典型的骨小梁结构,其孔隙率为50%~80%,允许骨母细胞、骨髓间充质干细胞在孔隙里的增殖分化及血管的长入[17]。人体皮质骨的弹性模量和抗弯强度分别为1.0~2.5 GPa及100~200 MPa,松质骨的弹性模量和抗弯强度分别为50~250 MPa及2~20 MPa[18]。PLLA具备良好的力学性能,β-TCP的加入可增加其韧性,本研究中3D打印的PLLA/β-TCP复合人工骨所测得的弹性模量及压缩强度接近松质骨水平。PLLA/β-TCP复合人工骨的孔径分布于20~400 μm。Zhao等[19]研究证实多孔材料有利于血管化和新骨沉积的最佳孔径是400 μm,大于该尺度的孔径对血管的新生无显著影响,反而降低材料的机械性能。Kapat等[20]研究表明孔径大于50 μm的支架有利于氧气与营养物质的交换并排除代谢废物,但细胞的黏附率及细胞之间信号传递会因此降低,而孔径小于10 μm时可取得相反的效果。因此,大径与小径微孔的结合更能促进血管的新生和骨的生成。
β-磷酸三钙具有骨引导性,但对其是否具有骨诱导性的观点目前还不统一[21-22]。有研究认为磷酸三钙的骨诱导性是由于支架材料的孔隙结构及交通率等几何因素促进了骨形态发生蛋白等成骨因子的吸附及沉积导致的[23]。Tsukanaka等[24]认为酸性磷酸酶阳性细胞的募集是高纯β-磷酸三钙骨支架具有骨诱导性的关键所在。Syed-Picardl[25]研究证实磷酸三钙是一种具有骨诱导性的材料,它通过释放钙离子来改变三维细胞支架的分化模式,释放的钙离子可以调节CD43(跨膜蛋白)介导的缝隙连接,增加胞外钙离子的浓度,诱导细胞的成骨分化。本研究避免材料界面等因素干扰,利用人工骨浸提液培养细胞,早期成骨分化后的ALP染色和晚期成骨分化后的茜素红S染色结果阳性,提示PLLA/β-TCP复合人工骨具备一定的骨诱导作用。但其作用是有限的,浸提液中钙离子浓度可能是主要的影响因素之一,复合支架中钙离子的释放受人工骨结构强度及浸泡时间的影响。要使人工骨具有明显的骨诱导性,可以在人工骨中加入骨形态发生蛋白等成分。
对生物相容性的研究常用体外细胞培养法和体内直接植入法(1988年)。本研究中体外细胞培养可见人工骨中细胞生长良好,伪足伸展充分,未见细胞萎缩溶解现象。体内植入实验组织学检测提示PLLA/β-TCP复合人工骨早期存在一定的炎症反应。炎症反应是活体组织对损伤因子所作出的防御反应,引起可降解支架材料炎症反应的因素较多,如植入手术引起创伤的范围、支架的形状、支架的表面自由能及表面电荷、支架材料的中间降解产物等[26-27]。PLLA/β-TCP复合人工骨在体内植入实验后的组织学检测结果符合国家医疗器械的植入后局部反应试验标准。
由此可见,3D打印的PLLA/β-TCP复合人工骨具备优良的三维多孔结构,力学强度佳,具备良好的细胞相容性及组织相容性,β-TCP的掺入使得复合人工骨具备一定的骨诱导性,是一种理想的可降解组织工程骨材料。然而,3D打印的组织工程骨仍存在诸多问题,如其孔隙率及孔径精确度有待提高;3D打印可生物降解材料后期的降解速度与生物力学、与成骨成血管匹配的关系有待研究。
