海洋甲藻包囊及沿革
2019-10-23张晓东
孙 军,杨 双,张晓东
(天津科技大学印度洋生态系统研究中心,天津 300457)
甲藻是海洋中的单细胞生物[1],在浮游植物中占据非常重要地位,对海洋生态系统的物质循环和能量流动具有重大贡献[2].在遇到不良环境时,有些甲藻会失去鞭毛形成不动的休眠细胞——甲藻包囊沉入海底[3].甲藻包囊有孢粉质壁[4],对外界环境的干扰有一定的抵抗力[5],可以长达数年甚至更长时间在沉积物中保持活性[6].目前世界上大约发现2 000 种甲藻,其中有200 多种可以形成相应的包囊[7],包囊在周围环境相对适宜时会重新萌发进入上层水体[8],这极大地增强了甲藻种群的延续能力.包囊大量萌发极易造成区域内相关藻华的发生,因此包囊常被称为藻华的“种源”[9].在藻华爆发的后期,沉积物中的包囊会有所增加[10-11],这也为下一次藻华的爆发奠定了基础.
藻华通常是指水体中的藻类大量繁殖从而达到一定密度的现象[12],有时又被称为赤潮.藻华的爆发有时会给周围的海洋环境造成严重的破坏[13],影响海洋养殖业的发展[14-15],甚至会威胁人类的生命健康[16-17].藻华的爆发与相关区域水体环境的变化有很大关系,尤其是水体交换能力较为薄弱的区域,极易造成水体中营养物质含量过高,引起浮游植物的大量增殖,进而使海水颜色发生变化,出现赤潮现象.包囊可以在一定程度上反映上层水体富营养化的演变[18-19],同时还可以对富营养化区域或工业污染区进行区分[20].为了更好地了解调查区域的环境变化及相关影响因素,研究者逐渐加强对沉积物中包囊的研究[21-22],试图通过探索甲藻藻华爆发的机制,提高对藻华的防治能力.
本文主要简介甲藻包囊的起源,系统梳理甲藻包囊的相关基础术语,对近年国内外甲藻包囊分子生物学、生理生态学等方面的研究进行简要回顾,并对包囊与上层浮游植物的相互关系进行探索,为甲藻包囊之后的研究提供基础知识,期望引起国内学者对该领域的关注.
1 甲藻包囊的基本概念
甲藻包囊可以帮助甲藻躲避恶劣的生存环境,许多甲藻都以休眠孢子的方式保留至今,故包囊的存在为藻种的生存、延续与扩散提供了可能性[23-25].休眠孢子主要分为3 种类型(图1[26]):似包囊(proximate cyst)、刺包囊(chorate cyst)和穴包囊(cavate cyst).
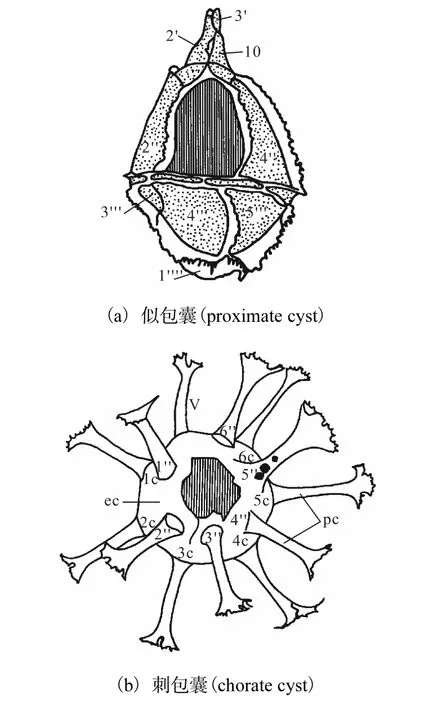

图1 甲藻包囊及类甲板方程Fig.1 Cysts of dinoflagellates and their paratabulation
似包囊即包囊与营养细胞具有完全相同的甲板形态;刺包囊的孢子壁上有分枝和管状突起,外壁和内壁紧密相接;穴包囊跟刺包囊区别之处在于外壁和内壁不紧密相接.
部分甲藻在整个生活史的过程中会因不同的因素形成两种不同类型的包囊(图2[27]),即暂时性包囊和休眠包囊.
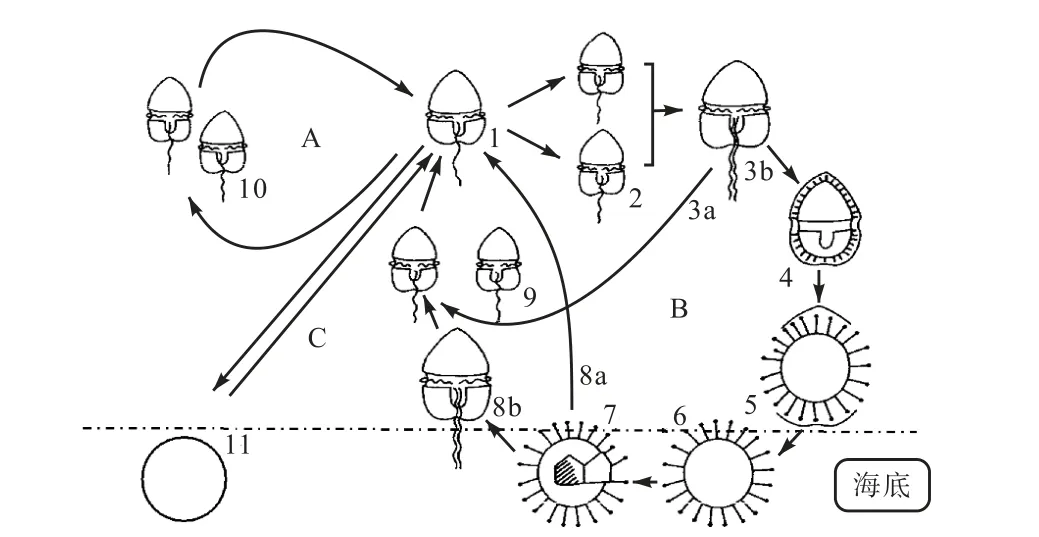
(A)无性生活史阶段:1.浮游性营养细胞;10.二分分裂;11.临时性不动孢子.(B)有性生活史阶段:2.配子对;3a.减数分裂;3b.游动合子;4、5.包囊形成过程;6.休眠孢子;7、8a.包囊萌发过程;8b.游动合子;9.浮游性营养细胞
暂时性包囊,是当水体中的营养细胞遭遇到强烈的冲击、骤然的温度变化、突然爆发的过高的生物量等不适宜其持续生长的环境变化时,营养细胞就会立即采取相应的措施——形成暂时性包囊沉入海底沉积物中.形成的暂时性包囊的包囊壁较薄[7],内部的营养物质与营养细胞的差异性不大,因此在周围环境变得相对适宜时,暂时性包囊能够在较短的时间内萌发进入水体.但若将暂时性包囊长时间处于不良环境中,其是否会失去活力而不再萌发目前还不清楚.
休眠包囊,是营养细胞在进行有性生殖阶段遭遇到恶劣的环境变化,游动合子会形成相应的休眠孢子沉入海底.休眠包囊具有一定的休眠期,休眠期约为2 周到几个月不等[28].休眠期内的包囊即使周围环境适宜其生长,也不能萌发.休眠期过后,只要环境适宜,休眠包囊就可以萌发重新进入上层浮游植物群体中[29].休眠包囊可以在特殊的环境如低氧、高沉降条件下保存较长时间[30],故对海洋环境的追溯与重建具有重要意义[31].
2 研究方法
包囊的分布与水底沉积物的类型具有一定的相关性[32],包囊在淤泥和黏土占优势的地方含量较多,在粒径较大的沉积物中含量相对较少[33],因此在获取样品时要根据实验需求选择相应的采集设备(抓斗式采泥器、重力采泥器、柱状样品采泥器),从而提高采集效率.包囊在沉积物中密度相对较低,在分析样品之前需要先对沉积物进行分离和浓缩.筛网过滤法[34]和孢粉学方法[35]是目前用的较多的分离方法,前者需要根据包囊的大小选择相应的网筛孔径,据以往研究发现大部分包囊的大小在30~65µm[36],所以一般会选择20µm 和80µm 两种孔径的网筛.孢粉学方法则需要用盐酸、氢氟酸等化学试剂对样品先进行初步的处理,由于受实验中相关化学试剂的影响,经过该方法分离得到的包囊一般不适合再次进行萌发实验[37].在早期的调查中,调查者也曾利用多钨酸钠(SPT)对沉积物中的包囊进行分离[38],但在之后的研究中发现该方法在一定程度上会影响包囊的萌发率,且对包囊的形态造成影响.综上,筛网过滤法是目前较为可靠的一种处理方法[39].
不同类型的甲藻一般形成的包囊形态有所差异,因此对于包囊分类鉴定的方法主要是利用显微镜观察来分析包囊的形状、大小、包囊壁、附属物及古口等[40-42].电子显微镜相较于光学显微镜更为精细,可以将两者相结合,确保实验结果的准确性[43].但显微镜观察也存有一定的弊端:(1)传统的显微镜观察往往依赖于研究者自身知识经验,存有一定的不准确性.(2)同种营养细胞会因环境的影响产生不同形态的包囊[44],这就为依赖包囊形态进行分类带来了困难.(3)形态相似的包囊也会形成不同类型的营养细胞[45],这就需要对其进行挑取、培养、纯化,增加了研究者的工作任务.为了弥补传统显微镜观察方法存在的不足,人们不断尝试运用分子生物学的方法对包囊进行鉴定与分析,并取得了较好的结果[46-47].Gao等[48]利用基于高通量测序的宏条形码技术发现在调查区域不同季节不同站位的包囊的丰度与分布有较大差异,并且其利用超声波清洗尽可能除去包囊中的污染物,以提高分子鉴定的成功率[49].目前,研究者往往先利用电子显微镜及光学显微镜对包囊进行初步了解,然后再运用分子生物学方式对包囊进行深入分析[50-51].三者的有效结合,有利于区域新种的发现,也极大提高了实验数据的可靠性.
3 甲藻包囊的起源与发展
3.1 甲藻包囊的起源
甲藻化石最早出现于白垩纪的火石碎片中[52],而化石包囊最早发现于志留纪时期[53],要比甲藻化石早5 个世纪.起初,孢粉学家只对包囊进行相关的研究,而并没有将其与甲藻联系在一起.直到Evitt通过“archeopyle(古口)”的观察将包囊与甲藻联系在一起[54],才真正开启了现代甲藻包囊的研究.之后,人们又在研究中发现配子的结合可以形成相应的包囊,进而将包囊与有性生殖联系在一起,完善了包囊与浮游植物的关系[55-56].
甲板术语的出现为包囊的研究提供了便利,最初,研究者在对包囊进行描述时所使用的术语较为繁杂[57],为了方便记录,Sarjeant 与Downie 于1966 年对相关术语进行了较为一致的划分,结束了之前混乱的局面[58].在之后的发展中,研究者又根据实验的需求不断进行增添与完善[59],让人们对包囊与其营养细胞有了更为准确的认识.尤其是Sarjeant 对之前未区分的类型增添了9 种新的定义后,使得包囊的相关描述更为准确[60],为之后的研究带来很大的便利.
古口,即包囊的萌发孔,主要由副甲板脱落或横沟、甲板等产生的裂缝形成[61].依赖于包囊古口的所在位置,研究者对现有包囊的古口进行类型的划分:顶生(apical)、间生(intercalary)、沟前生(precingular)、复合型(combination)、混杂型(miscellaneous)(图3[59,62]).早期对古口进行分类时,没有明确划分未覆盖副板块的裸甲藻类,为了弥补这一缺陷,Matsuoka 与Fukuyo 于2000 年又重新对古口进行较为详细的定义,形成了完善的现代甲藻包囊的萌发孔类型(图4[28]).通过对古口的研究,可以对包囊的类型进行鉴定与划分,也可以通过参与萌发孔的副甲板的数量得到系统发育的趋势,如顶孔板古口主要出现在三叠纪,从白垩纪开始,萌发孔开始由一个以上的甲板组成,之后萌发孔开始变为复合型,直到新世纪才开始出现外包型包囊[63].

图3 甲藻古口的类型Fig.3 Archeopyle types
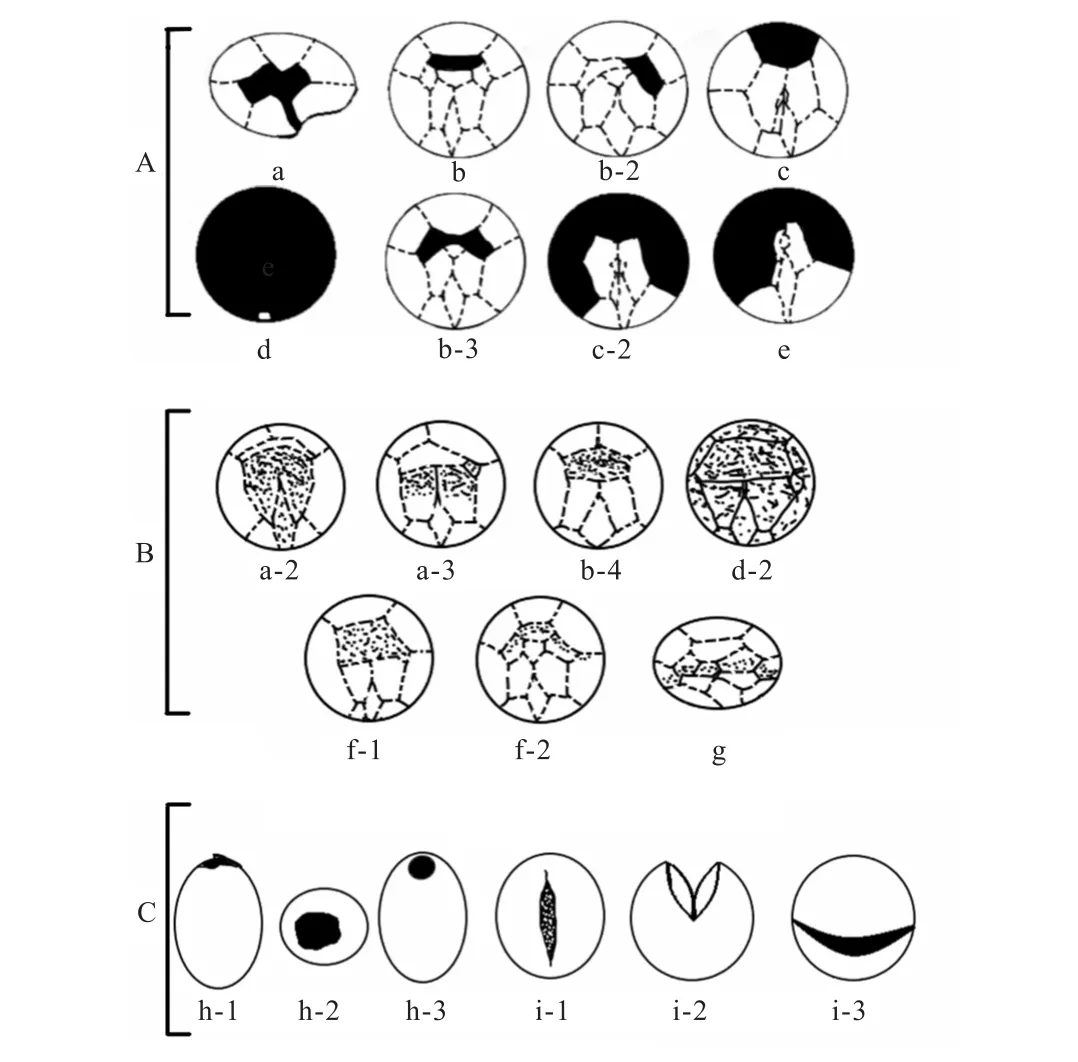
(A)显口型(saphopylic archeopyle):a.顶生型;b.间生型;c.沟前型;d.外包型;e.顶生/间生/沟前型.(B)中间型(theropylic archeopyle):f.顶生/间生型;g.结合型.(C)隐口型(cryptopylia archeopyle):h.洞状口;i.裂缝口
在初步完成对古口划分后,有研究者利用古口与相应的包囊甲板将包囊划分为7 大谱系(Lineage):角藻系(Ceratioid Lineage)、旋甲藻系(Cyclonephelium Lineage)、裸甲藻系(Dinogymnium Lineage)、膝沟藻系(Gonyaulacysta Lineage)、微角藻系(Nannoceratopsis Lineage)、多甲藻系(Peridinioid Lineage)、结节甲藻系(Tuberculodinium Lineage)[53].不同时期的环境有所差异,其主要的包囊组成也有所差别.
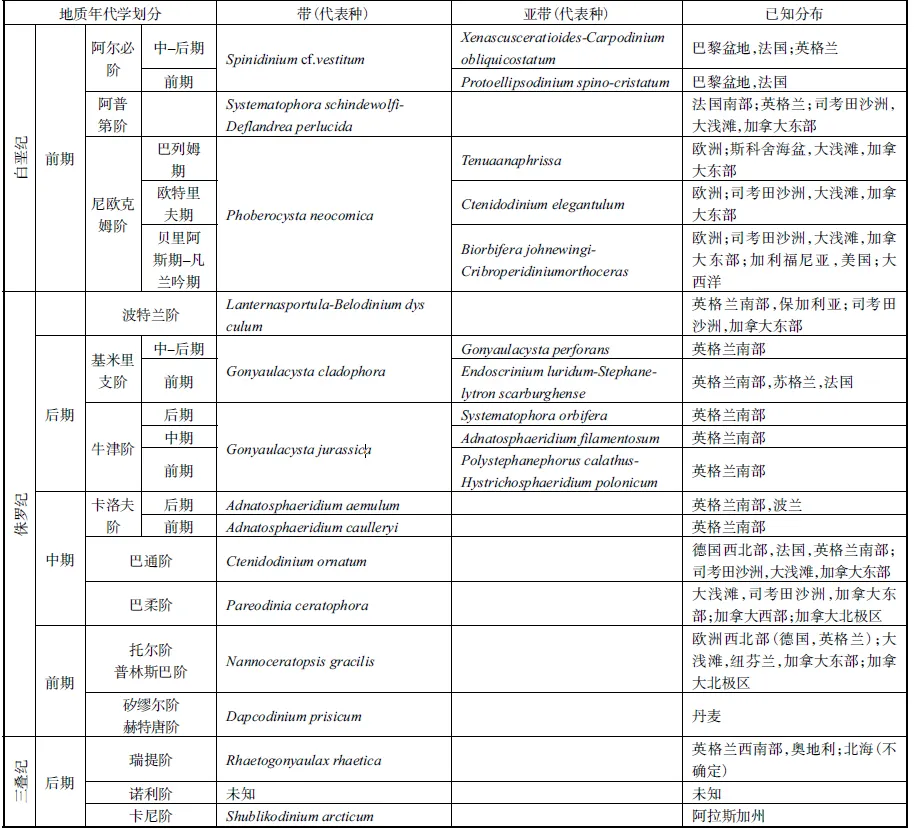
目前所知在三叠纪时期甲藻包囊仅在卡尼阶与瑞提阶有所发现,主要以原多甲藻类为主.到侏罗纪时期,包囊进化相对趋于稳定.该时期根据其存有的包囊划分为9 个带及5 个亚带,包囊的主要特点为拥有较少的副壳板及简单的沟前型古口.虽然侏罗纪时期的包囊在一定程度上不及白垩纪及新生代时期的包囊那样富集,但其较三叠纪时期包含包囊的区域已有所增加[53].
白垩纪时期的包囊根据其存有情况也分为9 个带及5 个亚带,虽与侏罗纪时期具有相同数量的带与亚带,但其包含的内容却有所差异.在白垩纪的早期,具厚壁的膝沟藻类出现,代表了对浅海环境的适应性.也许是因为白垩纪后期海洋环境及气候的变化,裸甲藻系(Dinogymnium Lineage)的出现仅限于白垩纪后期[53].
在第三纪,膝沟藻系(Gonyaulacysta Lineage)在群落的组合占据主要地位,且结节甲藻系(Tuberculodinium Lineage)在古第三纪开始出现.古第三纪中的膝沟藻系(Gonyaulacysta Lineage)主要含有心球藻属(Cordosphaeridium)、膝沟藻属(Gonyaulacysta)、口盖藻属(Operculodinium)、刺甲藻属(Spiniferites)及管球藻属(Hystrichosphaeridium)等.无论是在古第三纪还是新第三纪的化石中,都未发现角藻系的踪迹,故说明在第三纪相关物种没有形成相应的包囊.沉积物中包囊的多样性在渐新世出现了明显的下降,这对后期包囊的多样性也造成了一定的影响,所以在新第三纪中多甲藻类的多样性也出现下降趋势.在新第三纪,占据主要优势的膝沟藻系中某些物种的丰度出现较大的变化,这可能与该时期的环境有一定的相关性[53].利用这7 大谱系,研究者对中生代与新生代时期出现的包囊进行区域的划分(表1[53]),之后的研究者多利用其划分对古海洋环境进行调查[64-65].
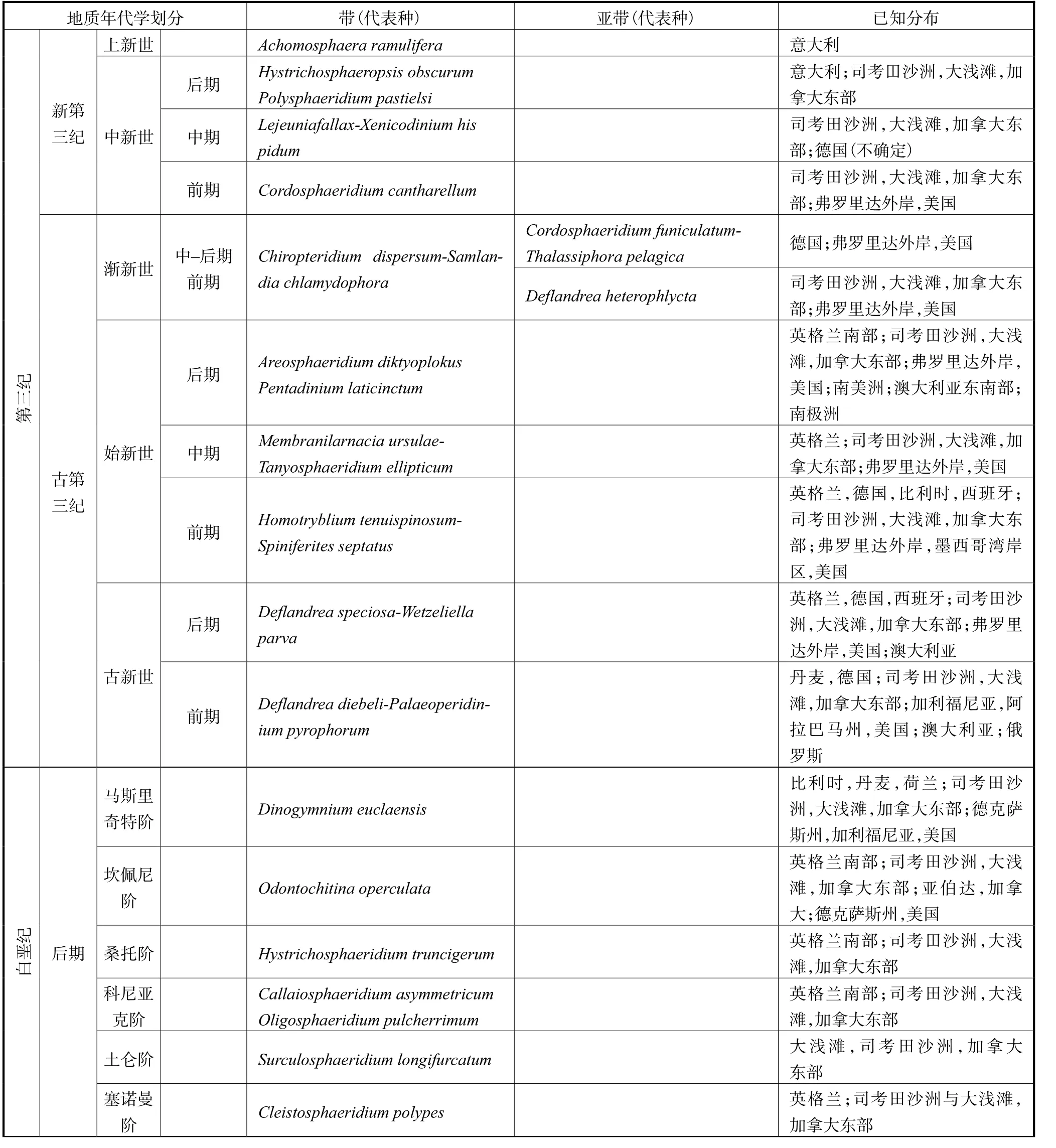
表1 中生代与新生代包囊分布带Tab.1 Dinocyst concurrent range zones in the Mesozoic and Cainozoic
续表
为了适应甲藻包囊的最新研究,Matsuoka[4]对海洋中较为重要的甲藻包囊进行孢粉学与生物学名称的结合,并将其划分为 6 大类:膝沟藻类包囊(Gonyaulacoid Group)、类结节类包囊(Tuberculodinioid Group)、钙质类包囊(Calcoidinellid Group)、裸甲藻类包囊(Gymnodinioid Group)、原多甲藻类包囊(Protoperidinioid Group)、翼甲藻类包囊(Diplopsalid Group),这也是目前应用比较广泛的分类标准.王朝晖[61]在此概念的基础上对重要甲藻包囊的孢粉学名称与生物学名称的对应关系进行完善,使之后的研究者更容易对甲藻包囊进行区分.甲藻包囊是由相应的甲藻在不良环境中所形成的,其甲藻具有自养型、异养型等类型.膝沟藻类包囊(Gonyaulacoid Group)、类结节类包囊(Tuberculodinioid Group)、钙质类包囊(Calcoidinellid Group)属于自养型的甲藻包囊,而原多甲藻类包囊(Protoperidinioid Group)、翼甲藻类包囊(Diplopsalid Group)属于异养型甲藻包囊.裸甲藻类包囊(Gymnodinioid Group)相对复杂,其中既包含自养型,也包含异养型[61].
在历史的演替中,包囊共出现3 次较为完整的“生长周期”,在包囊含量最为丰富的指数期,海洋环境可能发生了较大的改变,不再适宜营养细胞的生长,从而导致沉积物中出现大量的包囊.在不同的历史发展时期,包囊的适应能力有所差别,沉积物中占据主导地位的包囊种类与数量也有所差异,研究者可以通过对沉积物中优势包囊来调查古海洋环境的变化.通过对包囊“生长周期”及优势种的研究,可以更好地分析出古海洋环境中主要的更替事件,有利于对古海洋环境进行追溯与重建.
3.2 国内外研究现状
到目前为止,国外对甲藻包囊各方面的相关研究较为完善,对包囊的研究一般集中在野外的调查实验与室内培养实验.研究发现,包囊的萌发与形成受周围环境因素的影响,众多环境因素中以温度、营养盐、光照对包囊的影响尤为重要.包囊的萌发需要合适的温度,当温度达到适合包囊萌发的要求时,其才有可能顺利萌发成营养细胞[66].休眠包囊一般具有一定的休眠期,不同类型的休眠包囊其休眠期一般不同且较为固定,但有时温度的变化会导致休眠期的改变[67],进而影响包囊的萌发时间.温度除了能够影响包囊的生理机制外,还能够影响其最终分布[68].营养盐中N、P 两种元素被普遍认为是影响藻种生长的重要因子[69],在包囊的形成与萌发中也占有重要的地位[70].两者对于包囊的影响存在一定的差异,对于链状亚历山大藻(Alexandrium catenella)来说,N 限制更能诱导其包囊的萌发[71].海冰在哈得逊湾内可以作为调控海水黑暗时间长短的因素,研究者发现黑暗时间的长短不但对适应黑暗的异养型包囊没有产生任何影响,对当地依赖光照生长的自养型包囊也没有任何影响[72].除上述环境因素外,盐度与包囊也具有一定的相关性,Sildever 等[42]在对波罗的海中甲藻包囊物种的多样性进行调查时发现包囊的多样性与盐度呈现明显的正相关性,Zonneveld 等[73]综合世界范围内的2405 样品数据及相关文献,还发现沉积物中包囊的分布与温度、盐度、底层氧浓度等环境因素之间都呈正相关性.在进行室内实验时,人们有时难以从众多包囊中挑取出活性包囊.为了方便实验,Coyne 等[74]成功运用特定mRNA 对沉积物中的活性包囊进行鉴定,从而方便对沉积物中的死亡包囊与活性包囊进行区分.Erdner 等[75]利用实时荧光定量PCR 成功地对沉积物中的亚历山大藻的包囊进行了计数与分析,并证明该种方法适用于每立方厘米包囊数量≥10 的沉积物.多环旋沟藻(Cochlodinium polykrikoides)因在亚洲及北美地区形成有害藻华而著名[76],但因其包囊的形态还存有一定的疑问,限制了对多环旋沟藻进一步调查,选用荧光原位杂交法可以准确地检测出其所形成的包囊,极大地提高了实验效率[77].
中国对甲藻包囊的研究起步相对较晚[78],但取得的成果却不容小觑.齐雨藻等[79]、王朝晖等[80]、顾海峰等[81]多位学者先后对中国沿海表层沉积物进行相关调查,中国沿海甲藻包囊的种类与描述不断增加与更新[82-84].王朝晖等[85]对中国沿海10 个海域或港口进行采样研究,其中共发现14 属61 种,并为中国的包囊记录增添了17 个新种.顾海峰等[86]对中国沿海亚历山大藻属(Alexandrium)进行调查,为中国亚历山大藻属(Alexandrium)物种增添了 7 种新纪录.顾海峰等[45]在2011 年对中国沿海的包囊种类进行较为全面的调查,发现记录的甲藻包囊共有25 属67 种,其中原多甲藻属占据主要优势.黄琳在2012年对东、黄海沉积物中包囊的研究发现,近三十年来调查区域的富营养化现象日趋严重[87].海区的富营养化除了与沉积物中甲藻包囊的组成有关[88],也与自养型甲藻包囊的生产力具有一定的相关性[89].海底沉积物中的包囊有时会受上层水体运动的影响.例如,对黄海的样品进行调查中首次发现高生物量的刺果口盖藻(Operculodinium centrocarpum)包囊,研究推测形成这种现象的主要原因可能与该海域的冷水团及长江的径流动态相关[90].受环境条件的限制,野外调查实验具有一定的局限性,不能够很好地了解包囊整个生活史的影响因素和变化情况,为了更好地了解包囊的生活习性以及与上层环境的相互关系,研究者近几年来开始加强在室内实验,通过多种方式探索包囊及其营养细胞的特点.顾海峰等[91]通过分子手段对双锥原多甲藻(Protoperidinium biconicum)和矮胖原多甲藻(Protoperidinium humile)建立了新的包囊与外壁的关系.也有研究运用多种物理、化学方式对锥状斯氏藻包囊进行处理,发现外部环境影响包囊的萌发活性[92].顾海峰等[93]研究了东海沉积物中未钙化的包囊的萌发情况,并对其进行了相关分子实验,最终发现其为一株新种.通过室内外实验的相互结合,影响甲藻包囊萌发的各种影响因素也逐渐被了解,但由于包囊自身存有一定的复杂性,加之实验技术、条件等众多因素的影响,外界条件及包囊自身的应对机理等方面还需进一步探索.
4 甲藻包囊与上层水体的关系
休眠包囊的萌发存在两种相对应的机制.第一种机制:度过强制性休眠期的包囊在良好的外界环境下便能萌发形成营养细胞;第二种机制:季节对休眠包囊萌发的影响[94].沉积物中包囊的大量萌发极易造成水体中营养细胞的大量增加,进而引发藻华现象.藻华的发生主要包括4 个过程:存有藻华类孢子→适宜条件下进行分裂繁殖→大量增殖成藻华→一定环境下产生包囊[95],由此可知包囊与藻华频繁发生存有一定的相关性.诱发甲藻藻华发生的因素有许多,主要包括水体富营养化[96]、温度[97]、盐度等.一旦藻华爆发不但会对海洋环境、水中生物造成伤害,甚至还会威胁人类的生命健康[98].即使在未发生藻华时期,包囊与上层的浮游植物之间就存在一定的联系,Elshanawany 等[99]曾在研究甲藻包囊分布时发现在未发生赤潮时期,多边舌甲藻(Lingulodinium machaerophorum)与水体中的蓝藻呈现正相关性.在赤潮鼎盛时期,浮游植物过度消耗周围环境中的营养物质会导致沉积物中暂时性包囊和休眠包囊都具有不同程度的增加[100].甲藻包囊的存在是区域甲藻春季藻华反复爆发的一个重要因素,Nagai 等[101]曾注意到藻华消失时的温度与包囊形成存有某种联系,换言之,包囊的形成与藻华的消失具有一定的关系.
有害甲藻包囊主要是指可以形成有害藻华危害生态系统和自身能产生毒素的包囊,据统计,全球范围内大约有22 种,其中我国就存有约18 种[102].这些有害甲藻包囊的存在不但对水体中的生物造成危害,而且会通过食物链威胁人类的生命安全[12].为了加强对有害包囊的研究,Perini 等[103]发现利用实时荧光定量核酸扩增检测系统(qPCR)可以对沉积物中有害包囊进行定量分析,这为进一步准确了解有害包囊的各种特性提供了坚实基础.
甲藻藻华的爆发可以帮助甲藻包囊扩大其自身地理分布,当某海域发生藻华时,水体中的甲藻营养细胞就会随着海风的扰动、水流的走向来拓宽自身的分布范围,也就变相地拓展了甲藻包囊的分布地理位置,为下一次更大范围甲藻藻华的爆发埋下了隐患.除了在海底沉积物中存有甲藻包囊,在上层水体中也可能存在少数还未来得及沉入水底的残余包囊.由于水体中的包囊极少,所以大部分的调查者在研究包囊时仅仅对沉积物中的包囊进行定量定性,从而忽略其在水体中的存在,造成了数据的不完整性,故在分析相关数据时存有少许的误差.要想更为准确地反映调查海域甲藻包囊的组成,应该将其对应的上层水体中的少数包囊也进行定量定性分析,这样才能更全面地了解调查区域的环境变化状况.
5 展 望
虽然对于包囊及相关甲藻的研究已相对完善,但其中仍存有一些问题:(1)对包囊的准确分类与鉴定是分析各种因素的重要前提,但因多种实验条件的限制,对于沉积物中损坏、未萌发的包囊难以进行明确的划分与命名,给实验带来一定困难.(2)包囊的形成与萌发除了与周围的环境因素具有很大的相关性外,与自身内部复杂的生理机制也存有一定的联系,但人们在调查时往往忽略对包囊内部的生理机制探索.(3)全世界范围内不断发现新的甲藻包囊类型,所以到目前为止对包囊的种类还没有一个较为明确的统计.
今后研究方向:(1)包囊作为甲藻生命周期中的重要组成部分,被普遍认为是藻华发生和消失的重要指示标志.通过对包囊野外的调查研究可以一定程度上加深对藻华的了解,有利于改进藻华的减灾措施.因此,包囊不再局限于古生物的研究,而在海洋生态学、生物学方面也应引起广泛关注.为了加深对包囊的了解,研究者在积极开展野外调查实验的同时,也应不断增强实验室内的生理生态学研究,利用分子生物学对包囊进行准确的鉴定及生理生化的探究,从而更加准确地把握包囊各种生理机制,对其生存、扩散以及与周围环境相互作用有一个较为全面的掌握.(2)室内的培养实验虽然能对环境因素与包囊的相互关系进行科学的研究,并得出两者的相关性,但对于真正的野外环境来说,包囊的形成与萌发是受多种因素共同作用的,为了能够对包囊的各种机制进行全面了解,研究者应增长野外调查的时间,从而得到更为准确的现场结果.(3)由于环境、技术等方面的限制,研究者对于包囊的调查区域多集中于沿岸区域地带,对于外海的调查研究相对较少,这可能会造成部分甲藻包囊还未被发现,因此今后应不断将调查区域向外海扩展.
