沉默Wnt4基因抑制大鼠肾间质纤维化
2019-04-28杨阳白海涛李玲陈美雪
杨阳,白海涛*,李玲,陈美雪
(1. 厦门大学附属第一医院 福建医科大学教学医院儿内科,福建 厦门 361000; 2. 华中科技大学同济医学院附属武汉儿童医院儿内科, 武汉 430014; 3. 莆田市儿童医院儿内科,福建 莆田 351100)
肾间质纤维化(renal interstitial fibrosis,RIF)是慢性肾病的病理生理基础。RIF是由于各种原因使间质炎症细胞浸润、细胞外基质(extracellular matrixc, ECM)不断积聚从而导致肾功能减退的动态过程。而肾小管上皮-间充质细胞转化(epithelial-mesenchymal transition,EMT)作为肾小管间质纤维化的主要细胞学行为,近年来已被广为接受和研究,但其确切分子机制尚未完全阐明。Wnt/β-catenin信号通路被越来越多证实与纤维化疾病的发生密切相关,包括特发性肺纤维化、肝纤维化等。Wnt基因家族目前已有19种基因,16种在成年小鼠肾有不同程度表达。其中Wnt4基因在肾的发育中发挥着至关重要的作用,在胚胎肾中,Wnt4主要诱导肾小管间质细胞向上皮细胞转化,诱导肾小管的形成。Wnt4基因沉默是否通过参与EMT过程,延缓肾间质纤维化,目前相关体内动物实验尚未见报道。本研究通过构建Wnt4-siRNA载体分别转染UUO大鼠体内,拟在探讨Wnt4基因沉默后对β-catenin表达的影响,以及与肾间质纤维化的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性SD大鼠128只,7周龄,体重约180 ~ 220 g,由厦门大学实验动物中心提供【SCXK(京)2012-0001】,实验在厦门大学实验动物中心进行【SYXK(闽)2013-0006】。SD大鼠常规饲养,自由摄食、饮水,光照黑暗交替12/12 h,建模前12 h禁食。所有操作均符合实验动物伦理学要求。
1.1.2 试剂与仪器
慢病毒载体系统(载体编号:GV115)、293T细胞、大肠埃希菌菌株DH5α、PCR 用试剂primer(R&F)购自上海吉凯基因化学技术有限公司。兔抗大鼠α-SMA单克隆抗体购自英国Abcam,兔抗大鼠GAPDH多克隆抗体购自杭州贤至生物科技公司。山羊抗兔二抗购自美国Earthox。兔抗大鼠Wnt4多克隆抗体、兔抗大鼠β-catenin单克隆抗体、兔抗大鼠 vimentin单克隆抗体购自Cell Signaling Technology公司。兔IgG两步法免疫组化试剂盒即用型购自武汉博士德。Taq polymerase、TRIzol试剂、cDNA合成试剂盒和RT-PCR试剂盒购自日本TaKaRa。引物由上海英俊生物技术有限公司设计及合成。DMEO购自Gibco公司,胰酶购自上海化学试剂公司,Lipofectamine 2000购自Invitrogen公司。oligo dT购自上海生工,PVDF膜购自美国PALL,BCA蛋白质定量试剂盒购自北京天根生化,DAB显色盒购自福州迈新生物技术公司,X光胶片购自美国Kodak,ECL化学发光试剂盒购自美国Pierce公司。
1.2 方法
1.2.1Wnt4 siRNA慢病毒载体的构建
选取NRK-52E大鼠肾细胞培养,收集生长状态良好的细胞,采用RT-PCR检测目的基因的表达,筛选出表达丰度较高的细胞类别,用做后期的慢病毒的内筛内验。根据目的基因序列及siRNA设计原则,分别设计四个Wnt4基因的干扰靶点。构建病毒载体框架。(见表1)。
通过T4DNA连接酶将双酶切(酶切位点为AgeI,EcoRI)线性化的载体和DNA片段在适当的buffer 中进行连接反应,制备双链DNA oligo,连接与转化慢病毒载体(pGCSIL-GFP载体)与Wnt4 shRNA序列。挑取转化子重悬于10 μL LB溶液,混匀取1 μL作为模板;使用相应引物:Wnt4上游上游引物CCATGATTCCTTCATATTTGC;下游引物GTAATACGGTTATCCACGCG。进行菌落PCR鉴定实验。PCR阳性重组子鉴定后,送公司测序。包装Wnt4 siRNA慢病毒,转染293T细胞。

表1 Wnt4基因shRNA序列Table 1 Wnt4 shRNA sequences
1.2.2 动物模型制作
180 ~ 220 g的雄性SD大鼠称重后以1%的戊巴比妥钠注射麻醉后,固定于动物台,备皮后医用酒精及安尔碘常规消毒,行左侧耻骨上切口(约2 ~ 3 cm),逐层打开腹腔,推开肠管避开肝,沿左肾下极寻找左输尿管,游离,用5-0号丝线上下结扎两处,然后从中剪断输尿管以防逆行性感染,分层缝合切口并安尔碘消毒;假手术组仅游离左侧输尿管,并不结扎,其余步骤同单侧输尿管结扎(unilateral ureteral obstruction, UUO) 模型组。
1.2.3 动物分组及体内转染
实验设128只SPF级雄性SD大鼠随机分为4组:根据手术及给药处理方式的不同,依次为①假手术组(单侧输尿管分离不接扎组,n=32);②模型组(UUO组,单侧输尿管结扎组,n=32);③阴性组(单侧输尿管结扎+阴性慢病毒液沉默组,n=32);④沉默组(单侧输尿管结扎+Wnt4慢病毒液沉默组,n=32)。于术后第3、7、10、14天每组各处死8只动物,留取肾标本。其中阴性组在UUO模型组的基础上用微量进样器于肾被膜(单侧肾转染)下注射阴性对照的重组慢病毒液10 μL(含病毒颗粒1×107ifu),沉默组在UUO组的基础上采用微量进样器于肾被膜下注射特异的Wnt4 siRNA慢病毒液10 μL。四组大鼠自由取食并饮水。分别于术后3、7、10、14 d牺牲各组8只大鼠,取肾组织。
1.2.4 冰冻切片制作、标本采集
注射慢病毒液的梗阻侧肾组织必须保持新鲜,勿固定,立即制作冰冻切片。Wnt4 siRNA慢病毒浓缩液肾内转染3 d后牺牲大鼠,立即取梗阻侧肾,勿固定,用干净冻存管装好。将组织块置于金属组织托上面,组织块在-15℃ ~ -20℃环境中冰硬,切片厚度为4 ~ 5 μm。切片置于荧光显微镜下观察绿色荧光在肾的分布,了解不同剂量组的感染效率。
各组大鼠分别于造模后3、7、10、14 d牺牲大鼠,并取左侧肾,冠状面切开组织,取一部分肾组织(小米粒大小,约1 mm3)置于2.5%戊二醛中固定,待做电镜。一部分置于4% 中性甲醛中固定,石蜡包埋,待做H&E染色、Masson染色及免疫组化。一部分剥离表面脂肪后分离肾皮质和髓质,包入无菌锡纸中置液氮罐内,再转移至-80℃冰箱,待做RT-PCR。
1.2.5 H&E染色病理检测β-catenin、Wnt4、E-cadherin和α-SMA的表达
按常规方法进行H&E染色,光镜下观察四组大鼠肾组织结构病理及肾间质纤维化的改变。按说明书采用兔IgG两步法免疫组化法染色,结果以出现棕黄色颗粒为阳性表达。
1.2.6 RT-PCR检测β-catenin、Wnt4、E-cadherin和α-SMAmRNA的表达
取各组转染后3、7、10、14 d 大鼠肾皮质100 mg,采用Trizol试剂提取大鼠肾皮质RNA并逆转录成cDNA。经37℃,15 min,85℃ 5 s,逆转录合成cDNA,以此为模板用相应引物经PCR 方法进行扩增。设计α-SMA、β-catenin、Wnt4引物,以GAPDH作为内参,以目的基因拷贝数/GAPDH 拷贝数作为目的基因的相对表达量。扩增条件为:95℃ 预变性30 s;95℃ 变性15 s,58℃退火20 s、72℃ 20 s,共45 个循环。融解曲线条件:95℃ 5 s,65℃ 1 min。
1.3 统计学分析

2 结果
2.1 大鼠肾间质病理H&E染色结果
H&E染色结果表明:假手术组四个时间点未见肾间质改变;UUO组、阴性沉默组及沉默组造模后3 d出现肾间质水肿、少量肾间质纤维化,10、14 d肾间质弥漫性巨噬细胞、淋巴细胞浸润,呈加重趋势;阴性沉默组基因与UUO组相同;沉默组四个时间点均出现不同程度肾间质纤维化,14 d肾间质纤维化程度低于阴性沉默组及UUO组(P< 0.05)(图1)。
2.2 Wnt4基因沉默后Wnt4 mRNA相对表达量
假手术组Wnt4 mRNA表达量在四个时间点无明显变化;UUO组及阴性组Wnt4 mRNA表达量随着阻断时间延长增加,与同一时间点的假手术组相比明显增多(P< 0.05),第10、14天明显低于同一时间点的UUO组及阴性沉默组(P< 0.05)(图2)。
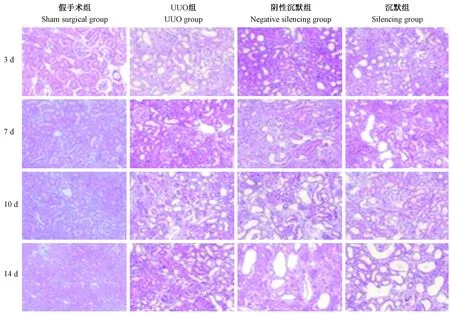
图1 Wnt4基因沉默后不同时间各组大鼠肾间质H&E染色结果(×200)Figure 1 Pathological changes of renal interstitium of the rats in different groups at different time points after Wnt4 silencing(HE staining,×200)

注:b1表示UUO组、阴性沉默组与假手术组比较,P< 0.05;b2、b3表示沉默组与UUO组、阴性沉默组比较,P< 0.05。(下图同)图2 Wnt4基因沉默后肾组织中Wnt4 mRNA相对表达量Note. b1: The UUO and the negative silencing groups were compared with the sham operation group, respectively, P< 0.05. b2 and b3: The silencing group compared with the UUO and negative silencing groups, P < 0.05.(The same in the following figures)Figure 2 Relative expression of Wnt4 mRNA in the renal tissues after Wnt4 silencing
2.3 Wnt4基因沉默后β-catenin mRNA相对表达量
假手术组β-cateninmRNA的表达量在四个时间点无明显变化;UUO组、阴性组及沉默组β-cateninmRNA的表达量随着梗阻时间延长增加,明显高于同一时间点的正常组(P< 0.05),且三组间表达量无统计学差异。(见图3)
2.4 Wnt4基因沉默后α-SMA mRNA相对表达量
假手术组α-SMAmRNA表达量在四个时间点无明显差别;UUO组及阴性组α-SMAmRNA表达量随着梗阻时间延长增加,明显高于同一时间点的假手术组(P< 0.05)。沉默组的α-SMAmRNA表达量随着梗阻时间延长减少,第10、14天时与同一时间点的UUO组及阴性沉默组相比明显减少(P< 0.05),但仍明显高于同一时间点的假手术组(图4)。
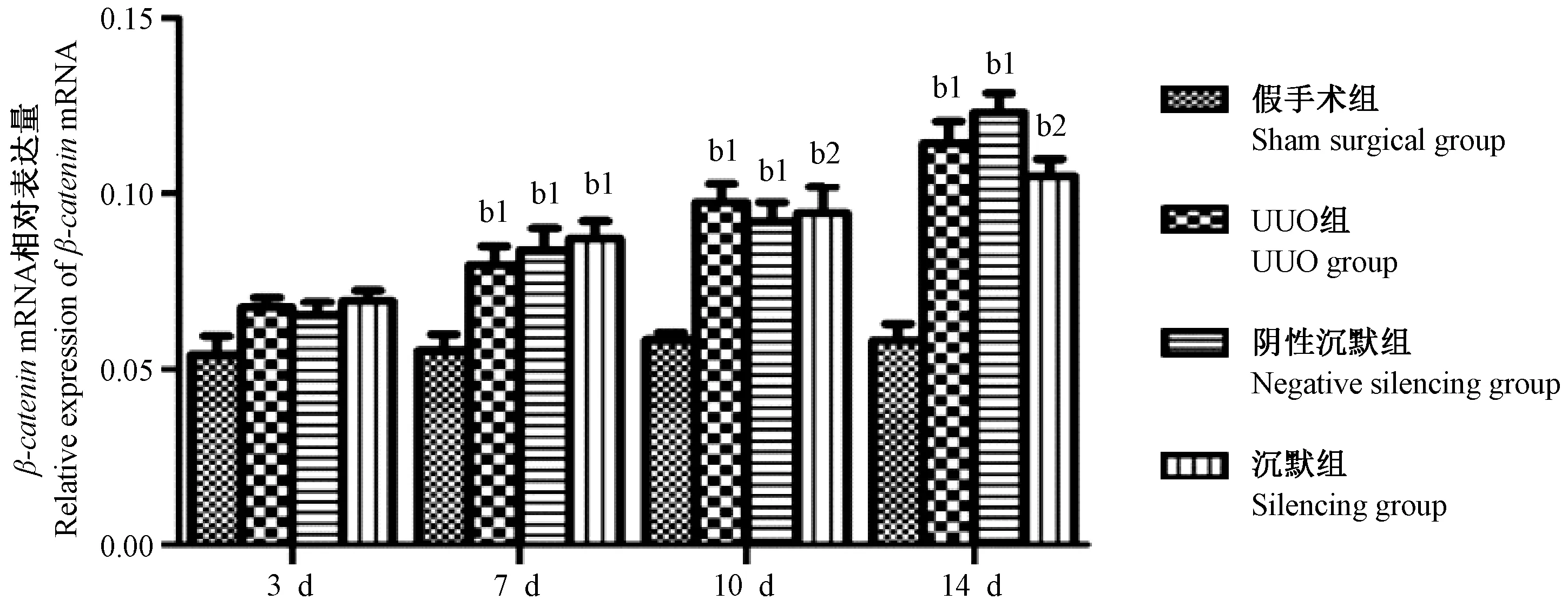
图3 Wnt4基因沉默后β-catenin mRNA相对表达量Figure 3 Relative expression of β-catenin mRNA in the renal tissues after Wnt4 gene silencing
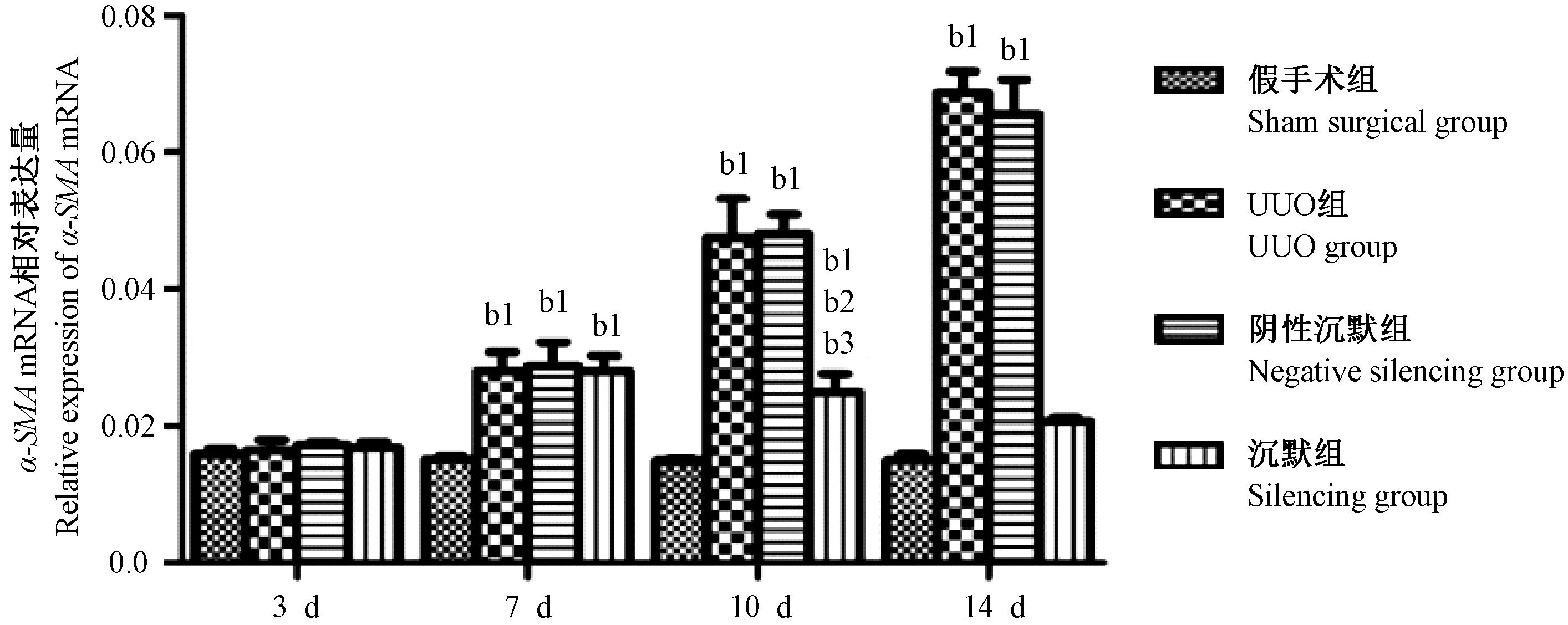
图4 Wnt4基因沉默后α-SMA mRNA相对表达量Figure 4 Relative expression of α-SMA mRNA in the renal tissues after Wnt4 silencing
2.5 Wnt4基因沉默后波形蛋白(vimentin)mRNA相对表达量
假手术组的vimentinmRNA表达量在四个时间点无明显差异;UUO组及阴性沉默组vimentinmRNA表达量随着梗阻时间延长增加,明显高于同一时间点的假手术组(P< 0.05)。沉默组vimentinmRNA表达量随着梗阻时间延长增加,第14天时表达量减少,明显低于同一时间点的UUO组及阴性沉默组(P< 0.05),但较同一时间点的假手术组表达量仍高(P< 0.05)(见图5)。
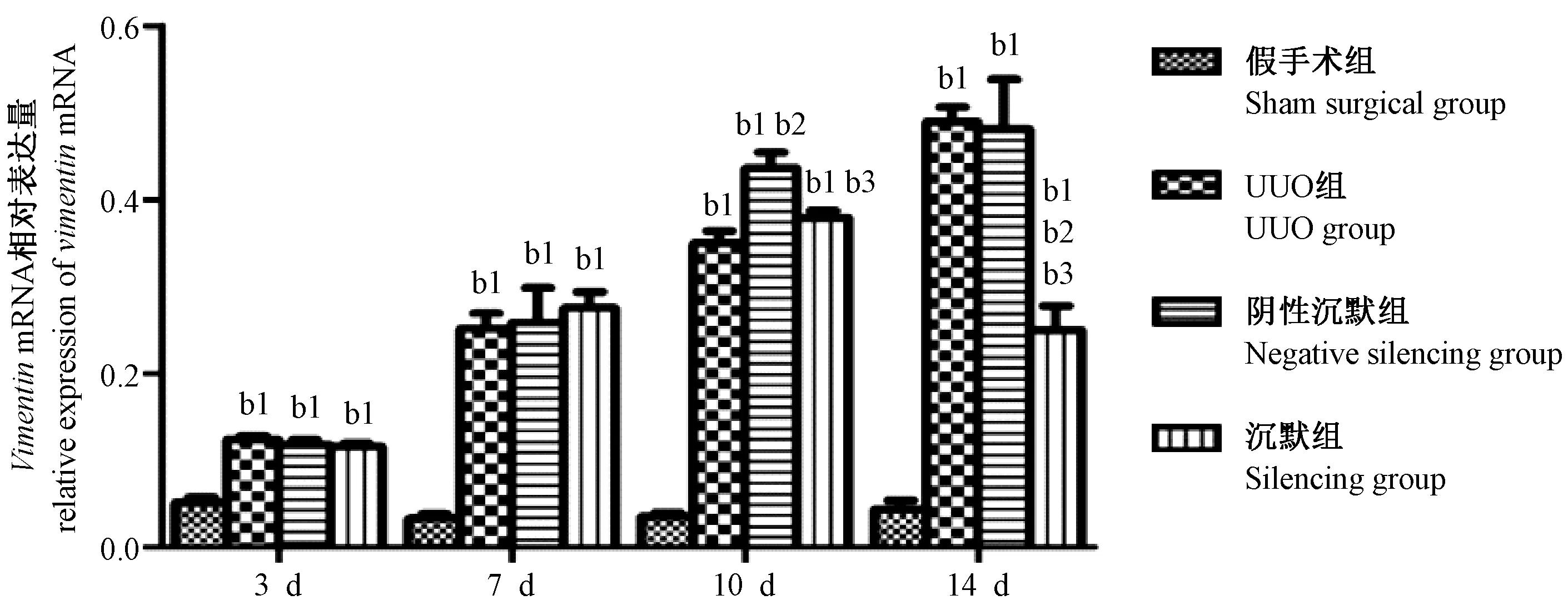
图5 Wnt4基因沉默后波形蛋白(vimentin)mRNA相对表达量Figure 5 Relative expression of vimentin mRNA after Wnt4 silencing

注:A、B,UUO组; C、D,沉默组。图6 Wnt4基因沉默后Wnt4与β-catenin、α-SMA相关性分析Note.A、B,UUO group. C、D,Silencing group.Figure 6 Correlation between the expressions of Wnt4 and β-catenin and α-SMA after Wnt4 gene silencing
2.6 Wnt4基因沉默后Wnt4与β-catenin、α-SMA相关性分析
Wnt4基因沉默后UUO组 mRNA表达量的相关性分析显示,Wnt4与β-cateninmRNA表达量具有显著相关性(r=0.886,P< 0.001)(图6A)。Wnt4与α-SMAmRNA表达量具有显著相关性(r=0.930,P< 0.001)(图6B)。Wnt4基因沉默后沉默组mRNA表达量的相关性分析显示,Wnt4与β-cateninmRNA表达量无显著相关性(r=0.204,P=0.263)(图6C)。Wnt4与α-SMAmRNA表达量具有显著相关性(r=0.753,P< 0.001)(见图6D)。
3 讨论
肾间质纤维化是临床慢性肾病治疗和肾移植管理的关键,但至今RIF的发病机制还不甚明了,对抗肾间质纤维化的治疗,尚无有效的方案。本研究前期实验证明Wnt/β-catenin信号通路在肾间质纤维化中起到重要作用,信号通路阻断可减少肾间质纤维化发生。Wnt信号传导通路分为经典Wnt/β-catenin 信号通路及非经典信号转导通路,后者包括Wnt/Ca2+通路和细胞极性通路[1],当肾损伤时,Wnt4基因大量表达,与跨膜结合并形成复合物,抑制细胞内GSK-3β表水平达,阻止β-连环蛋白磷酸化及降解,导致细胞内β-连环蛋白大量聚集,进入细胞核中与转录因子LEF/TCF 结合,激活下游与EMT密切相关的靶基因,包括Snail,TwistT和锌指蛋白(zinc finger E-box binding protein, ZEB),三者均可在抑制上皮细胞钙粘蛋白的同时激活间充质基因,包括N-钙粘蛋白、波形蛋白和粘连蛋白[2-3]。在肾发育的不同阶段,多种Wnt蛋白在肾不同部位均有不同程度的表达。国内外大量的基因敲除模型及体外研究证实,WNT蛋白介导的信号通路在肾的发育过程中必不可少,在肾发育的早期,Wnt4主要表达腹侧间充质帽(CM)中,介导间充质-上皮转分化,是唯一在肾前体细胞表达并表现出在肾发育过程中有重要作用的Wnt基因[4]。关于Wnt4诱导MET发生的机制,2011年,Tanigawa等[5]用重组WNT蛋白作为大鼠后肾间充质的祖细胞,研究发现WNT4 蛋白能够诱导肾小管的形成。2013年,李里等[6]应用脂质体介导将重组质粒pEGFP-PAX2转染入体外培养的大鼠肾小管上皮细胞,发现PAX2转染至肾小管上皮细胞后激活了Wnt4 通路,PAX2在体外诱导正常肾小管上皮细胞间充质转分化可能是通过 Wnt/β-catenin通路完成。综上所述,Wnt4基因和β-catenin基因及其编码的蛋白在Wnt/β-catenin信号通路对EMT的调控中发挥重要作用。
本研究成功制作UUO大鼠RIF 模型,并通过慢病毒转染成功将Wnt4-siRNA片段导入UUO 大鼠体内,同时应用Real-Time PCR 进行检测,结果显示各时间点Wnt4 基因沉默组与阴性对照组比较,Wnt4 mRNA 和蛋白表达量明显降低,提示Wnt4基因被沉默。在UUO模型中,Wnt4基因随着梗阻时间延长表达量增加明显,与转分化指标α-SMA的表达量呈显著正相关(r=0.930,P< 0.01),纤维化指标波形蛋白梗阻后表达量增加,且肾病理提示肾间质胶原纤维堆积,纤维化形成,证实Wnt4基因被大量激活后,参与肾小管上皮间质转分化过程,促进肾间质纤维化形成。β-连环蛋白在梗阻后第7天表达量明显增多,明显高于同期的假手术组,且Wnt4与β-catenin的mRNA相对表达量呈显著正相关(r=0.886,P< 0.001),说明Wnt4沉默后,主要通过Wnt4/β-catenin信号通路传导信号,诱导肾小管上皮间质转分化的发生。沉默组的β-cateninmRNA的表达量随着梗阻时间的延长表达量增加,与同一时间点的UUO组及阴性组无统计学差异。且相关性分析结果显示Wnt4与β-catenin无显著相关性(r=0.204,P=0.263),提示Wnt4基因沉默后,可能会代偿性地激活其他信号通路,导致β-catenin的表达量上调。在转染10 d 时,靶基因沉默组α-SMAmRNA 表达量明显低于阴性对照组。说明Wnt4基因沉默在纤维化进程中对EMT 有影响,在纤维化进程中可明显抑制肾小管EMT的过程,延缓RIF的进程。本研究显示在UUO模型中β-连环蛋白在梗阻后第7天表达量明显增多,明显高于同期的正常组,且Wnt4与β-catenin的mRNA相对表达量呈显著正相关(r=0.886,P< 0.001),说明Wnt4基因激活后,主要通过Wnt4/β-catenin信号通路传导信号,诱导肾小管上皮间质转分化的发生。
Wnt信号转导的研究还处于探索阶段,有许多问题尚不清楚。本研究通过沉默Wnt/β-catenin信号通路中的Wnt4基因,观察了肾间质纤维化的改变,发现沉默Wnt4 基因后肾间质纤维化减少。肾间质纤维化是由多因素导致、多基因参与、多步骤形成的复杂病理生理过程。选择合适的药物和有效的治疗手段对于慢性肾病患者至关重要。综上所述,本研究为慢性肾病的药物研发及治疗靶点提供了一定的理论依据。
