鳖甲煎丸对AngⅡ-ROS诱导下HSC-LX2细胞中PKC-Pyk2/SRC通路的影响
2019-04-28
浙江中医药大学 杭州 310053
肝纤维化以肝星状细胞(hepatic stellate cells,HSC)的活化、增殖为主要特征,是慢性肝炎向肝硬化发展的重要病理过程。HSC的活化受氧化应激(oxidative stress,OS)、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)等诸多因素的影响,是肝纤维化发生的中心环节[1]。研究表明,生物体内活性氧簇(reactive oxygen species,ROS)引起的OS在肝纤维化形成中扮演了重要角色[2],而蛋白激酶 C(protein kinase C,PKC)在细胞的 OS反应过程中起重要作用[3-5],富含脯氨酸的酪氨酸激酶2(proline-rich tyrosine kinase 2,Pyk2)则参与了 AngⅡ诱导的血管平滑肌细胞蛋白合成,与心脏间质纤维化密切相关[6-7],SRC也被认为是AngⅡ调节细胞内信号的关键成员。在血管平滑肌细胞中SRC以ROS依赖的方式被G蛋白激活,并调节诸如Pyk2、两面神激酶(Janus kinases,JAK)/信号传导与转录激活子(signal transduction and activator of transcription,STAT)等下游信号。这些迹象提示,PKC、Pyk2、SRC很可能也参与了肝纤维化的发生发展。
本课题组前期研究发现,《金匮要略》所载鳖甲煎丸及其改良剂型鳖甲煎口服液能够通过防止肝细胞变性、坏死;清除肝纤维化诱因;抑制HSC增殖;降低纤维化大鼠血浆中的肾素、AngⅡ、醛固酮活性;减少AngⅡ诱导HSC氧化应激时产生的羟自由基及单线态氧自由基等机制,从而抑制肝纤维化的发生与发展[8-11]。
据此,笔者进一步提出假设,在肝纤维化形成早期阶段,AngⅡ诱导ROS作为初始的刺激因素,通过激活有PKC、Pyk2、SRC等诸多因子参与的信号网络,最终导致HSC增殖,以致形成肝纤维化。鳖甲煎丸能有效抑制肝纤维化的发生、发展,可能与其对该网络中的关键节点的干预有关。本研究采用MTT、荧光探针DCFH-DA、Western blot及血清药理学等研究方法,观察鳖甲煎丸含药血清对AngⅡ诱导的ROS作用下HSC-LX2细胞的增殖情况以及对PKC、Pyk2、SRC蛋白表达情况的影响,以初步探讨其干预机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物和细胞 清洁级雄性SD大鼠50只,体质量180~200g,购买于上海西普尔必凯实验动物有限公司[实验动物生产许可证号:SCXK(沪)2013-2016],饲养于浙江中医药大学动物实验研究中心[实验动物使用许可证号:SYXK(浙)2013-0184]。5只/笼,25℃恒温,光照12h/d,普通饲料喂养。人源肝星状细胞HSC-LX2购于北京北纳创联生物技术研究院。
1.1.2 主要实验试剂和药品 活性氧检测试剂盒、BCA蛋白浓度测定试剂盒均购自Solarbio公司(批号:CA1410、PC0020);二甲基亚砜(dimethyl sulfoxide,DMSO)购自 Vetec 公司(批号:V900090);SDSPAGE凝胶配制试剂盒、二抗羊抗兔、内参β-actin均购自华安生物公司(批号:WK001、HA1001、CT36001);Anti-Pyk2抗体、Anti-SRC 抗体、Anti-PKC alpha+beta 2+gamma抗体均购自Abcam公司(批号:[E354]ab32448、[EPR5496]ab109381、[EPR18104]ab184746);二硫苏糖醇(DL-dithiothreitol,DTT)购自弗德生物公司(批号:FD0011);RPMI1640培养基购自 HyClone公司(批号:SH30809.01);Beyo ECL plus购自碧云天公司(批号:P0018);胎牛血清购自Diagnovum公司(批号:D154-500mL)。
鳖甲煎丸购自国药集团中联药业有限公司(批号:Z42020772);依那普利购自扬子江药业集团江苏制药股份有限公司(批号:H32026567)。
1.1.3 主要仪器设备 MK-10干式恒温器购于杭州奥盛仪器有限公司;L500台式低速自动平衡离心机购于长沙湘仪离心机仪器有限公司;MCO-15AC型二氧化碳培养箱为日本SANYO公司产品;AE200倒置生物显微镜购于Motic公司;imark全自动酶标仪为Bio-Rad公司产品;CLiNX扫膜仪购于Science Instruments公司。
1.2 实验方法
1.2.1 含药血清的制备 大鼠以随机数字表法分成5组:鳖甲煎丸高、中、低剂量组,依那普利组及空白组。根据预实验结果,鳖甲煎丸高、中、低剂量组分别选用60kg成人每日总服用量的20、10、5倍。鳖甲煎丸以0.9%氯化钠溶液溶解,高、中、低剂量组分别予12g/kg·d、6g/kg·d、3g/kg·d 灌胃给药,灌胃体积 10mL/kg;依那普利组以10mg/kg·d剂量的依那普利溶液灌胃[11],空白组以等量0.9%氯化钠溶液灌胃。各组均灌胃2次/d,连续给药7d。末次给药1h后,各组大鼠均在无菌条件下经腹腔静脉取血,4℃、3 000r/min离心20min分离血清,56℃灭活 30min,0.22μm 微孔滤膜过滤,-20℃冻存备用。
1.2.2 MTT法测定鳖甲煎丸含药血清对细胞增殖的影响 按前期研究方法[9]培养细胞,取对数生长期的HSC-LX2 细胞制成单细胞悬液,以 1×103~1×104个/孔的密度接种于96孔板,每孔终体积为100μL。将细胞分为AngⅡ组、依那普利组、鳖甲煎丸高、中、低剂量组、空白血清组。各组以含10%胎牛血清的RPMI 1640培养基37℃培养24h,使细胞贴壁,向每孔加入新鲜制备的、经滤膜滤过除菌的10-5mol·L-1AngⅡ处理1h,鳖甲煎丸高、中、低剂量组、依那普利组均分别设有4个浓度梯度,分别按5%、10%、15%、20%的终浓度加入相应的含药血清,空白血清组加入空白组大鼠血清,AngⅡ组加入胎牛血清。各组细胞继续置于37℃、5%CO2培养箱孵育 24、48、72h 后,每孔加入5mg·mL-1MTT 20μL,37℃培养 4h后,彻底吸弃上清液,向每孔中加入150μL DMSO,置于摇床上振荡10min,充分溶解蓝紫色的甲臜沉淀,570nm波长检测各孔吸光度值OD,代表细胞的增殖情况。
1.2.3 荧光探针DCFH-DA检测细胞内ROS含量变化 收集对数生长期的HSC-LX2细胞,制成单细胞悬液,以5×105个/mL的密度接种于24孔板,每孔500μL。培养24h后,将其分为空白对照组(培养液)、AngⅡ组、依那普利组、鳖甲煎丸高、中、低剂量组和空白血清组。除空白对照组外,其余各组均以10-5mol/L AngⅡ处理1h,分别给予胎牛血清、依那普利含药血清、10%鳖甲煎丸高、中、低剂量含药血清及空白组大鼠血清。作用24h后,以PBS冲洗3次,去除细胞培养基,加入适当体积的DCFH-DA,DCFH-DA按照1:1000比例以无血清培养基稀释,终浓度为10μmol·L-1,37℃孵育20min。再以无血清培养基洗涤3次,充分去除未进入细胞内的DCFH-DA。荧光共聚焦显微镜观察HSC-LX2细胞内的ROS,颜色越深,表明ROS生成量越多。
1.2.4 Western blot法检测PKC-Pyk2/SRC通路中相关蛋白的表达 将细胞分为AngⅡ组、依那普利组、鳖甲煎丸高、中、低剂量组和空白血清组。先用10-5mol·L-1AngⅡ处理24h,然后分别予以各血清作用24h。参照前期研究[9]方法提取各组细胞总蛋白,BCA蛋白定量,制胶。根据蛋白定量结果,上样、电泳、转膜。稀释一抗(PKC 1:1 000、Pyk2 1:500、SRC 1:10 000、β-actin 1:5 000),二抗(羊抗兔 lgG,稀释比例1:2 000),室温下摇床孵育2h。脱色、覆膜后利用凝胶成像系统扫描蛋白条带,以目的蛋白与β-actin蛋白条带灰度比值表示蛋白表达水平。
1.3 统计学分析 应用 GraphPad Prism 5.0统计软件进行统计学分析,计量资料以±s表示,两组间比较用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组HSC-LX2细胞增殖活性比较 实验结果显示,各组中AngⅡ组与空白血清组细胞增殖活性无统计学差异(P>0.05)。与AngⅡ组比较,处理24h后,5%鳖甲煎丸高、中剂量组显著抑制HSC-LX2细胞增殖(P<0.05,P<0.01),10%、15%、20%鳖甲煎丸各剂量组细胞增殖活性差异无统计学意义(P>0.05)。见图1。处理48h后,与AngⅡ组比较,5%鳖甲煎丸高、中、低剂量组均显著抑制细胞增殖活性(P<0.05,P<0.05,P<0.01);15%鳖甲煎丸高剂量组可显著抑制HSCLX2细胞增殖活性(P<0.05);10%、20%鳖甲煎丸各剂量组细胞增殖活性差异无统计学意义(P>0.05)。见图2。培养72h后,与AngⅡ组比较,5%鳖甲煎丸中剂量组显著抑制细胞增殖活性(P<0.01),10%、15%、20%鳖甲煎丸各剂量组细胞增殖活性差异无统计学意义(P>0.05)。见图 3。
2.2 各组HSC-LX2细胞ROS含量比较 采用荧光共聚焦显微镜直接观察HSC-LX2细胞内ROS含量的变化,ROS的表达在HSC-LX2细胞的细胞质中表现为绿色的荧光颗粒,绿色越深,分布越密集,表明ROS含量越高。空白对照组绿色荧光颗粒颜色较浅,分布散在、稀疏;与空白对照组比较,AngⅡ组绿色荧光颗粒颜色加深,分布较密集;依那普利组绿色荧光颗粒明显少于AngⅡ组,且分布稀疏;鳖甲煎丸高剂量组绿色荧光颗粒密集程度与空白对照组和依那普利组相似,但颜色略淡;鳖甲煎丸中剂量组绿色荧光颗粒略多,且颜色加深;低剂量组,绿色荧光颗粒较明显,密集程度与AngⅡ组相似;空白血清组绿色荧光颗粒颜色不深,分布较为稀疏。见图4。说明与空白对照组比较,AngⅡ组ROS含量明显提高;与AngⅡ组比较,依那普利组、鳖甲煎丸高、中剂量组ROS含量降低,低剂量组的变化不大。
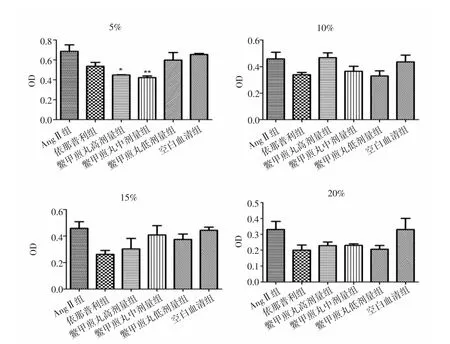
图1 作用24h后各组HSC-LX2细胞增殖活性比较Fig.1 Comparison of proliferation activity of HSC-LX2 cell in each group after treatment of 24h
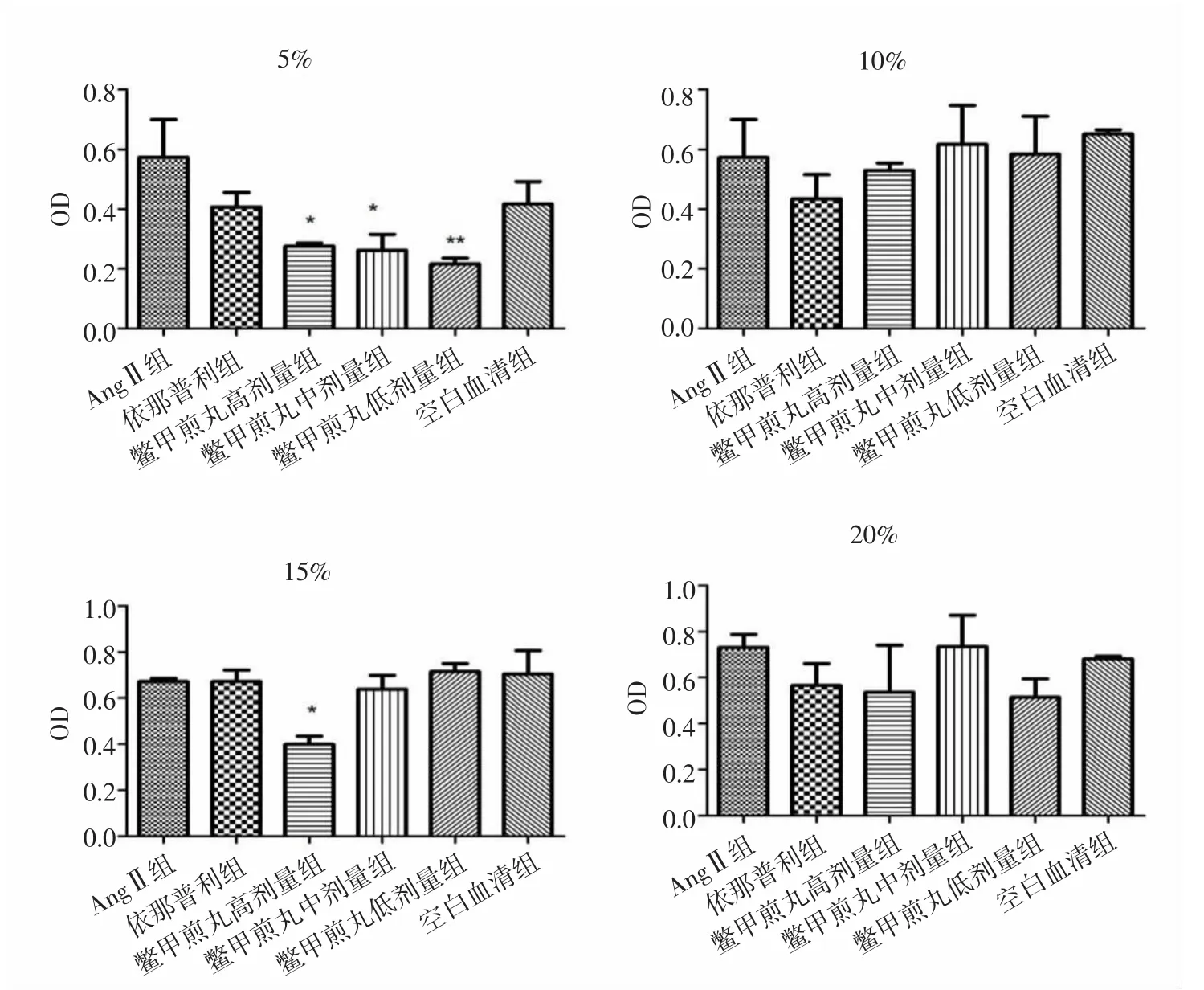
图2 作用48h各组HSC-LX2细胞增殖活性比较Fig.2 Comparison of proliferation activity of HSC-LX2 cell in each group after treatment of 48h
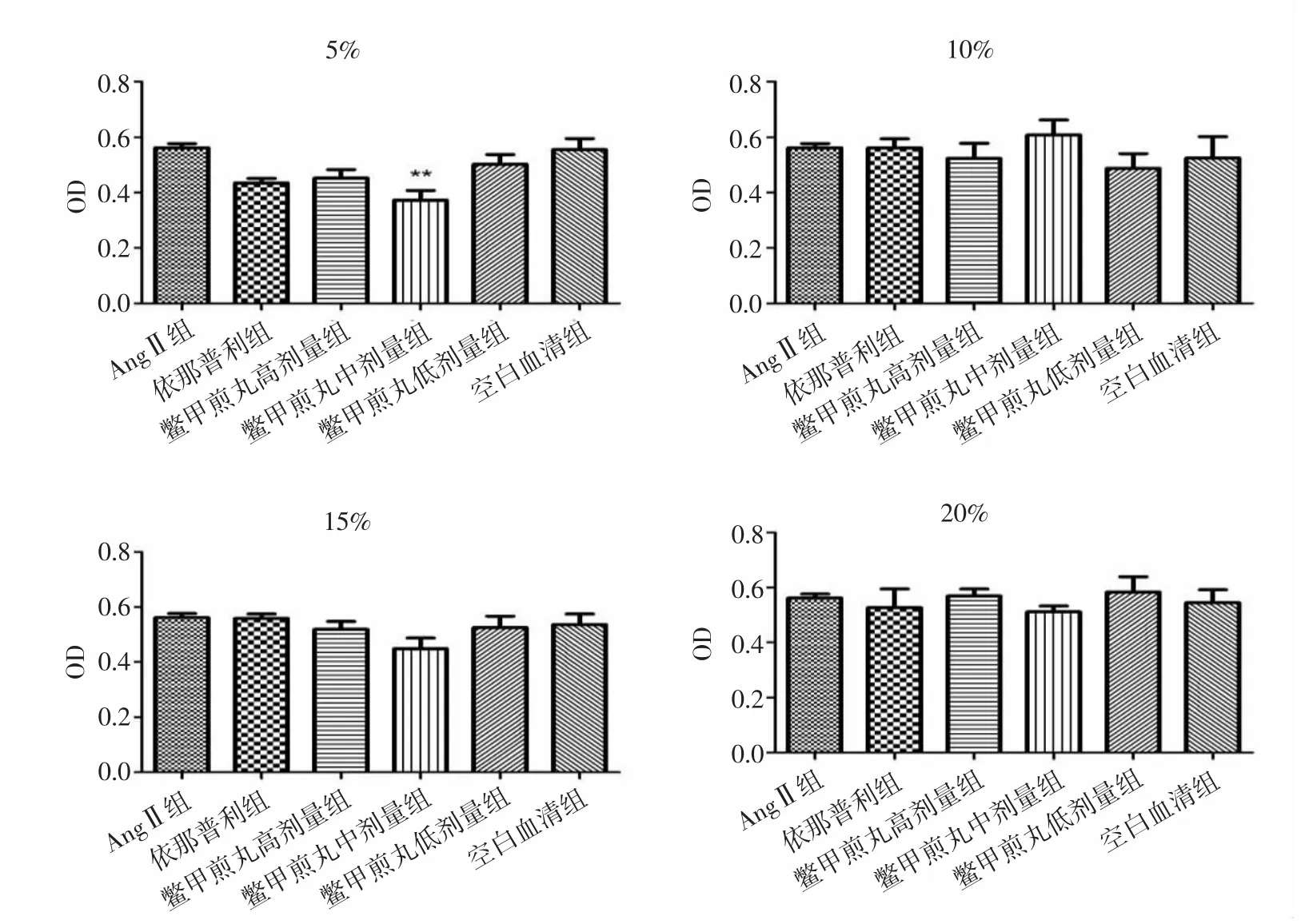
图3 作用72h后各组HSC-LX2细胞增殖活性比较Fig.3 Comparison of proliferation activity of HSC-LX2 cells in each group after treatment of 72h
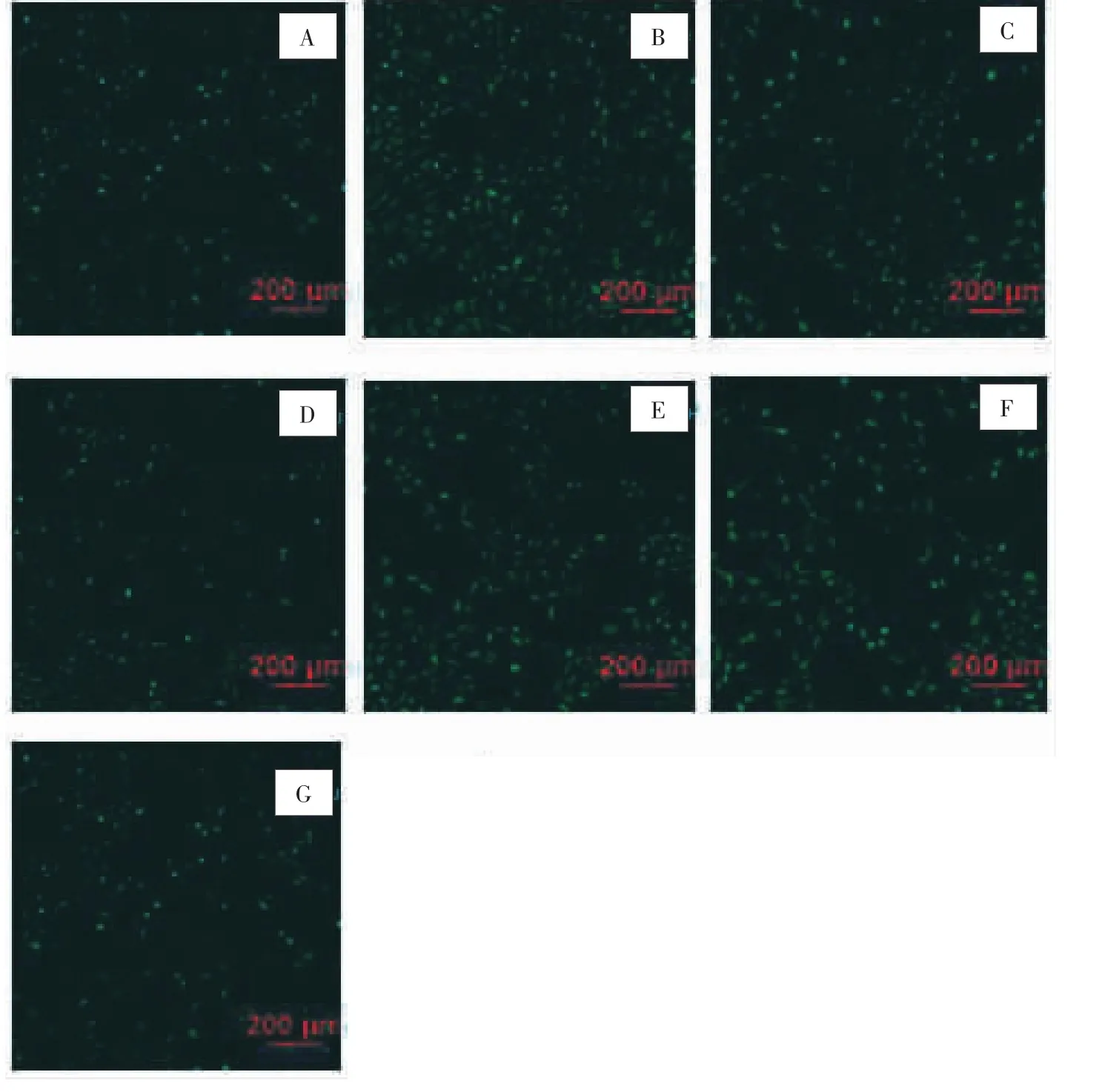
图4 荧光共聚焦显微镜检测HSC-LX2细胞内ROS含量Fig.4 Fluorescence confocal microscopy to detect ROS content in HSC-LX2 cell
2.3 各组HSC-LX2细胞PKC、Pyk2、SRC蛋白表达比较 与空白血清组比较,鳖甲煎丸高、中、低剂量组PKC 表达减低(P<0.001,P<0.001,P<0.001);与 AngⅡ组比较,鳖甲煎丸高、中、低剂量组PKC表达差异无统计学意义(P>0.05)。与空白血清组比较,鳖甲煎丸中、低剂量组 Pyk2 的表达减低(P<0.01,P<0.001);与 AngⅡ组比较,鳖甲煎丸高、中、低剂量组Pyk2的表达明显减低(P<0.05,P<0.001,P<0.001)。与空白血清组比较,鳖甲煎丸高、中、低剂量组SRC表达明显减低(P<0.001,P<0.001,P<0.01);与 AngⅡ组比较,鳖甲煎丸高、中剂量组SRC表达减低(P<0.05,P<0.05)。见图 5。
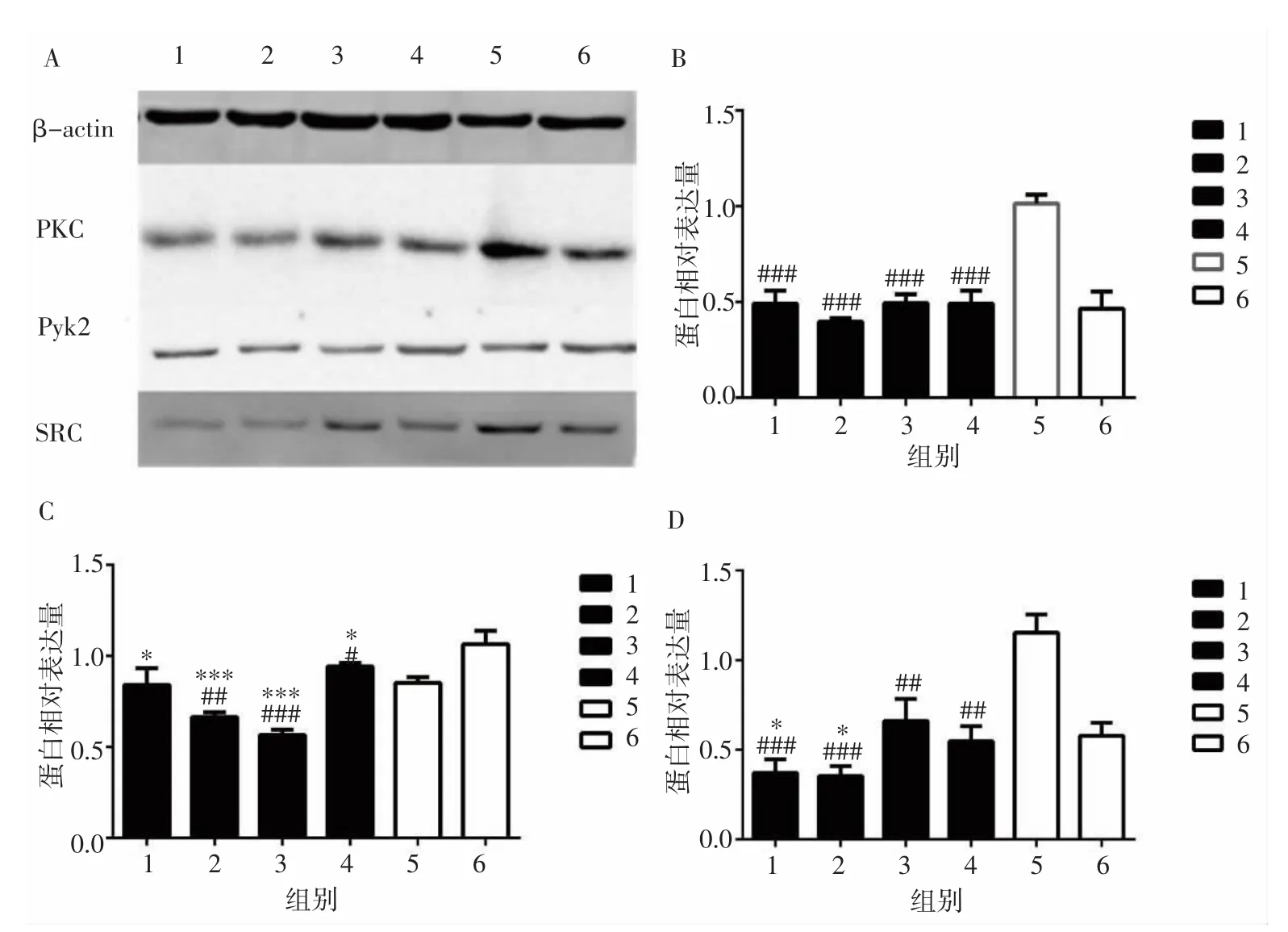
图5 各组HSC-LX2细胞PKC、Pyk2、SRC蛋白表达比较Fig.5 Comparison of protein expression of PKC,Pyk2 and SRC in each group
3 讨论
肝纤维化是多种原因引起的慢性肝损害所致的病理改变,表现为肝内细胞外间质成分异常沉积,并影响肝脏的功能,是慢性肝病发展到肝硬化的必经阶段,其病因大致可分为感染性、先天性代谢缺陷、化学毒物性、自身免疫性肝病等。目前认为,HSC的激活是肝纤维化发生的中心环节,抑制HSC的激活和转化为肌成纤维细胞是抗纤维化研究的热点。对慢性肝脏疾病动物模型的研究已证实了疾病发展过程中存在着氧化应激作用。还有研究证实,AngⅡ在肝纤维化的发生发展中起着重要的作用,可促进肝纤维化的形成[12]。
为了探索AngⅡ对HSC-LX2细胞产生ROS的影响,笔者采用AngⅡ刺激HSC-LX2细胞,通过荧光共聚焦显微镜观察,结果显示,与空白对照组比较,AngⅡ组ROS产生明显增多,经鳖甲煎丸高、中剂量组含药血清干预后,ROS均不同程度减少。这提示AngⅡ可以诱导HSC-LX2细胞产生ROS,鳖甲煎丸对此具抑制作用。
为了观察鳖甲煎丸对HSC-LX2细胞增殖活性的影响是否存在时效、量效关系,笔者选用不同浓度(5%、10%、15%、20%)的高、中、低剂量鳖甲煎丸含药血清,分别干预HSC-LX2细胞24、48、72h,用MTT法观察细胞增殖。结果显示,与AngⅡ组比较,5%鳖甲煎丸含药血清培养24h后,高、中剂量组显著抑制HSC-LX2细胞增殖;48h后,高、中、低剂量组均能显著抑制HSC-LX2细胞增殖;72h后,中剂量组有显著抑制效果。此外,除了15%中剂量鳖甲煎丸含药血清培养48h后有显著抑制效果,其余各组、各时间段均无显著抑制作用。由此可见,5%含药血清干预48h的增殖抑制作用最明显,各剂量组之间没有呈现出量效关系。究其原因主要有以下两方面:一方面含药血清制备尚无统一的给药方案[13],本研究采用不同剂量鳖甲煎丸连续灌胃7d,2次/d的方法,然后取血制备含药血清。经过大鼠机体的代谢,各剂量组血药浓度是否仍有明显差异,尚不确定。另一方面培养液中含药血清的浓度过高有可能反而降低细胞对药物的敏感性。从本研究的结果看,5%的含药血清浓度较为适宜。
AngⅡ能够刺激HSC-LX2细胞产生ROS并增殖,涉及的环节错综复杂。PKC、Pyk2和SRC很可能也参与其中。PKC属于丝氨酸/苏氨酸蛋白激酶家族,广泛存在于机体的组织细胞内,它被多种因素激活后,可通过磷酸化下游蛋白、激活蛋白激酶和诱导几种核转录因子的表达,从而影响细胞的OS反应[3-5]。Western blot结果显示,AngⅡ组中胎牛血清对PKC表达的抑制较明显,空白血清组的PKC表达明显增强。经鳖甲煎丸含药血清干预后,PKC的表达同样受到抑制。结合ROS及MTT的结果可知,PKC参与了AngⅡ-ROS诱导HSC-LX2细胞增殖过程,鳖甲煎丸可抑制PKC的表达。
Pyk2是粘着斑激酶FAK家族重要成员之一,参与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、JAK/STAT、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB/AKT)等多条信号通路的传递,调节着细胞的生长、分化、凋亡和黏附等生理过程。在AngⅡ的刺激下,Pyk2是多种细胞信号途径的一种上游调节因子,参与了AngⅡ诱导的血管平滑肌细胞蛋白合成,有望成为心脏间质纤维化防治的新靶点[14-15]。本研究结果提示,与空白血清组比较,AngⅡ组Pyk2表达增强,经鳖甲煎丸含药血清干预后,Pyk2蛋白表达受到抑制。结合ROS及MTT的结果,笔者认为Pyk2也参与了AngⅡ-ROS诱导HSC-LX2细胞增殖过程,可以将其作为防治肝纤维化的潜在靶点,而鳖甲煎丸对其表达具有抑制作用。
SRC被认为是AngⅡ调节胞内信号的关键成员。在血管平滑肌细胞中SRC以ROS依赖的方式被G蛋白激活,并调节诸如Pyk2、JAK/STAT等下游信号。在AngⅡ作用下,Pyk2和SRC、PI3K等共同导致了细胞生长及局部黏附。ROS能够以直接或间接的方式激活SRC,SRC反过来通过一系列的信号通路对ROS具有调节作用,许多研究已经表明SRC能够呈正反馈地促进ROS的生成[16-17]。本研究结果提示,与AngⅡ组比较,SRC对空白血清组中的大鼠血清更敏感,而鳖甲煎丸含药血清对SRC表达有显著的抑制作用。结合ROS及MTT的结果,笔者认为SRC是AngⅡ-ROS诱导HSC-LX2细胞增殖的促进因素,而鳖甲煎丸可抑制其表达。
综合分析实验结果,笔者得出以下结论:AngⅡ可以诱导HSC-LX2细胞产生ROS,继而影响PKC、Pyk2、SRC蛋白的表达,最终促进细胞的增殖。鳖甲煎丸可通过抑制ROS的产生,下调PKC、Pyk2、SRC蛋白的表达,从而抑制HSC-LX2细胞的增殖。PKC、Pyk2、SRC诸蛋白在其中的调控机制,将在后续研究中采用siRNA技术予以探讨。
