天名精根提取物调控TLRs信号抑制RAW264.7细胞炎症的研究
2019-04-28
浙江中医药大学生命科学学院 杭州 310053
菊科植物天名精(Carpesium abrotanoides Linn.),在《神农本草经》中被列为上品,其性味甘、寒,主瘀血、血瘕欲死[1],临床上广泛用于带状疱疹、流行性腮腺炎、口腔糜烂、毒蛇咬伤等症的治疗[2]。研究发现,其全草的乙醇提取物对LPS诱导的体外炎症反应有一定缓解作用,但具体机制尚不清楚[3]。
炎症是许多疾病的主要危险因素,而巨噬细胞是组成机体抵御外来病原微生物(如细菌、病毒和真菌等)入侵的第一道防线的重要免疫细胞[4-5]。巨噬细胞通常通过识别、吞噬和杀死微生物,在宿主免疫系统中发挥关键作用。炎症期间,巨噬细胞产生大量的炎症介质,如诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶-2(cyclooxygenase-2,COX-2)以及白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎细胞因子[6],这些炎症介质和细胞因子的过量产生可能会对机体器官产生不利影响。
脂多糖(lipopolysaccharide,LPS)是革兰阴性菌外膜中最常见的致病性内毒素成分,在LPS刺激下小鼠腹腔巨噬细胞RAW264.7会发生快速炎症反应,释放大量促炎细胞因子,包括TNF-α、IL-1β和IL-6,以及炎症介质前列腺素 E2(prostaglandin E2,PGE2)、COX-2和iNOS[6];而金黄色葡萄球菌(Staphylococcus aureus)是一种重要的革兰阳性病原菌,可引起严重感染,是多种感染性疾病发病和致死的主要原因[7]。
本实验通过提取天名精根的有效成分,以RAW264.7巨噬细胞为研究对象,采用LPS和灭活的金黄色葡萄球菌刺激RAW264.7细胞,构建体外巨噬细胞炎症模型,研究天名精根提取物对巨噬细胞体外炎症的影响。
1 材料和方法
1.1 细胞和菌种 RAW264.7细胞株、金黄色葡萄球菌ATCC 25923和ATCC 43300均购于中国科学院上海细胞库。
1.2 主要试剂 DMEM高糖培养液购于杭州吉诺生物医药技术有限公司(批号:2017022705);胎牛血清购于杭州四季青生物制品公司(批号:150208);LPS(011:B4)购自 Sigma公司(批号:L2630);核转录因子-κB(nuclear factor-κB,NF-κB)p65鼠单克隆抗体购自美国Santa Cruz公司(批号:B0612);逆转录试剂盒、羊抗鼠IgG购自北京康为世纪生物有限公司(批号:30147、10146)。
1.3 主要仪器 SpectraMax190酶标仪购于美国Molecular Devices公司;3111 CO2培养箱购于美国Thermo Fisher Scientific 公 司 ;PowerPacTMHCBIORAD电泳仪购于美国Bio-Rad公司;5427R低温高速离心机购于德国 Eppendorf公司;Stepone plus荧光定量PCR仪购于美国ABI公司;JY92-Ⅱ超声波细胞粉碎机购于宁波新芝科器研究所;DMI8荧光显微镜购于德国Leica公司。
1.4 实验方法
1.4.1 天名精根提取物制备 天名精采集于杭州市富阳区场口镇上村附近山域,经浙江中医药大学中药学教研室鉴定为菊科天名精属天名精的全草。人工采摘地上部分高50cm及以上的植株,将完整植株置于阳光下直晒,1~2d后装入筐中,放通风处1~2d,待水分向表层渗出后,复晒l~2d直至全干。晒干后,待全草自然降温至常温,剪取根部,放入粉碎机中粉碎,过60目筛。收集粉末,置于灭菌烘干的500mL玻璃瓶中密封,4℃保存备用。精密称取5.0g天名精根粉末,加80%乙醇超声提取60min,重复3次,合并滤液,旋蒸挥干后冷冻干燥得0.553g天名精根乙醇提取物(ethanol extract of Carpesium abrotanoides Linn.’s root,ECA),得率为 10.67%;1.5g ECA 加入石油醚超声提取40min,重复3次,合并滤液,旋蒸挥干,冷冻干燥后得到0.16g天名精根石油醚提取物(petroleum ether extract of Carpesium abrotanoides Linn.’s root,PCA),得率10.6%。每100.00μg ECA相当于937.21μg天名精根粉末;每100.00μg PCA相当于8.84mg天名精根粉末。
1.4.2 热灭活的金黄色葡萄球菌(heat-inactivated preparations of Staphylococcus aureus pathogens,SAC)制备 金黄色葡萄球菌菌株在LB培养基中,37℃条件下培养。待达到对数生长期(600nm处的OD值为0.5,即为 5×107个/mL),调整数量后 80℃热灭活 1h,以培养基洗涤2次,最终将数量调整为1×108个/mL,-20℃保存。
1.4.3 高效液相色谱法(high performance liquid chromatography,HPLC) 检测 色谱条件:C18柱(Φ4.6mm×250mm,5μm);流动相乙腈由 5%梯度洗脱至100%;测定时间30min;检测波长210nm,流速1mL·min-1,柱温 30℃,进样体积 10μL。
1.4.4 细胞培养 RAW264.7细胞采用含有10%胎牛血清、青霉素100U·mL-1及链霉素100U·mL-1的DMEM高糖培养液培养,置于37℃、5%CO2培养箱中,每3d传代1次。
1.4.5 MTT法检测细胞增殖活性 取对数生长期的细胞,倒置显微镜下观察计数,调整细胞密度为1×105个/mL,接种于96孔板,每孔200μL,置于培养箱贴壁培养 24h,分别用 0、10、25、50、100、200μg·mL-1ECA或PCA处理细胞,每组设6个复孔,每孔终体积为 200μL。作用 6h 后每孔加入 5g·L-1MTT 20μL,暗室孵育4h,弃去培养液,然后加入二甲基亚砜(dimethyl sulfoxide,DMSO)150μL,以空白孔调零,震荡混匀后,酶联免疫监测仪上490nm波长测定各孔吸光度值。
1.4.6 qPCR检测Toll样受体-2(Toll-like receptor-2,TLR-2)、TLR-4、髓样分化因子 88(myeloid differentiation primary response 88,MyD88)、IL-1β、IL-6、TNF-α基因mRNA表达 取对数生长期细胞,调整细胞密度为1×105个/mL,接种于12孔板,每孔1mL,置于培养箱贴壁培养24h,分为正常对照组(不加干预的RAW264.7细胞),炎症模型组(2μg·mL-1LPS孵育RAW264.7细胞6h或MOI=5的SAC孵育RAW264.7 细胞 3h),ECA 组 (100μg·mL-1ECA 与LPS共同孵育6h或与SAC共同孵育3h),PCA组(100μg·mL-1PCA与LPS共同孵育6h或与SAC共同孵育3h)。细胞处理结束后,收集细胞,以Trizol法提取各组细胞中的总RNA,紫外分光光度计测定总RNA的纯度及浓度。根据反转录试剂盒说明书反转录合成cDNA第一链,采用荧光定量PCR进行扩增,每样本设3个复孔。所有引物由上海生工生物技术有限公司合成,序列如表1所示。扩增条件:95℃预变性 5min,95℃ 10s,60℃ 30s,72℃ 5s,扩增 40 个循环。mRNA相对表达量计算采用Ratio=2-ΔΔCT方法,ΔCT1=对照组目的基因CT值-对照组内参基因CT值,ΔCT2=实验组目的基因CT值-实验组内参基因CT 值,ΔΔCT=ΔCT2-ΔCT1,代入公式 2-ΔΔCT计算,即得到mRNA相对表达量。
1.4.7 Western blot检测NF-κB p65蛋白的表达取对数生长期的细胞,倒置显微镜下观察计数,调整细胞密度为2×105个/mL,接种于6孔板,每孔2mL,置于培养箱贴壁培养24h,细胞分组同1.4.6中。处理结束后,收集各组细胞,以预冷的PBS洗涤5次,加入预冷的细胞裂解液裂解细胞,混匀后超声破碎细胞;4℃、12 000r/min离心30min,转移上清液于新的EP管中,以BCA法测定蛋白浓度。一定量的蛋白样品与上样缓冲液按比例混合后煮沸5min,SDS-PAGE电泳3h,200mA恒流转膜2h,5%脱脂奶粉室温封闭2h,TBST漂洗3次后分别加入相应一抗,4℃孵育过夜。次日TBST漂洗3次,加入二抗37℃孵育2h,TBST漂洗3次后进行ECL显色。用凝胶成像分析系统分析电泳条带,以内参为对照,计算各处理组目的蛋白的表达情况。

表1 引物序列Tab.1 Primer sequences
1.5 统计学分析 采用GraphPad Prism 6.0统计软件进行统计学分析。计量数据以±s表示,两组间比较采用t检验,大于两组比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 HPLC分析 ECA的HPLC检测结果见图1。PCA的HPLC检测结果见图2,其中以峰A的物质为主,于28.78min出峰,峰高1 928mAU。
2.2 各组细胞增殖情况比较 MTT结果显示,与正常对照组比较,当ECA或PCA浓度≥200μg·mL-1时,细胞存活率降低(P<0.01),提示高浓度的ECA或PCA对细胞增殖具有明显抑制作用。见图3。故采用100μg·mL-1ECA和100μg·mL-1PCA进行后续研究。
2.3 天名精根提取物对细胞炎症因子mRNA表达的影响 与正常对照组比较,2μg·mL-1的LPS刺激6h后,RAW264.7 细胞中的炎症因子 IL-1β、IL-6、TNF-α mRNA 表达增加(P<0.01),而 100μg·mL-1的 ECA或PCA干预后,这些炎症因子mRNA的表达均显著下降(P<0.01)。与正常对照组比较,以MOI=5的SAC刺激细胞 3h 后,RAW264.7 细胞中 IL-1β、IL-6、TNF-α mRNA 表达增加(P<0.01),而 100μg·mL-1的ECA或PCA干预后,相关炎症因子mRNA的表达显著下降(P<0.01)。见图 4。
2.4 天名精根提取物对NF-κB表达的影响 与正常对照组比较,无论是LPS刺激6h还是以MOI=5的SAC刺激RAW264.7细胞3h后,细胞中的NF-κB mRNA和NF-κB p65蛋白表达量均明显增加(P<0.01),在 100μg·mL-1ECA 或 PCA 干预后,NF-κB mRNA和NF-κB p65蛋白表达量低于LPS组和SAC组(P<0.01)。见图 5。

图1 ECA的HPLC检测结果Fig.1 ECA HPLC test results of ECA

图2 PCA的HPLC检测结果Fig.2 HPLC test results of PCA

图3 不同浓度天名精根提取物对细胞增殖的影响Fig.3 Effect of different concentration extracts of Carpesium abrotanoides Linn.’s root on cell proliferation
2.5 天名精根提取物对TLRs/MyD88 mRNA表达的影响 LPS刺激6h后,与正常对照组比较,RAW264.7细胞TLR-2的mRNA表达无统计学差异(P>0.05),TLR-4及 MyD88 mRNA 表达均增加(P<0.01,P<0.05)。ECA或 PCA 干预后 TLR-2的 mRNA表达与LPS组比较无统计学差异(P>0.05);TLR-4 mRNA表达量明显低于LPS组,差异有统计学意义(P<0.01);PCA干预后MyD88 mRNA表达量明显低于LPS组,差异有统计学意义(P<0.05),而ECA干预后MyD88 mRNA表达与LPS组比较,差异无统计学意义(P>0.05)。
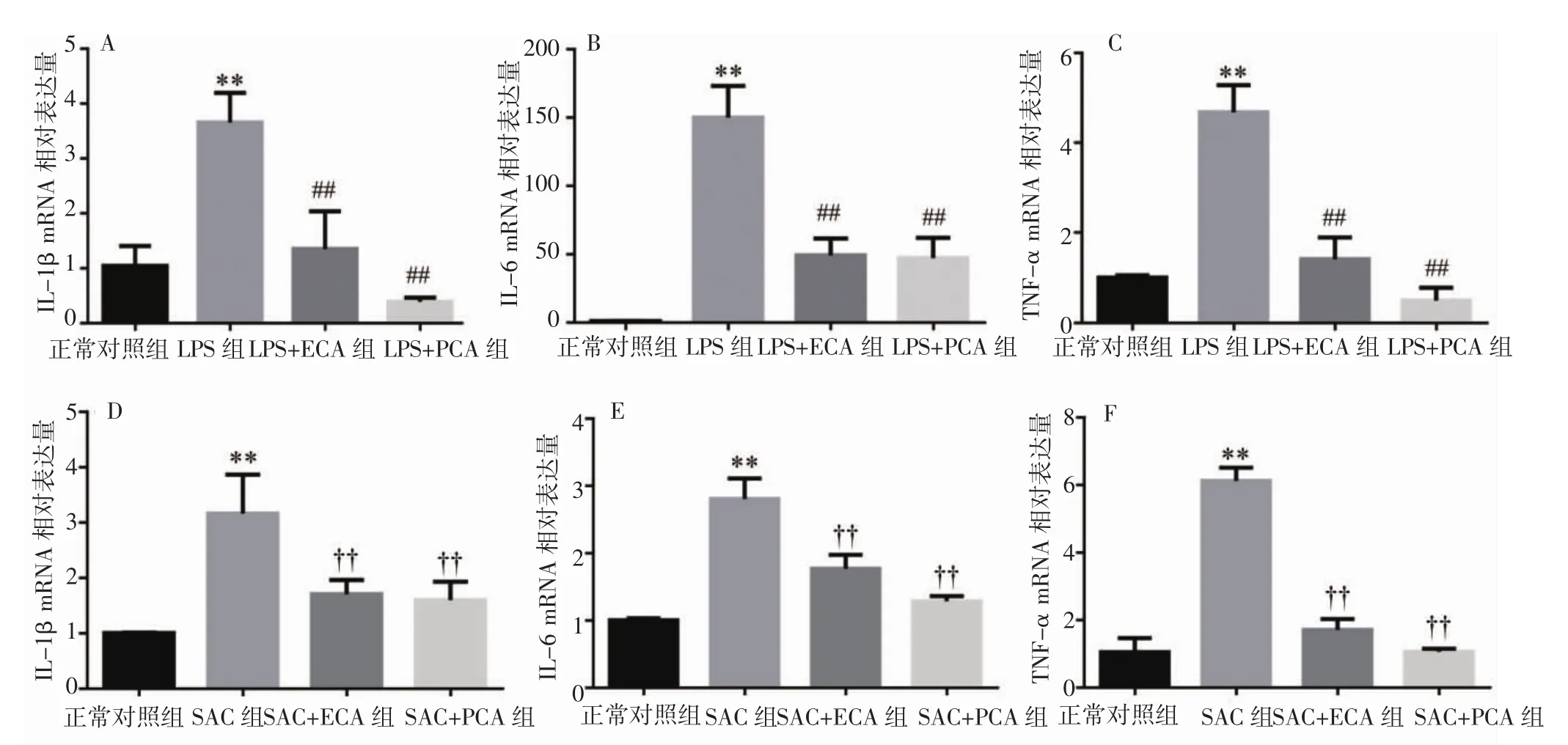
图4 不同天名精根提取物对炎症因子mRNA表达的影响Fig.4 Effects of ECA or PCA on mRNA expression of inflammatory factors
SAC刺激3h后,与正常对照组比较,TLR-2及MyD88 mRNA表达增加(P<0.01),TLR-4 mRNA表达无统计学差异(P>0.05)。ECA或PCA干预后,TLR-2 mRNA的含量明显低于SAC组(P<0.01),MyD88 mRNA 表达低于 SAC 组(P<0.05,P<0.01),而TLR-4 mRNA表达无统计学差异(P>0.05)。见图6。
3 讨论
天名精又名鹿活草,是一种两年生草本植物,常应用于传统中医治疗中,其主要药效成分为倍半萜内酯[8]。现有实验表明,天名精提取物具有抗菌、抗炎等功效[9-11]。既往实验通常分离其地上部分、花或果实,提取活性成分进行研究[9-11],在本研究中笔者根据传统医方提示,以天名精根作为研究对象,从天名精根中分离有效成份,希望发现并确定其功能化合物。经过HPLC检测,与汪蕾等[12]、沈冰冰等[13]以及杨勇勋等[14]的研究进行比对发现,ECA和PCA的检测图谱与目前已知的天名精化合物群无法重合。对PCA中主要的A峰物质进行质谱检测,发现其分子量为360.2,与已知的天名精所提取物无一相同,故笔者推测ECA和PCA所含主要成分可能是一类新的萜类物质。

图5 不同天名精根提取物对NF-κB表达的影响Fig.5 Effects of ECA or PCA on the expression of NF-κB
TLR是近年来发现的细胞表面受体家族,是连接天然免疫和适应性免疫的桥梁。TLR-2作为革兰阳性菌的主要识别受体,在抗菌免疫中发挥显著作用。TLR-2在人单核细胞、巨噬细胞表面都呈较高水平的表达[15],一般和TLR-1或TLR-6形成二聚体,能够识别革兰阳性菌和革兰阴性菌的脂蛋白、革兰阳性菌的脂磷壁酸、分支杆菌的阿拉伯糖甘露糖脂,TLR-2和TLR-1二聚体还可以识别革兰阴性菌的三酰基脂蛋白,TLR-2和TLR-6二聚体可以识别革兰阳性菌的二酰基脂蛋白,具有较广泛的识别普遍性[15]。而TLR-4是一种革兰阴性菌的主要识别受体,其可以激活下游蛋白质复合体相互作用,释放促炎细胞因子或Ⅰ型干扰素(interferon type Ⅰ,IFN-Ⅰ)[16]。
本研究在体外模拟了急性炎症常见的革兰阴性和革兰阳性病原菌刺激巨噬细胞的炎症模型,研究结果表明,天名精根提取物降低LPS诱发的巨噬细胞中 TLR-4介导的 IL-1β、IL-6、TNF-α mRNA 的表达。同时还可以缓解由SAC引起的巨噬细胞炎症反应。在研究中发现ECA和PCA可以抑制由SAC刺激TLR-2介导的 IL-6、TNF-α、IL-1β mRNA 表达。目前研究表明无论TLR-2还是TLR-4主要通过MyD88依赖和β-干扰素TIR结构域衔接蛋白(TIR-domaincontaining adaptor inducing interferon-β,TRIF)依赖的两个下游分支途径调节炎症基因的表达,而MyD88是参与TLRs介导的炎症表达的关键信号适配基因,其可以募集IL-1受体相关激酶1(IL-1 receptor associated kinase1,IRAK1)和 IRAK4 至 TLRs[17],这个信号复合体也可以促进这些激酶的磷酸化,磷酸化的IRAK1可以激活肿瘤坏死因子受体相关因子6(tumour necrosis factor receptor-associated factor 6,TRAF6),此外可以激活I-κB激酶(I-kappaB kinase,IKK)复合体,导致转录因子 NF-κB 的活化[18]。NF-κB是在TLRs介导的炎症中起核心作用的基因,已有研究在IFN-γ、IL-10、TNF-α 和 IL-6等大多数细胞因子基因的启动子中发现了NF-κB编码结合位点[19-21]。在无刺激的条件下,NF-κB通常与I-κB固定于细胞质中,而当外源病原菌刺激时,I-κB磷酸化导致NF-κB p65和p50亚基释放,易位于核并与相关的DNA序列结合,诱导靶基因表达[22]。本研究结论也支持了这一观点,无论是LPS激活TLR-4还是SAC激活TLR-2都会使MyD88的表达增加,促进NF-κB活化,ECA和PCA均可以抑制这一通路的激活,从而缓解炎症症状。本研究也证实了,天名精根提取物对革兰阴性和阳性菌引起的巨噬细胞体外炎症均有良好的缓解作用。
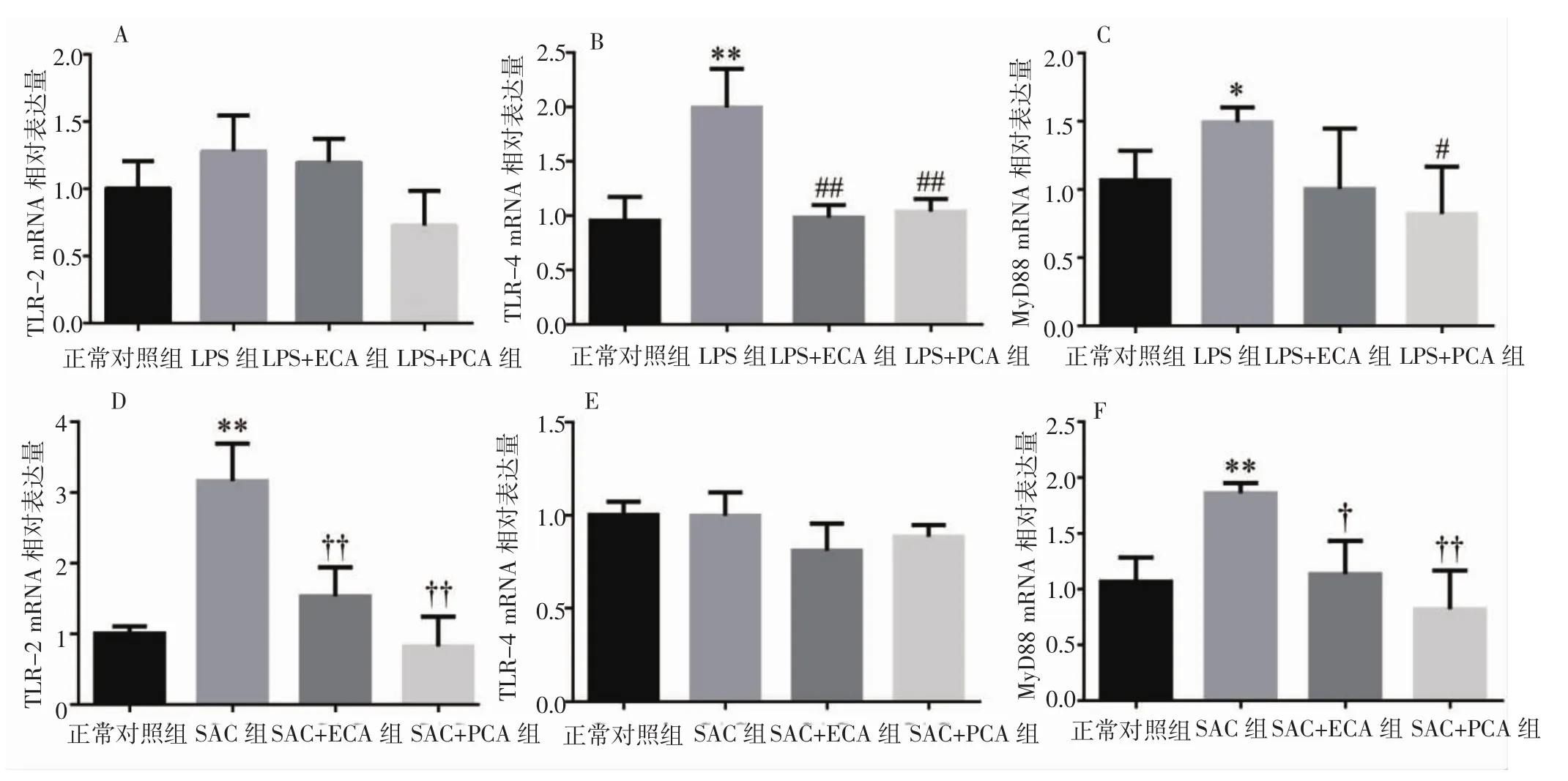
图6 不同天名精根提取物对TLRs/MyD88 mRNA表达的影响Fig.6 Effects of ECA or PCA on mRNA expression of TLRs/MyD88
综上所述,天名精根提取物可以抑制由LPS和SAC刺激RAW264.7细胞引起的体外炎症反应,其机制可能与抑制TLRs信号通路有关。本实验根据传统医方首次对天名精根进行了活性成分提取,得到一类新型的萜类物质,并进行药理活性研究,为天名精的开发提供了新的实验基础,但所得提取物的结构式尚待进一步分析与实验。
