长链非编码RNA HOTAIR靶向miR-1对胶质瘤细胞增殖、侵袭和迁移能力的影响
2019-04-27董孟宁张建党张元峰韩伟一
董孟宁, 张建党,张元峰,韩伟一
(南阳市中心医院 神经外科,河南 南阳473009)
胶质瘤是中枢系统最常见的恶性肿瘤,具有较高的癌细胞转移率和致死率。据报道,经常规治疗的胶质瘤患者生存时间中位数仅有15个月[1]。因此探究胶质瘤发生发展机制,寻找治疗胶质瘤的新方法显得尤为迫切。长链非编码RNA是一类在哺乳动物体内高度保守的RNA,不参与蛋白质的编码,但能通过调控基因的表达过程影响疾病的发生发展,如影响基因转录、翻译后修饰及调控表观遗传等[2]。研究发现LncRNAs在多类疾病中均出现表达异常,特别是癌症[3,4]。大量研究表明,LncRNAs在胶质瘤中表达也有不同程度的升高和降低,如LncRNA CCAT1在胶质瘤细胞中表达升高,能通过靶向抑制微小型RNA-410(microRNA-410,miR-410) 的表达促进胶质瘤细胞增殖[5]。LncRNA GRNDE在胶质瘤细胞中表达增多,能通过调控mTOR信号通路促进胶质瘤细胞生长和侵袭[6]。也有研究表明,LncRNA HOTAIR在胶质瘤中表达升高,与胶质瘤患者的存活时间及预后密切相关,可作为胶质瘤生物标记物[7,8]。HOTAIR可通过靶向调控miR-326的表达影响胶质瘤细胞的生长[1]。miR-1是一类抑癌基因,在胶质瘤中呈低表达水平,Su DN等人研究发现,HOTAIR能通过负向调控miR-1的表达促进肝癌的发展[9],但HOTAIR是否能通过靶向调控miR-1的表达影响胶质瘤细胞的生存及侵袭转移能力还未见报道。本文通过沉默HOTAIR的表达,探究HOTAIR对胶质瘤细胞生存、侵袭及迁移的影响及机制,为HOTAIR应用于临床胶质瘤的预防及治疗提供更多依据。
1 材料与方法
1.1 主要试剂
人胶质瘤细胞株U87、U251、U118和LN18购自美国典型培养物保藏中心 (American type culture collection,ATCC)。RPMI 1640培养液和胎牛血清购自美国Gibco公司,青霉素和链霉素购自美国BI公司。Trizol试剂、RIPA裂解液和BCA试剂盒购自北京索莱宝生物公司,Lipofectamine 2000转染试剂盒、逆转录试剂盒、荧光素酶报告检测试剂盒和实时定量PCR试剂盒购自美国ThermoFisher公司。shRNA HOTAIR (sh-HOTAIR) 和miR-1 inhibitor购自上海吉满生物科技公司,实验所用引物采用Primer 3网站设计,由上海生工合成。Ki67、Bcl-2、Bax、基质金属蛋白酶-2 (Matrix metalloproteinase-2,MMP-2) 和MMP-9购自美国Santa Cruz公司,实验所有二抗购自上海博士德生物科技公司。
1.2 细胞培养
用含有10%胎牛血清,100 μg/mL的链霉素和100 U/mL的RPMI 1640培养液培养人胶质瘤细胞株U87、U251、U118和LN18,培养环境条件为37 ℃、5% CO2,隔天进行换液,细胞融合率达到85%以上时进行传代,传代浓度为1×104个/mL。
1.3 细胞分组及转染
将细胞分为Control组、sh-HOTAIR组、miR-1 inhibitor组和sh-HOTAIR + inhibitor组,将细胞接种于6孔板中,种板浓度为1×105个/mL。培养24 h后,根据转染试剂盒说明书用sh-HOTAIR转染sh-HOTAIR组细胞,miR-1 inhibitor转染miR-1 inhibitor组细胞,用sh-HOTAIR和miR-1 inhibitor同时转染sh-HOTAIR + inhibitor组细胞,Control组则加入等量载体进行处理。转染6 h后更换为正常细胞培养液继续培养,进行后续检测。
1.4 RT-PCR检测HOTAIR和miR-1的表达
用Trizol试剂提取胶质细胞株U87、U251、U118和LN18及用sh-HOTAIR处理后的U251细胞的总RNA进行定量分析后,每组取等量的RNA根据逆转录试剂盒说明书合成cDNA,用PCR仪进行扩增后,采用实时定量PCR试剂盒对其进行定量分析。
1.5 荧光素酶报告实验
通过生物信息预测HOTAIR和miR-1的结合片段,采用PCR进行扩增并插入到荧光素酶报告酶载体中,构建HOTAIR 野生型 (wt) 质粒;采用基因突变技术对HOTAIR序列上与miR-1的结合位点的个别核苷酸进行突变 ,构建HOTAIR突变型 (mut) 质粒。用miR-1 mimic和HOTAIR wt或HOTAIR mut共同转染U251细胞,24 h后检测各组细胞的荧光素酶活性。
1.6 CCK8检测细胞活性
按照1.3所描述的方法转染各组细胞,转染后分别培养0 d、1 d、2 d、3 d和4 d根据CCK8试剂盒说明书每孔分别加入10 μl的CCK8溶液,37 ℃孵育3 h后于450 nm处检测各组细胞吸光度,计算细胞的增殖生长倍数。
1.7 流式检测细胞凋亡
将细胞按照1.3所描述的方法进行处理后,用胰蛋白酶消化收集细胞,用预冷的冷酸盐缓冲液清洗3次后,用结合缓冲液将细胞密度调整至1×106个/mL,取100 μl细胞悬液加入到试管中,并加入5 μl的Annexin V和10 μl的PI溶液,室温避光孵育15 min后用流式细胞仪检测各组细胞凋亡率。
1.8 Transwell检测细胞侵袭能力
实验前将Matrigel放于4 ℃融化,融化后取少量Matrigel加入到Transwell小室中进行预包被,并尽量避免气泡产生。将细胞接种于Transwell小室内,按照1.3的方法进行分组后转染,用无血清培养液继续培养。24 h后用棉签擦去上层未迁移的细胞,用HE染色液将下层迁移细胞染色并进行计数统计。
1.9 划痕实验检测细胞迁移能力
实验前用记号笔于12孔板背面划线,使至少有5条线穿过每个培养孔。将细胞接种于12孔板中,并进行分组转染。转染后用10 μl的枪头垂直于背面直线划痕,用磷酸盐缓冲液洗去被刮下的细胞,换用无血清培养液继续培养。记录0 h和24 h的划痕宽度,计算划痕闭合率[划痕闭合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%]。
1.10 免疫印迹检测相关蛋白表达
将细胞进行转染后,用裂解液提取各组细胞蛋白,用BCA试剂盒进行定量分析后,调平各组细胞蛋白浓度。每组分别取30 μg蛋白质用10% SDS-PAGE分离各组蛋白,用半干法将蛋白质转移到PVDF膜并加入5%的脱脂牛奶室温封闭2 h,之后加入适应浓度一抗于4 ℃孵育过夜,第二天洗去未结合一抗,加入二抗于37 ℃孵育1 h后,滴加化学发光显色液进行曝光显色。以GAPDH为内参。
1.11 统计学分析
本文所有实验数据均用统计软件SPSS 17.0进行分析。先对实验数据进行正态分布和方差齐性分析,符合条件者采用单因素方差分析或t检验,不符合条件则采用秩和检验。
2 结果
2.1 sh-HOTAIR促进miR-1表达
如图1所示,HOTAIR在多类胶质瘤细胞株中的表达水平以U251细胞最高,因此选择U251细胞进行后续实验。用sh-HOTAIR转染细胞后发现,sh-HOTAIR能显著降低U251细胞HOTAIR的表达水平 (P<0.001,图2),并显著升高miR-1的表达水平 (P<0.001,图2),表明HOTAIR能抑制miR-1的表达。
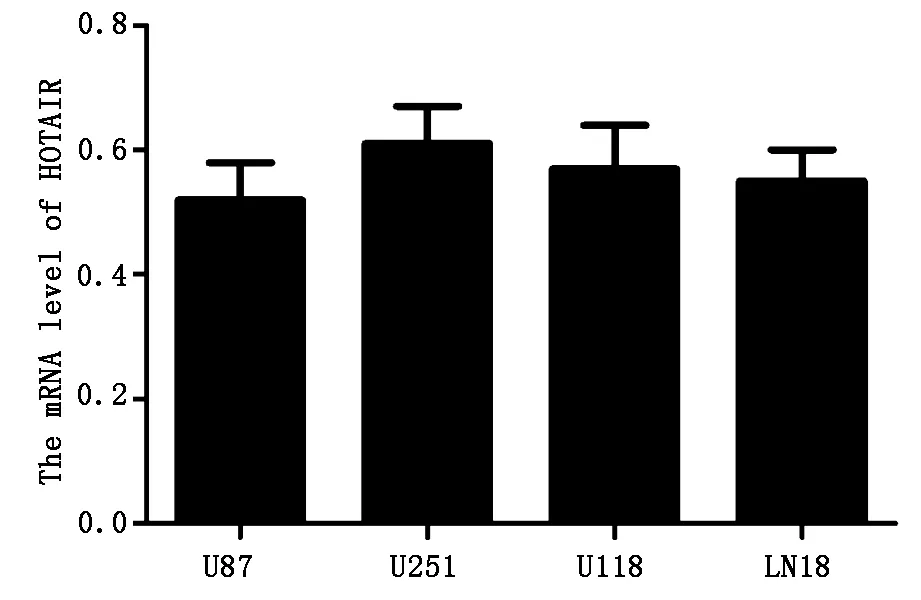
图1 HOTAIR在胶质瘤细胞株中的表达

图2 sh-HOTAIR对U251细胞HOTAIR和miR-1
2.2 HOTAIR与miR-1的靶向关系
生物信息预测结果表明,miR-1序列上存在HOTAIR的结合位点。同时,miR-1 mimic能显著升高U251细胞miR-1的表达水平 (P<0.001,图3),并且还能降低HOTAIR野生质粒的荧光素酶活性 (P<0.001,图3),将结合位点核苷酸进行突变后,miR-1 mimic对HOTAIR质粒荧光素酶活性的抑制作用消失,提示HOTAIR能靶向结合miR-1。
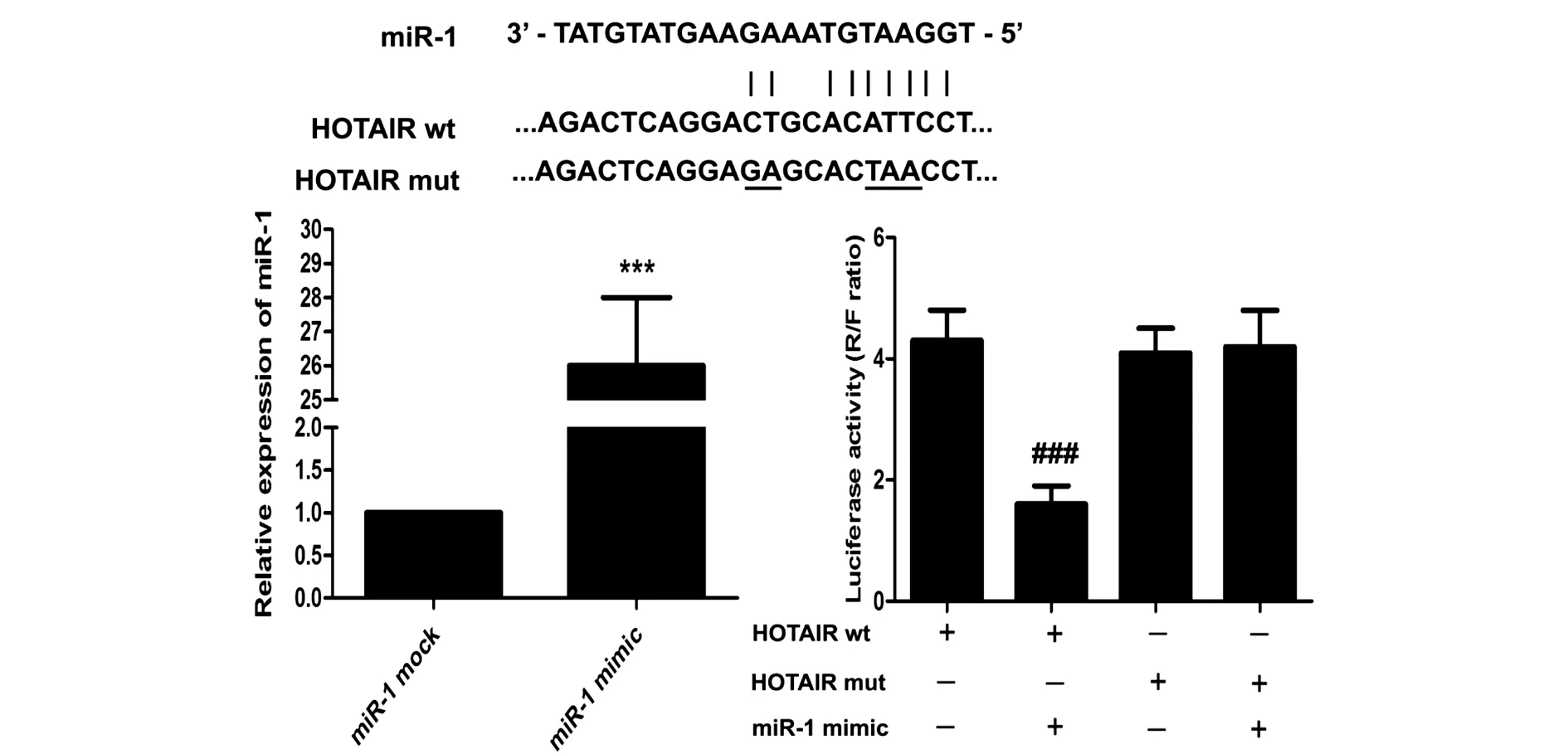
图3 HOTAIR与miR-1的靶向关系
2.3 sh-HOTAIR抑制U251细胞增殖
与Control组比较,sh-HOTAIR组细胞生长倍数明显降低 (P<0.001,图4),miR-1 inhibitor组细胞生长倍数明显升高 (P<0.01,图4),差异有统计学意义;与sh-HOTAIR组比较,sh-HOTAIR + inhibitor组细胞生长速度明显升高(P<0.001,图4),差异有统计学意义。同时,sh-HOTAIR组细胞增殖相关蛋白Ki67的表达水平与Control组比较明显降低 (P<0.001,图8),miR-1 inhibitor组Ki67表达水平明显高于Control组 (P<0.001,图8);sh-HOTAIR + inhibitor组Ki67表达水平与sh-HOTAIR组比较明显升高 (P<0.01,图8),差异有统计学意义,表明sh-HOTAIR能通过诱导miR-1表达抑制U251细胞增殖。
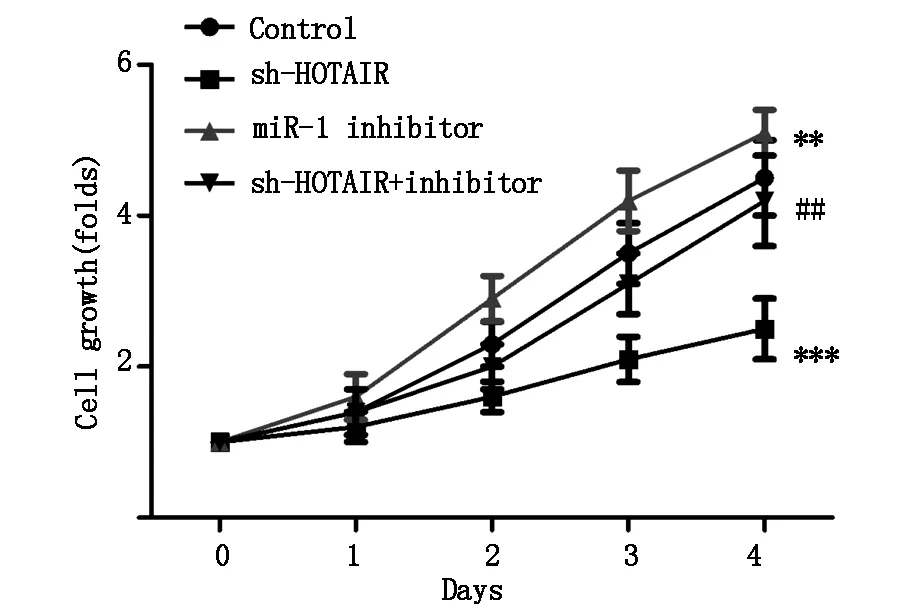
图4 sh-HOTAIR对U251细胞增殖的影响
2.4 sh-HOTAIR诱导U251细胞凋亡
如图5所示,与Control组比较,sh-HOTAIR组细胞凋亡率明显升高 (P<0.001,图5),miR-1 inhibitor组细胞凋亡率明显降低 (P<0.01,图5);与sh-HOTAIR组比较,sh-HOTAIR + inhibitor组细胞凋亡率明显升高 (P<0.001,图5),差异有统计学意义;此外,sh-HOTAIR能显著抑制抗凋亡蛋白Bcl-2的表达 (P<0.001,图8),诱导促凋亡因子Bax表达 (P<0.001,图8),miR-1 inhibitor能显著升高Bcl-2的表达水平 (P<0.01,图8),降低Bax的表达水平(P<0.01,图8);miR-1 inhibitor还能显著减弱sh-HOTAIR对Bcl-2和Bax表达的调控作用 (P<0.01,图8),表明sh-HOTAIR能通过促进miR-1表达诱导U251细胞凋亡。
2.5 sh-HOTAIR抑制U251细胞侵袭
与Control组比较,sh-HOTAIR组侵袭细胞数明显减少(P<0.001,图6),miR-1 inhibitor组侵袭细胞明显增多(P<0.01,图6);与sh-HOTAIR组比较,sh-HOTAIR + inhibitor组侵袭细胞明显增多 (P<0.01,图6),表明sh-HOTAIR能通过诱导miR-1表达降低U251细胞侵袭能力。
2.6 sh-HOTAIR抑制U251细胞迁移
与Control组比较,sh-HOTAIR组细胞划痕闭合率明显降低 (P<0.001,图7);与sh-HOTAIR组比较,sh-HOTAIR + inhibitor组细胞划痕闭合率显著升高(P<0.01,图7),差异有统计学意义。同时,sh-HOTAIR能显著抑制U251细胞侵袭和迁移相关蛋白MMP-2和MMP-9的表达 (P<0.001,图8),miR-1 inhibitor能显著促进MMP-2和MMP-9的表达 (P<0.01,图8),miR-1 inhibitor还能显著减弱sh-HOTAIR对MMP-2和MMP-9表达的促进作用 (P<0.01,图8),提示sh-HOTAIR能通过抑制miR-1的表达抑制U251细胞迁移。
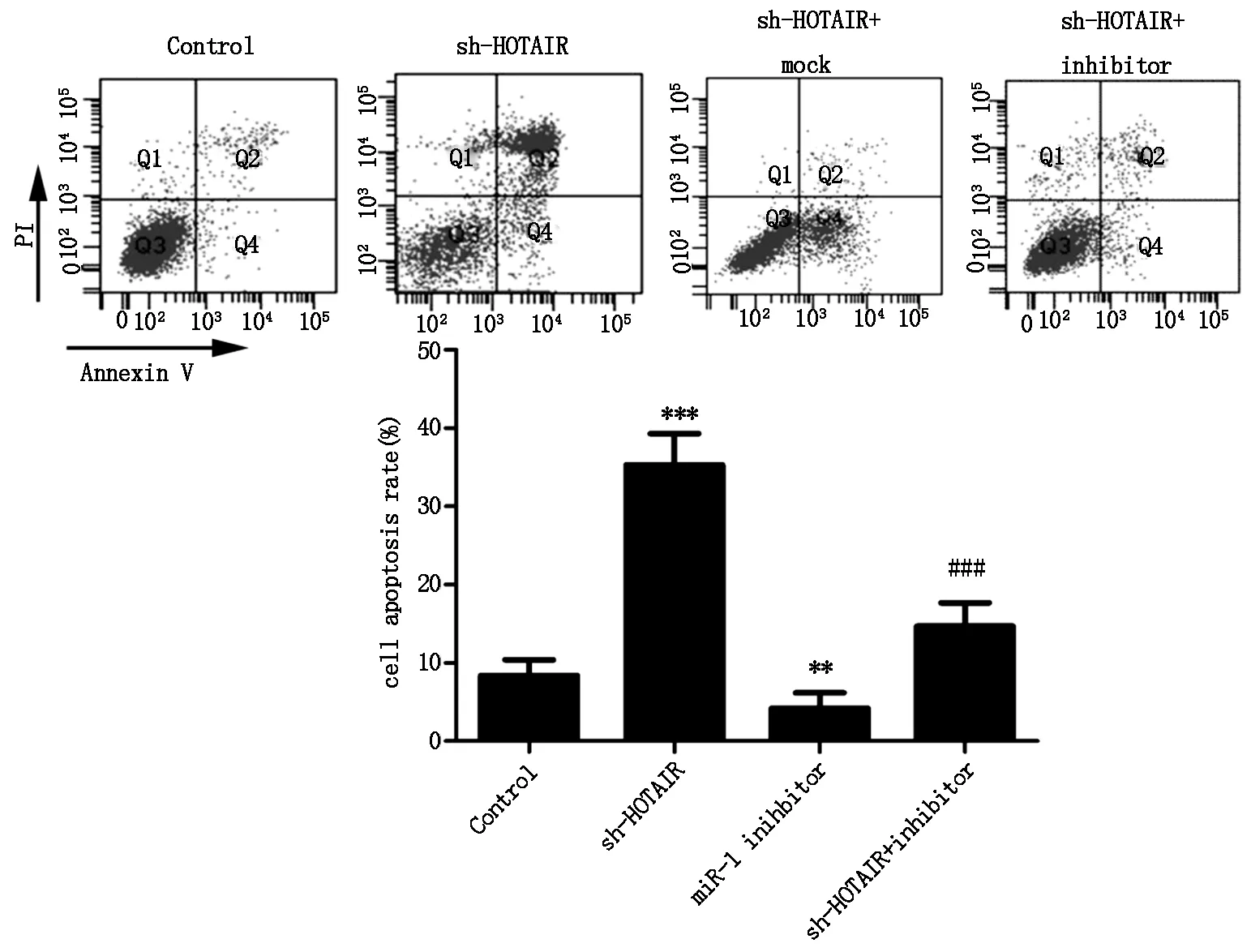
图5 sh-HOTAIR对U251细胞凋亡的影响

图6 sh-HOTAIR对U251细胞侵袭的影响

图7 sh-HOTAIR对U251细胞迁移的影响
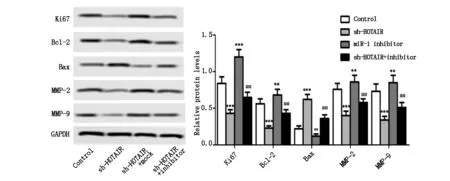
图8 sh-HOTAIR对Ki67、Bcl-2、Bax、MMP-2和MMP-9表达的影响
3 讨论
目前大量研究表明,LncRNA的异常表达不仅能影响真核细胞基因的表达,同时还能促进疾病的发生发展,能通过调控细胞增殖使细胞获得无限增殖的能力,导致癌症的发生,同时还能促进癌症转移,诱导癌症恶化[10,11]。HOTAIR是一类致癌基因,于2010年首次被报道其与乳腺癌患者癌症的转移相关[12]。随后大量研究报道表明HOTAIR在其他各类癌症中均表现为高表达状态,并且与癌症的发生有着密切关系[13,14]。也有大量研究表明,HOTAIR在胶质瘤细胞及患者的肿瘤组织中表达均明显增多,并与胶质瘤细胞增殖、侵袭和迁移有关[15]。但具体作用机制有待进一步探究。本研究首先检测了HOTAIR在几类胶质瘤细胞株中的表达情况并发现,HOTAIR在U251细胞中表达水平最高,因此选择U251细胞进行后续实验。
miR-1是一类在多种癌症中低表达的miRNA,在胶质瘤发生发展过程中起到负向调控的作用[16]。上调miR-1的表达能通过调控表皮生长因子受体抑制胶质瘤细胞的迁移,从而减缓胶质瘤患者病情的恶化[17]。本文研究结果表明下调HOTAIR的表达能显著升高miR-1在U251细胞中的表达水平,提示HOTAIR可能抑制miR-1的表达。生物信息预测结果表明,miR-1基因序列上存在连续的HOTAIR的结合位点。此外,荧光素酶报告实验结果发现,miR-1 mimic能显著减弱HOTAIR荧光素酶的活性,将HOTAIR序列上的个别结合位点突变后miR-1 mimic抑制荧光素酶活性的抑制作用消失,进一步证明HOTAIR能靶向抑制miR-1的表达。
细胞无限增殖是癌症的主要特征之一,抑制癌细胞增殖也是目前临床放化疗治疗癌症的主要作用机制。研究表明,抑制HOTAIR的表达能抑制多种癌细胞的增殖,作用机制与调控miRNAs的表达有关。LIU SH等人在对胃癌的研究中发现,HOTAIR能通过靶向抑制miR-331-3p的表达促进人类表皮生长因子受体2表达促进胃癌肿瘤的生长[18]。HOTAIR还能通过靶向抑制miR-1的表达调控食道鳞状细胞癌细胞周期,从而促进癌细胞增殖[19]。Di W等人研究表明,HOTAIR能通过调控miR-1-CCND信号轴促进甲状腺癌细胞的生长、抑制癌细胞凋亡[20]。本文研究发现,用sh-HOTAIR沉默HOTAIR的表达后,U251细胞的增殖速度和增殖相关蛋白Ki67的表达水平明显降低,细胞凋亡水平明显升高;用miR-1 inhibitor进一步抑制miR-1表达后细胞增殖速度明显升高,细胞凋亡率明显降低,并且还能显著减弱sh-HOTAIR对细胞增殖及Ki67表达的调控作用。此外,sh-HOTAIR还能抑制Bcl-2表达,促进Bax表达。Bcl-2是一类抗凋亡蛋白,在多种肿瘤组织中呈高表达状态,能通过抑制Bax表达促进细胞存活[21]。结合实验结果表明sh-HOTAIR能通过上调miR-1的表达抑制U251细胞存活,提示HOTAIR能通过靶向抑制miR-1表达促进胶质瘤U251细胞生长。
癌细胞的侵袭和迁移是癌症转移的主要过程,血管周围侵袭性生长也是胶质瘤细胞增殖的主要方式,因此抑制胶质瘤细胞的侵袭和迁移是治疗胶质瘤的关键[22]。研究表明,HOTAIR在癌症中的高表达与癌症的转移密切相关,抑制HOTAIR表达有利于减缓癌症的发展[23]。研究发现,HOTAIR能促进卵巢癌SKOV3细胞侵袭和迁移[24],还能通过靶向下调miR-1在肝癌中的表达抑制肝癌细胞的生长、侵袭和迁移[9]。本文实验结果表明,沉默HOTAIR的表达能抑制U251细胞侵袭和迁移,miR-1 inhibitor能显著减弱sh-HOTAIR对U251细胞侵袭和迁移的抑制作用,表明sh-HOTAIR抑制胶质瘤U251细胞侵袭和迁移的作用与调控miR-1的表达有关。此外,sh-HOTAIR还能显著抑制MMP-2和MMP-9的表达,抑制miR-1表达能减弱sh-HOTAIR对MMP-2和MMP-9的调控作用。MMP-2和MMP-9是细胞侵袭和迁移的关键蛋白,能通过促进细胞外基质的降解增加癌细胞的运动能力,从而促进癌细胞的转移[25]。进一步表明HOTAIR能通过靶向抑制miR-1的表达促进胶质瘤U251细胞侵袭和迁移。
综上所述,sh-HOTAIR能抑制胶质瘤U251细胞增殖及Ki67表达、诱导细胞凋亡及Bax表达并降低Bcl-2的表达水平,miR-1inhibitor能显著降低sh-HOTAIR对细胞增殖、凋亡及相关蛋白表达的调控作用;同时,sh-HOTAIR还能减少U251细胞侵袭,抑制细胞迁移及MMP-2和MMP-9表达,miR-1inhibitor能显著减弱sh-HOTAIR对胶质瘤细胞侵袭和迁移的调控作用。提示HOTAIR能通过靶向miR-1促进胶质瘤U251细胞增殖、侵袭和迁移,为HOTAIR应用于临床胶质瘤的诊断及治疗提供了理论依据。
