术前白蛋白/球蛋白比值在肝癌射频消融病人预后中的价值
2019-04-26邓岩王帅喻晓霍成龙孙振纲
邓岩,王帅,喻晓,霍成龙,孙振纲
(华中科技大学同济医学院附属荆州医院肝胆外科,湖北 荆州 434020)
原发性肝癌是常见的恶性肿瘤之一,其发病率和病死率逐年增高,严重影响人类的身心健康[1-3]。对于早期肝癌而言,射频消融、肝切除术和肝移植是其主要治疗手段[4-5]。由于肝癌易侵犯血管,容易发生肝内、外转移,因此大多数肝癌病人就诊时已丧失了手术机会[6]。尽管肝癌诊断及治疗技术取得不断提高,但部分术后病人预后仍然较差,这就意味着手术并未为此类病人带来明显益处。因此,有待于发现更多预后指标预测肝癌术后死亡及复发风险,从而对病人进行有效分级指导术前临床决策。
现诸多研究表明,术前血清白蛋白/球蛋白比值(albumin/globulin ratio,AGR)作为独立预后指标广泛应用于肺癌、食管癌、胃癌、结直肠癌及泌尿系统恶性肿瘤的预后评估[7-13]。甚至有研究[14]表明,术前AGR与原发性肝癌肝切除术后病人的预后密切相关。然而,对于其对原发性肝癌射频消融术后病人预后的评估价值在国内外尚未见研究报道。因此,本研究对术前AGR与原发性肝癌射频消融术后病人临床病例特征及预后的关系进行了探讨。
资料与方法
一、临床资料
本次研究收集了华中科技大学同济医学院附属荆州医院肝胆外科在2011年12月至2018年9月间收治的首次行肝癌射频消融的192例原发性肝癌病例及随访资料。所有病人术前均经影像学或病理证实为原发性肝癌。完整的病例资料及随访资料从病例或电话随访中获得。纳入标准:①经影像学检查或者病理结果证实为原发性肝癌(肝细胞癌);②病人仅行肝癌射频消融治疗。排除标准:①既往有因肝癌行射频、肝切除或肝动脉化疗栓塞术病史;②伴有影响血清白蛋白或球蛋白含量水平疾病的病人,如白血病和自身免疫性疾病等;③伴有其他恶性肿瘤的病人;④死亡原因与原发肿瘤无关者。本研究得到华中科技大学同济医学院附属荆州医院伦理委员会批准。
二、资料收集
从病人资料中,收集了病人年龄、性别、饮酒吸烟史、高血压病史、糖尿病病史、术前实验室检查指标及术前术后影像学和病理学报告。术前影像学和病理学报告诊断病人是否合并肝硬化。肿瘤的大小及数量经影像学资料获得。病人所有实验室指标是病人第一次入院还没有接受任何治疗之前获得的; 而对于存在多次术前实验室指标者,最早的一次被采用。AGR=血清白蛋白/血清球蛋白。
三、随访
所有病人均常规进行随访直至2018年10月1日。随访结束时间为病人死亡或最后一次随访时间。所有病人术后第1年每3个月进行一次随访,第2年每4个月一次;第3年及以后每6个月一次。生存时间是指从术后第1天到随访结束时间。无瘤生存时间是指从术后第1天到经影像学或实验室检查发现肝内外出现新发病灶的时间。随访内容包括甲胎蛋白(AFP)和影像学结果。术后AFP大于20 μg/L或影像学发现新发病灶,视为病人肿瘤复发。为最大程度减少偏倚发生,两位临床医生分别独立完成随访及复核。
四、统计学方法
采用Kaplan-Meier(K-M)方法绘制各组的生存曲线,组间差异运用Log-rank检验方法进行检测。单因素和多因素比例风险模型用来检测各项指标预后意义。亚组分析用来排除混杂偏倚。所有统计分析均是基于软件SPSS 22.0 (SPSS Inc.,Chicago,IL,United States)完成,双尾P<0.05为差异有统计学意义。
结 果
一、ROC曲线分析
结果如图1所示,白蛋白最佳截止点为35.85[敏感性为69.3%,特异度为58.2%,曲线下面积为0.640,95%置信区间(CI):(0.556,0.724),P=0.002];球蛋白最佳截止点为33.30[敏感性为45.5%,特异度为80.3%,曲线下面积为0.644,95%CI:(0.555,0.732),P=0.002];AGR最佳截止点为1.27[敏感性为59.1%,特异度为76.4%,曲线下面积为0.682,95%CI:(0.600,0.764),P<0.001]。根据AGR最佳截止点,所有病人被分为高AGR组和低AGR组。
二、AGR与病人临床病理特征的关系
192例病人的临床病理资料如表1所示,其中男性144例,女性48例;病人中位数年龄为55岁(29~83岁)。伴高血压疾病33例,伴糖尿病21例。53例有吸烟史,40例有饮酒史。术前123例病人存在肝硬化;乙型肝炎143例;丙型肝炎23例。影像学检查证实:19例病人患有癌栓且56例病人肿瘤包膜不完整。本次随访期间,62例病人死亡,术后最长生存时间为77个月;而70例病人出现肿瘤复发。如图2A所示,病人1年、3年和5年生存率分别为78.13%、 61.97%和39.48%。如图2B所示,病人1年、3年和5年无瘤生存率分别为76.04%、55.21%和33.41%。

图1 白蛋白、球蛋白及AGR的ROC曲线
两组病人临床病理资料比较见表1。老年病人出现在低AGR组的频率更高。术前AGR低的病人更容易出现肝硬化和腹水。而两组病人的肿瘤性质和病人术前性别构成、吸烟饮酒史、伴随疾病及乙型肝炎和丙型肝炎病史均未见统计学差异。
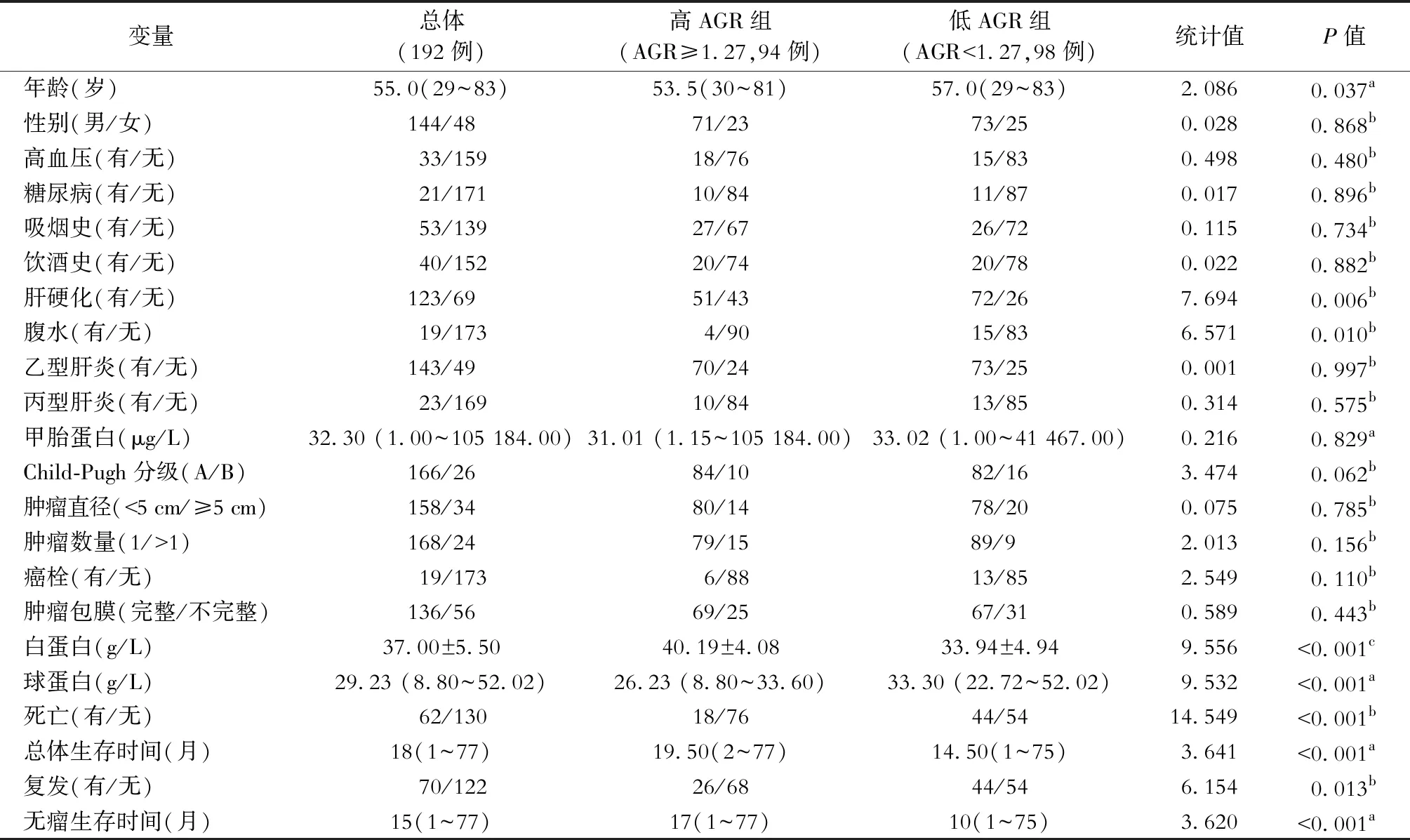
表1 AGR与病人临床病理参数的关系


图2 所有病人总体生存(A)和无瘤生存(B)的生存曲线
三、总体生存时间单因素和多因素分析
单因素分析示:腹水、肿瘤直径、癌栓、白蛋白、球蛋白及AGR可能是影响病人术后总体生存时间的预测指标(表 2)。K-M生存曲线分析揭示术前AGR高的病人总体生存时间明显长于AGR低的病人(图3A),差异具有统计学意义。多因素分析显示:术前腹水、肿瘤直径、癌栓、白蛋白及AGR是影响病人术后总体生存时间的独立危险因素。
四、无瘤生存时间单因素和多因素分析
单因素COX回归比例风险模型筛选出肝硬化、乙型肝炎、AFP水平、肿瘤大小、癌栓、血清白蛋白水平及AGR是影响病人术后无瘤生存时间的危险因素。如图3B所示:病人术前AGR越低,病人术后无瘤生存时间越短。进一步通过多因素COX回归比例风险模型得出肝硬化、乙型肝炎、癌栓及AGR是影响病人术后无瘤生存时间的独立危险因素(表3)。
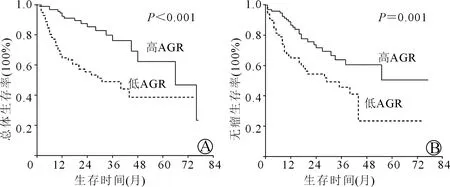
图3 高、低AGR组病人的总体生存(A)和无瘤生存(B)的生存曲线
五、亚组分析
如图4A所示,肿瘤直径被证实是影响肝癌病人术后总体生存时间的独立危险因素。因此,我们探讨术前AGR对不同大小肿瘤病人的预测意义,通过亚组分析发现:AGR对大小肝癌病人术后总体生存时间均产生明显影响(图4B~C)。如图4D所示,肝硬化一直被认为是影响病人肝癌术后复发的独立危险因素,进而亚组分析探讨AGR对是否伴有肝硬化术后病人无瘤生存时间的影响。分析显示术前AGR主要影响无肝硬化肝癌术后病人无瘤生存时间,但对于伴随肝硬化的病人,尽管AGR越高的病人术后无瘤生存时间明显较长,但差异尚无统计学意义(图4E~F)。

表2 病人的总体生存时间单因素和多因素分析
注:a调整腹水、肿瘤直径和癌栓等协变量

表3 病人的无瘤生存时间单因素和多因素分析
注:a调整肝硬化、乙型肝炎、肿瘤直径和癌栓等协变量

图4 不同肿瘤直径病人的生存曲线(A);高、低AGR病人在不同直径大小肿瘤中的生存曲线(B、C);肝硬化有无病人的无瘤生存时间的生存曲线 (D);高、低AGR病人在不伴肝硬化病人中的无瘤生存时间曲线(E);高、低AGR病人在伴肝硬化病人中的无瘤生存时间曲线(F)
讨 论
原发性肝癌是常见的恶性肿瘤之一,早期手术无疑是其主要治疗措施,其主要包括肝移植、肝切除及肝癌射频消融术等。目前对于早期原发性肝癌而言,肝切除和肝移植无疑是最好的治疗手段。随着医疗技术的不断提高,其生存率也随之提高。诸多研究表明:对于早期肝癌而言,肝切除或肝移植术后病人生存时间明显高于肝癌射频消融的病人。本队列术后病人1年、3年和5年生存率分别为78.13%、61.97%和39.48%,明显低于肝切除及肝移植术后病人的总体生存时间,也更好地论证了这一结论。因此对于肝癌病人,能行手术治疗者应尽量选择肝切除或肝移植治疗。然而对于拒绝肝切除和肝移植手术治疗或难以行该治疗的病人而言,射频消融不失为一种治疗手段,术后可配合多种综合治疗。一些肝癌病人即使行手术后,其预后仍然较差[15]。尽管诸多研究表明肿瘤TNM分期、血清AFP指标、分子基因技术和有创性检查能较好地评估病人预后,但其也存在诸多缺陷和不足。第一,原发性肝癌病人约20%~80%病人术前血清AFP指标并不高[16];第二,TNM分期仅仅只关注了肿瘤本身,而忽略了机体本身的功能状态且具有一定的滞后性[17];第三,一些分子及基因技术尽管能很好地预测病人预后,但其个体差异明显,难以推广[18];第四,术前有创性操作对预测病人预后具有较大作用,但其临床价值在临床实践操作中却受限。因此,探究一个简单、客观且效应显著的术前预后指标具有非常重要的临床价值和意义。
目前诸多研究表明系统性炎症反应在恶性肿瘤的发生、发展、增殖及转移中发挥重要作用,甚至是影响恶性肿瘤病人预后的独立危险因素[19-20]。基于此理论基础上的预后营养指数[21]、中性粒细胞淋巴细胞比[22]、淋巴细胞单核细胞比[23]及血小板淋巴细胞比[24]等系统性炎症反应指标被诸多研究证实是影响恶性肿瘤病人术后长期生存的独立危险因素。AGR作为一种系统性炎症指标也被证实是影响多种恶性肿瘤病人术后长期生存的独立危险因素。此外,白清白蛋白主要由肝脏产生,能较好地反应病人肝功能变化和病人营养状况[25-27];而球蛋白作为各项炎性蛋白的总和能很好反应机体炎症状况[9]。因此,基于此基础上的AGR可能是影响肝癌病人预后的独立危险因素。
与诸多学者既往研究结果相同,本研究发现在行肝癌射频消融的原发性肝癌病人中,高AGR组较低AGR组术后长期预后好。单因素和多因素分析结果显示术前AGR是影响病人预后的独立危险因素。亚组分析发现AGR对大小肝癌病人术后总体生存时间均产生明显影响。虽然AGR对肿瘤发生发展及对病人预后影响的具体机制还未得到完全阐明,但可从血清白蛋白和球蛋白本身开始探讨。首先,血清白蛋白能发挥抗氧化作用,从而促进机体抵抗外界生物化学性刺激,维持机体细胞生长和分裂的稳定[28-30]。其次,血清白蛋白水平能很好地反应机体免疫和营养状况。最后,球蛋白是由各种炎性蛋白组成,能较好地反应机体炎症状况。
越来越多研究表明机体炎症反应与肿瘤的发生、发展及转移密切相关[31-33]。对于绝大多数原发性肝癌而言,乙型肝炎病毒在其进展中发挥着重要作用,这可能与乙型肝炎病毒介导机体炎症反应密切相关[2]。球蛋白包含炎性蛋白,能很好地反应原发性肝癌病人机体炎症状况。AGR联合了白蛋白和球蛋白,不仅能反映机体免疫营养状况也兼顾体现机体的炎症状况,故而更好评估肝癌病人的临床预后。此外,AGR作为一种比值,它不受机体失水和水肿的影响,故而指标更为客观。当探讨术前AGR与病人临床病理资料关系时,我们发现术前低AGR与病人发病年龄呈正相关,这可能是由于老年病人身体机能及食欲减退导致免疫和营养状况变差所致[34-35]。此外,我们发现术前存在肝硬化和腹水的病人术前AGR更低,这可能是由于术前合并肝硬化和腹水的病人其肝脏合成白蛋白能力差、机体免疫力和营养状况不足所致[36-37]。由于AGR这一指标简单、客观、容易获得且非有创等特点,其可常规作为术前评估的指标。
尽管本研究发现术前AGR是影响原发性肝癌射频消融病人临床预后的独立危险因素,但是难免存在一定的缺陷和不足。首先,本研究是回顾性研究,一些病人临床资料及随访资料缺失可能为本研究结果带来了一定的负面影响;其次,本数据来源于单中心,纳入的病例数相对较少,故而影响了本研究结果的普遍代表性。因此,还有待于进一步的多中心大样本临床研究证实我们的结论。
