促肾上腺皮质素释放因子1在阿尔茨海默病发生和治疗中的作用
2019-04-26张紫薇刘静曾燕
张紫薇 刘静 曾燕
(武汉科技大学医学院脑与认知研究所,湖北 武汉 430065)
至今尚无较好的治疗方法能够减缓或阻止阿尔茨海默病(AD)发生发展。目前AD的治疗药物,如乙酰胆碱酯酶抑制剂和N-甲基-D-门冬氨酸(NMDA)受体拮抗剂美金刚,只能控制患者的部分行为学症状,对阻止疾病的发展并无多大帮助。
多种因素(包括生物和社会心理因素)都被认为与AD发病有关〔1,2〕。越来越多的证据表明,伴随着年龄增长,因躯体疾病、配偶和亲朋的去世等带来的心理应激和压力与AD发病关系密切〔3,4〕。应激在生物学上被定义为各种生理学改变,包括内环境失稳态及下丘脑-垂体-肾上腺(HPA)轴的激活。HPA轴主要维持内稳态和应激反应的应答,在应激条件下,下丘脑释放促肾上腺皮质激素释放因子(CRF),增加HPA轴的活性,CRF是HPA轴的一个关键性调节物质,也是中枢神经系统内直接的神经调节物质〔5,6〕。CRF协调应激反应,认为过量的CRF有助于这些疾病的病理生理学〔7〕,并且发现,CRF1受体存在性别偏向,因此三磷酸鸟苷(GTP)结合蛋白糖皮质激素(GCs)在女性中的耦联程度更高〔7〕。研究推测CRF1受体拮抗剂会减缓β-淀粉样蛋白(Aβ)斑块沉积速度,改善AD模型小鼠的行为学表现〔8〕。面对AD发生与发展,既然尝试干扰遗传倾向的道路行不通,那么制定一个策略来减轻环境因素(即心理社会应激)的负面影响,推迟发病或减缓神经病理恶化和认知能力下降是可行的。本文综述了应激、HPA轴和CRF信号转导途径在AD发生发展过程中的作用,探讨CRF受体拮抗剂作为治疗AD新药的可能性。
1 心理社会应激被认为是影响AD发病的一个关键环境因素
AD的神经病理学改变包括神经细胞外Aβ的沉积、神经细胞内神经纤维缠结及贯穿于皮质和海马的广泛神经元病变〔9,10〕。尽管已知与家族遗传性AD发病有关的3个突变基因:淀粉样前蛋白(APP)、早老蛋白(PS)和PS2,然而,非遗传性散发性AD的病例数占AD总病例数的95%以上〔11〕,但其发病原因未知。研究者普遍认为散发AD是由多基因改变的遗传因素和环境因素的复杂交互作用导致的〔12〕。
在日常生活中,心理压力是一种常见现象,压力调节对大脑功能是有益还是有害,取决于应激源的类型、暴露时间和发展阶段〔13〕。应激激素皮质醇与压力的关系最密切,正常水平的应激激素有益于大脑,并帮助人们保持头脑清醒,帮助神经细胞存活,但患上焦虑和抑郁疾病时,患者体内应激激素则会达到很高水平,给神经元带来损伤〔3,4〕。越来越多的研究表明,心理压力源与AD的发病和发展联系紧密,个体中有心理困扰的人发展AD的机会是非困扰者的2倍〔3,4〕,因此,心理社会应激是影响AD发病的一个关键环境因素〔4,14,15〕。机体处于应激状态时,下丘脑促进CRF分泌,通过HPA轴激活肾上腺皮质功能,使血浆皮质醇激素水平升高。研究表明,血浆中的皮质醇水平升高与AD患者认知能力的下降相关〔16~19〕。
学者们从多个角度研究了压力应激引起的HPA轴改变与AD发病和进展之间的关系〔19~22〕,特别研究了AD患者压力与认知功能之间的关系,并在AD模型Tg2576小鼠上探讨了压力对脑内斑块沉积和行为障碍的影响。研究发现,在AD患者中,血浆皮质醇水平越高,认知能力下降越快〔16~19〕,在Tg2576小鼠中,长期孤独会加快Aβ斑块的沉积和记忆相关的行为障碍〔20~23〕。其他团队在小鼠模型中也发现行为压力加速Aβ形成〔24,25〕,使记忆力下降加快。
2 应激和HPA轴与AD的发生发展
应激状态下或压力上升时,会增加HPA轴活性,其中涉及GCs释放,即人类的皮质醇和啮齿动物的皮质甾酮,这在很大程度上是由CRF控制的。正常情况下,负反馈回路能抑制CRF进一步合成和释放,而HPA轴调节发生异常时,则会引起负反馈功能障碍,过度增加血浆GCs的合成释放,最后造成中枢神经元损伤(图1)。在AD患者中发现HPA轴活性增高使GCs水平升高,血浆皮质醇水平增加〔26~28〕,导致海马神经元损伤或死亡,表明GCs对AD有负性作用。并且,AD患者大脑的免疫反应性细胞中CRF显著减少〔29,30〕,突触后CRF受体密度增加〔31,32〕。另外,CRF分泌亢进也会导致某些精神障碍,如抑郁、焦虑和神经性厌食;CRF分泌亢进也与其他神经退行性疾病有关,如帕金森病(PD)和亨廷顿病(HD)〔33〕。
磁共振成像研究表明,HPA轴变化与AD患者海马萎缩相关〔34〕。在豚尾猴(灵长类动物)的研究中,长期使用GCs后检测到胰岛素降解酶mRNA减少和Aβ1~42水平增加〔35〕。然而,很少有文献直接证明压力是否可以加速个体AD的发病过程。研究表明,行为压力因素是通过激活CRF1而增加Aβ的基础水平,并相应地增强神经元活性〔20,22〕。当用地塞米松治疗APP、PS1 Mapt (3xTg-AD)转基因小鼠时,引起大脑内APP和Aβ水平增高,APP中β-位点-淀粉样前体蛋白剪切酶(BACE)与β-C末端片段(CTF)也会相应增加〔36〕。
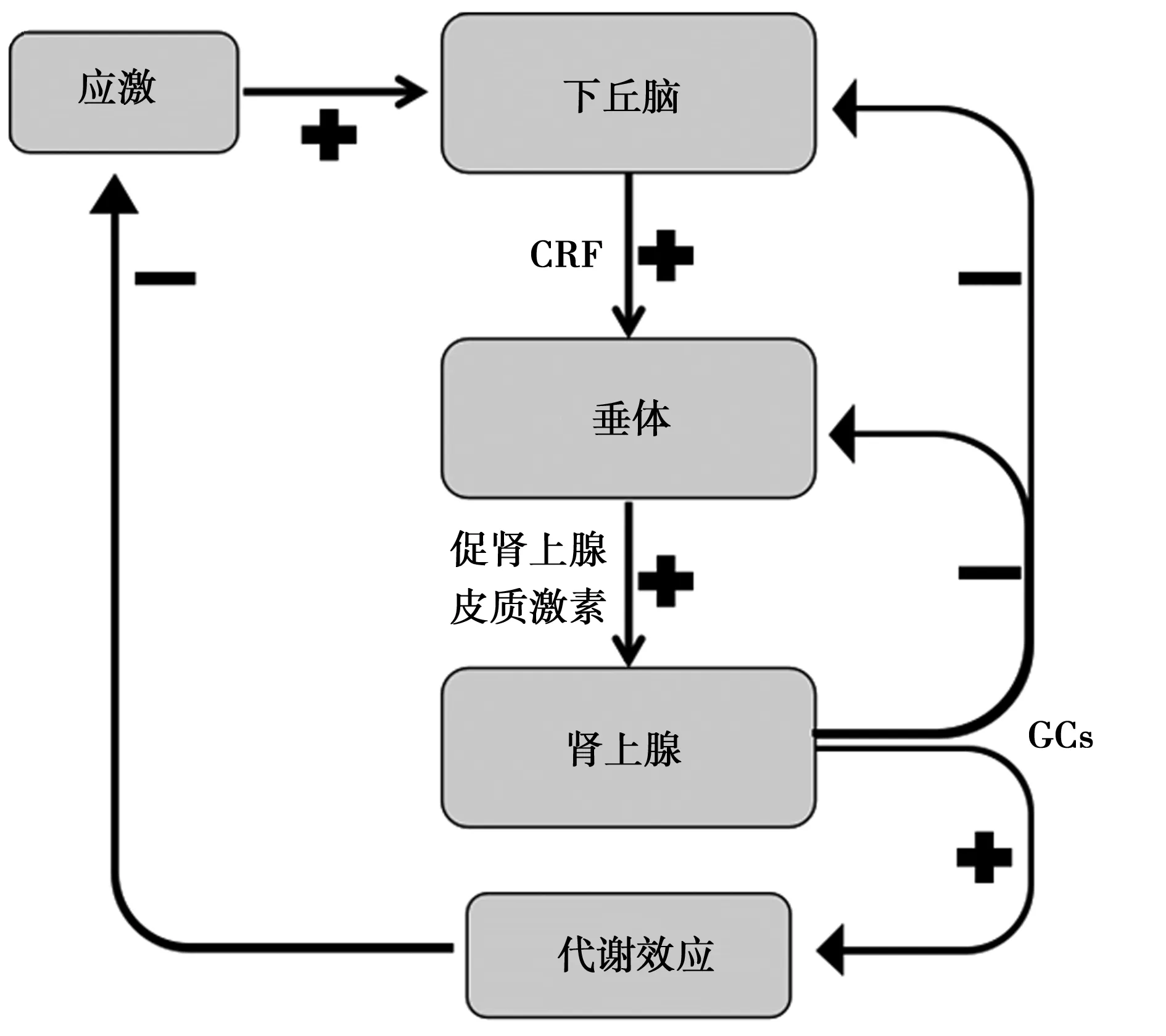
图1 HPA轴负反馈调节通路
3 CRF信号转导途径与AD
CRF与其受体广泛调节皮质和海马神经元的活动〔6,37,38〕,是重要的HPA调节因子,也是中枢神经系统内直接的神经调质〔5,6〕,CRF功能失调导致各种神经精神疾病〔33〕。压力不仅会通过CRF活动增加外部GCs水平,而且刺激外侧下丘脑区域、前额叶皮质、海马和杏仁核区域的CRF释放〔39〕,以应对行为压力。尽管CRF的作用与其受体已经证明与AD相关〔29~32〕,但CRF与其受体是否与AD的认知功能下降直接相关尚不清楚。
CRF的作用和对细胞的影响通过激活G蛋白耦联受体CRF1和CRF2实现〔40〕,CRF受体激活后进一步激活下游磷脂酶C途径(PLC)和蛋白激酶(PK)C途径,也激活环腺苷酸(cAMP)-PKA信号级联反应〔39,41〕。研究显示,CRF1受体激活后会刺激cAMP活性,增加细胞内cAMP水平,在前额叶皮质中通过增加儿茶酚的释放,加强前额皮质神经元的活动,反过来增加cAMP和PKC的信号传导。如减少前额叶皮质神经元活动,则可能损伤工作记忆〔42,43〕。此外,增加CRF受体活性区域的结合可提高PKC活性,影响神经元的可塑性,进一步暗示CRF在神经元的结构和功能中产生长时间的调节作用。研究显示,PKC在AD的病理学过程中扮演着一个重要的角色〔44~48〕,在一个与AD神经病理高度相关的脑皮层区域〔37,49〕,高CRF水平会导致腺苷酸环化酶(AC) 激活,增加PKC活性可以刺激Aβ的产生和tau蛋白的磷酸化,然而是否cAMP-PKA 或PLC/PKC信号途径可以影响CRF受体的活性,在AD老鼠模型中还尚不明确。
4 CRF受体拮抗剂
CRF及其受体与一些神经精神疾病、自身免疫病和慢性炎症有关。自从CRF多肽被分离出来后,发展特异性CRF受体拮抗剂作为生理研究的工具取得了很大进步,CRF1受体拮抗剂在神经退行性疾病的潜在治疗价值正慢慢被认可,CRF作为治疗AD的一种可能性方案成为有前景的候选药物〔19,50,51〕。这些候选药物包括肽拮抗剂、信号传导选择性拮抗剂及非肽类拮抗剂,主要作用于CRF1受体。早期的临床研究证明CRF1受体拮抗剂对抑郁症和焦虑有效〔52〕,如,R121919(一种非肽拮抗剂),表现出良好的整体安全性,能调节睡眠,减少重度抑郁患者肠道易激综合征和社会焦虑。因此许多CRF1拮抗剂具有以前未被发现的抗抑郁和焦虑作用,在重度抑郁患者身上的效果正在被证实。几个其他候选药物也正在进行早期阶段的实验〔53〕,结果证明CRF1拮抗剂在治疗抑郁、焦虑和肠道易激综合征上有潜力,且可能为成瘾性障碍的临床评估做铺垫。然而,CRF1拮抗剂对神经退行性疾病如AD的治疗潜力才刚刚被认识〔20,50,51〕。
研究发现处于隔离应激压力下的Tg2576小鼠脑组织的CRF1表达与Aβ水平增加具有显著相关性〔22〕,在Tg2576小鼠中,CRF拮抗剂逆转行为压力诱导的Aβ斑块沉积〔20,50〕。另一个研究证明了CRF结合蛋白抑制剂使老年大鼠的认知能力被提高〔48〕。总之,CRF1拮抗剂可能通过促进神经细胞的轴突和树突发育,增强突触的功能连接,恢复脑神经原有的各项功能,达到减轻AD症状的目的〔22〕。实验室也证明,CRF1拮抗剂可以减慢Tg2576小鼠的类AD过程,并且c-AMP/PKA信号传导途径可能参与这种作用〔8〕。AD患者存在HPA轴的功能亢进,使CRF受体功能亢进,进一步导致海马神经元损伤或死亡。研究应激状态HPA轴的活动有利于深入理解AD,通过影响HPA轴活动来调节各种神经递质,增强大脑反应与记忆能力,进而延缓AD的发生与发展是可行的。
