虾青素对碘海醇诱导的大鼠肾小管上皮细胞凋亡的影响
2019-04-26徐洋李文华郑迪张权
徐洋 李文华 郑迪 张权
(1东南大学附属徐州市中心医院心内科,江苏 徐州 221000;徐州医科大学 2心血管病研究所;3附属医院心血管内科)
随着冠心病的诊断、介入和放射医学诊疗技术的发展,对比剂的使用日益增多。对比剂急性肾损伤(CI-AKI)逐渐成为医源性肾衰竭的常见原因之一〔1〕。同时,CI-AKI、支架内血栓和支架术后再狭窄是患者行经皮冠状动脉介入治疗(PCI)手术后的3大并发症〔2〕。CI-AKI的发病机制尚未完全明确,对比剂的直接肾小管细胞毒性损伤、对比剂引起氧自由基损伤和肾脏血流动力学变化是其重要机制〔3,4〕。虾青素(AST)是一种类胡萝卜素,有抗炎、抗氧化、调节糖脂代谢、减轻肝肾损伤等多种作用〔5〕。目前CI-AKI的研究多集中在动物水平和临床研究,本实验旨在体外建立CI-AKI模型,研究细胞凋亡机制在大鼠CI-AKI中的作用及AST对其凋亡的保护,并探讨其可能的机制。
1 材料与方法
1.1主要试剂和仪器 AST(Sigma,纯度>99%),碘海醇(I,扬子江药业有限公司),胎牛血清(四季青,中国),DMEM/F12(Hyclone,美国),烟酰胺(大连美仑生物技术有限公司,中国),二喹啉甲酸(BCA)蛋白试剂盒,膜联蛋白(Annexin)V-FITC/碘化丙啶(PI)细胞凋亡试剂盒(南京凯基生物科技发展有限公司),线粒体膜电位检测试剂盒(JC-1,江苏碧云天生物技术公司),β-actin抗体(美国Proteintech公司),沉默信息调节因子2相关酶(SIRT)1抗体(Absin生物技术有限公司),P53抗体(Abclonal生物技术有限公司),Bax抗体(美国Proteintech公司),Bcl-2抗体(美国SantaCruz公司),CO2培养箱(Heraeus公司),三气培养箱(Thermo 公司),酶标仪(美国伯乐公司),蛋白电泳及电转装置(Bio-Rad 公司)。
1.2细胞培养与分组 大鼠肾小管上皮细胞株(NRK-52E)在含10%胎牛血清、0.1%青霉素和链霉素的DMEM/F12培养基中培养,当细胞长至80%左右时用0.25%胰蛋白酶消化传代。传代后随机分组:空白对照(Control)组、溶剂对照(DMSO)组(0.1% DMSO)、I组(50 g I/L)、AST预处理(AST+I)组(50 g I/L I+20 μmol/L AST)、AST预处理+SIRT1抑制剂烟酰胺(AST+I+NA)组(50 g I/L I+20 μmol/L AST+20 mmol/L NA),I+SIRT1抑制剂(I+NA)组(50 g I/L I+20 mmol/L NA)。
1.34,6-二脒基-2-苯基吲哚(DAPI)荧光染色观察细胞核形态 将生长于24孔培养板中的大鼠肾小管上皮细胞,用磷酸盐缓冲液(PBS)清洗3次,4%多聚甲醛〔溶于0.1 mol/L磷酸缓冲液(PB),pH7.4〕室温固定15 min后,再次用PBS清洗3次×5 min,避光条件下加入3 ml DAPI(用含0.2%Triton的PBS溶解)染色5~10 min,PBS冲洗3遍×5 min。在Olympus荧光显微镜上,以400 nm为激发光,455 nm发射光观察。
1.4Annexin V-FITC/PI双染流式细胞仪检测细胞凋亡 用2 ml PBS轻轻润洗培养皿中的细胞,去除PBS。将细胞重新悬浮于之前的培养基中或预冷的1×结合缓冲液中使其细胞浓度为1×106细胞/ml。取500 μl细胞悬液(5×105个细胞)至离心管中,离心1 000 r/min×5 min,去上清,加入500 μl PBS洗涤细胞,离心,去上清。再加入500 μl的1×结合缓冲液洗涤细胞,离心,去上清;加入100 μl 1×结合缓冲液重悬细胞后加入5 μl Annexin V-APC室温避光反应15 min。加入500 μl的1×结合缓冲液洗涤细胞,离心,去上清;加入200 μl 1×结合缓冲液重悬细胞后加入5 μl PI。将样品在1 h内用流式细胞仪检测分析。
1.5细胞凋亡检测试 弃去6孔板中的培养基,用PBS液洗涤3次,加入1 ml JC-1染色工作液,充分混匀,细胞培养箱中37℃孵育20 min。在孵育期间,按照每1 ml JC-1染色缓冲液(5×)加入4 ml蒸馏水的比例,配制适量的 JC-1染色缓冲液(1×),并放置于冰浴。37℃孵育结束后,吸除上清,用 JC-1染色缓冲液(1×)洗涤2次,加入2 ml细胞培养液,在荧光显微镜下观察。检测 JC-1单体时激发光设置为490 nm,发射光设置为530 nm;检测 JC-1聚合物时激发光设置为525 nm,发射光设置为590 nm。
1.6Western印迹检测蛋白表达水平 提取细胞总蛋白,BCA法测定蛋白浓度后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜后室温下封闭,用特异性抗体进行免疫杂交检测,β-actin作为内参,化学发光剂显色,最后对目的条带进行扫描密度分析。每组重复3次。
1.7统计学方法 采用Graphpad Prism5.0 软件进行方差分析、q检验。
2 结 果
2.1各组细胞凋亡的形态学变化 Control组与DMSO组,细胞核染色均一,未见凋亡细胞。I组可见细胞核固缩、核深染,固缩的核呈高亮状态,部分细胞可见核裂解。与I组相比,AST+I组核固缩、核深染状态改善,凋亡细胞减少。AST+I+NA组与AST+I组相比,固缩高亮的核增多,凋亡细胞增加。与AST+I+NA组相比,I+NA组凋亡小体进一步增加,细胞损伤加重。见图1。
2.2各组细胞凋亡率比较 与Control组相比,DMSO组细胞凋亡率差异无统计学意义(P>0.05);I组细胞凋亡率显著升高(P<0.05)。AST+I组细胞凋亡率较I组显著降低(P<0.05)。与AST+I组相比,AST+I+NA组细胞凋亡率明显升高(P<0.05)。与AST+I+NA比较,I+NA组差异有统计学意义(P<0.05),I组无显著差异(P>0.05)。见表1。
2.3各组JC-1荧光强度比较 DMSO组和Control组JC-1荧光强度差异无统计学意义(P>0.05),I组较Control组JC-1荧光强度显著下降(P<0.05)。AST+I组JC-1荧光强度较 I组显著升高(P<0.05)。与AST+I+NA组相比,AST+I组荧光强度显著升高(P<0.05),I+NA组JC-1荧光强度显著降低(P<0.05)。AST+I+NA组与 I组JC-1荧光强度差异无统计学意义(P>0.05)。见表1,图2。

图1 各组细胞凋亡的形态学变化(×200)
2.4各组肾小管上皮细胞中蛋白表达变化 与Control组相比,DMSO组蛋白表达无差异(P>0.05),I组SIRT1、Bcl-2蛋白表达显著减少,P53、Bax表达均显著增加(P<0.05)。AST+I组细胞SIRT1、Bcl-2蛋白表达较I组明显增加,P53、Bax蛋白表达显著减少(P<0.05)。AST+I+NA组与AST+I组相比,SIRT1、Bcl-2蛋白含量明显减少,P53、Bax表达均明显增加(P<0.05)。与AST+I+NA组相比,I+NA组SIRT1、Bcl-2蛋白表达显著减少,Bax、P53蛋白的表达显著增加(P<0.05)。见表1,图3。
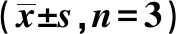
表1 各组细胞凋亡率和JC-1荧光强度及SIRT1、P53、Bax、Bcl-2蛋白表达比较
与Control组比较:1)P<0.05;与I组比较:2)P<0.05;与AST+I组比较:3)P<0.05;与AST+I+NA组比较:4)P<0.05
图2 各组JC-1荧光强度比较(×200)
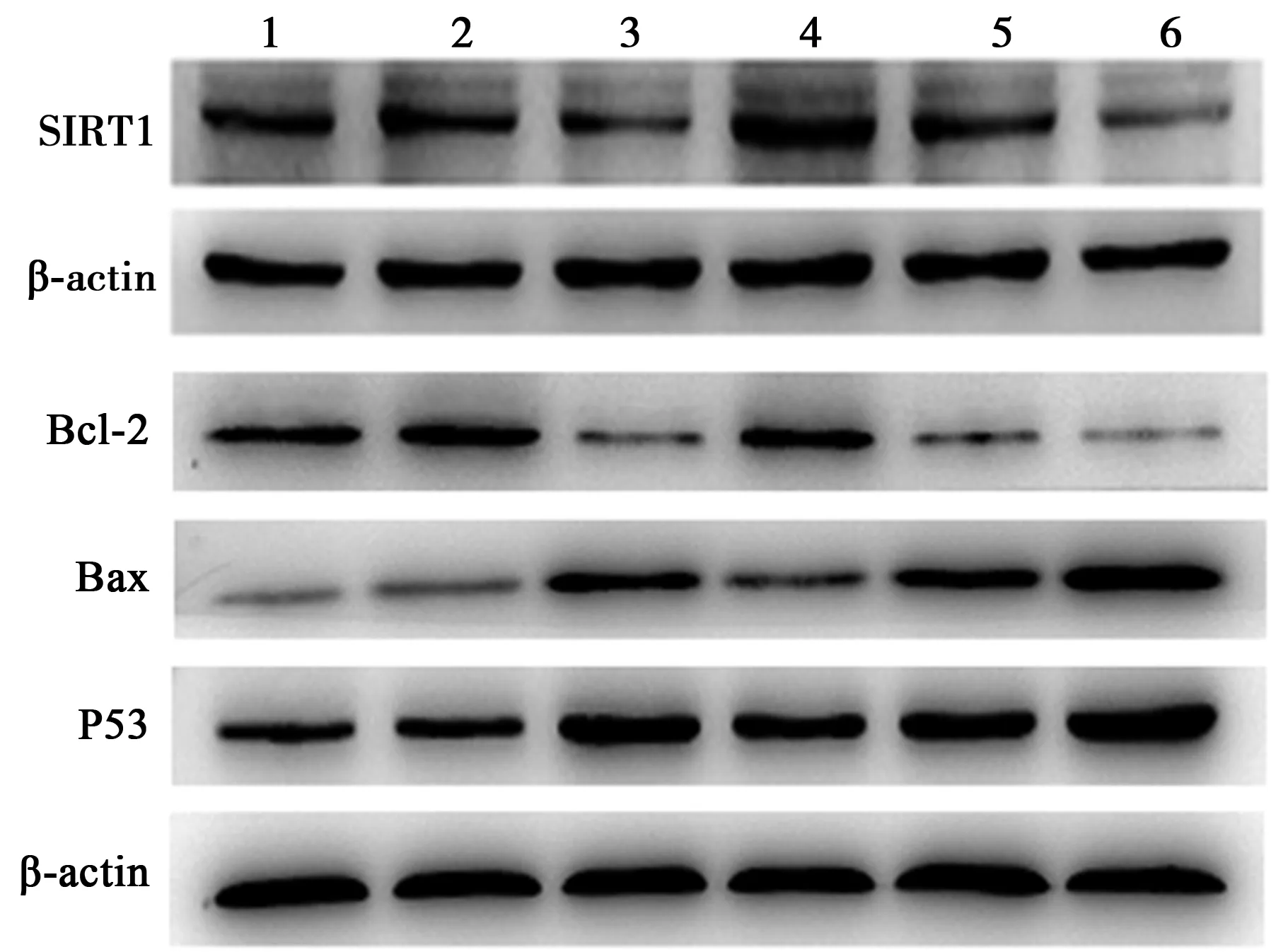
1~6:Control组、DMSO组、I组、AST+I组、AST+I+NA组、I+NA组图3 Western印迹检测各组SIRT1、P53、Bax、Bcl-2蛋白表达
3 讨 论
AST是一种天然存在的红色类胡萝卜素衍生物,广泛存在于多种动物及植物中。天然AST存在多种潜能,如抗氧化、抗炎、免疫调节、抑制肿瘤生长、抗衰老、预防心脑血管疾病等〔6〕。Guo等〔7〕研究表明,AST通过调节线粒体途径促凋亡蛋白而减少肾小管细胞凋亡改善严重烧伤大鼠的急性肾损伤。本实验结果证实:AST预处理可明显减轻对比剂诱导的细胞凋亡,其肾脏保护作用与激活SIRT1,稳定线粒体膜电位,并调节凋亡相关蛋白P53、Bax、Bcl-2表达密切相关。
细胞凋亡是指细胞接受刺激信号并受基因调控的一种自主性、程序性死亡〔8〕。Bcl-2家族是线粒体途径细胞凋亡的关键,以Bcl-2为代表的抗凋亡蛋白和以Bax为代表的促凋亡蛋白可通过激活一系列下游靶分子,调节线粒体膜的通透性和完整性,进而调节线粒体促凋亡因子的释放介导细胞凋亡〔9〕。研究发现,P53可调节Bcl-2家族进而调节细胞凋亡〔10〕。P53的靶基因编码多种促凋亡蛋白,如P53诱导基因蛋白(PIGs)、凋亡蛋白1(Fas)、凋亡酶激活因子(Apaf)-1、Bax、P53上调凋亡调节因子(PUMA)等,P53作为一种转录因子调控下游凋亡相关蛋白的表达,促使细胞凋亡发生〔11〕。P53也能直接结合Bak并将其激活,诱导Bak寡聚化,继而诱导细胞色素(Cyt)c释放最终引起细胞凋亡〔12,13〕。
SIRT1是烟酰胺腺嘌呤二核苷酸(NAD+)依赖的第三类组蛋白去乙酰化酶〔14〕。SIRT1的下游效应分子包括组蛋白、P53、核因子(NF)-κB、过氧化物酶增殖物激活受体(PPAR)γ及辅助激活因子(PGC-1α)、叉头蛋白转录因子(FOXOs)、缺氧诱导因子(HIF)1等,通过将它们去乙酰化达到调节糖脂代谢、抑制氧化应激和炎症、减少凋亡、减轻衰老等生物学效应,在肿瘤、糖脂代谢稳态调节和心血管等多种疾病中发挥重要作用〔15,16〕。本实验结果说明AST是通过激活SIRT1信号保护NRK-52E细胞,且SIRT1是在这些分子的上游发挥作用的。此外,与AST+I+NA组相比,I+NA组缺少了AST的保护,SIRT1、Bcl-2蛋白表达减少, P53、Bax表达增多,结果再次证实了AST的保护作用。
综上所述,AST可以改善CI-AKI,其主要机制是通过激活SIRT1通路,调节线粒体膜电位,下调促凋亡蛋白P53、Bax表达,上调抗凋亡蛋白Bcl-2表达发挥抗细胞凋亡作用。AST为对比剂肾病(CIN)的防治提供了新的选择,但AST产生肾保护性作用的具体机制尚未完全阐明,仍需进一步研究。
