甲氨蝶呤调控鼻咽癌细胞增殖、凋亡和分化的机制
2019-04-26王慧敏李静波王俊杰陈文明蔡纪堂
王慧敏 李静波 王俊杰 陈文明 蔡纪堂
(河南省中医院耳鼻喉科,河南 郑州 450000)
鼻咽癌(NPC)是发生于鼻咽腔的恶性肿瘤,其发病率占耳鼻咽喉恶性肿瘤的首位,是我国高发恶性肿瘤之一〔1〕。其发病原因目前尚不十分明确,可能与遗传、环境、病毒感染等因素有关。目前治疗NPC的主要方式是放射治疗,但对中晚期患者治疗效果并不理想,且放疗的毒副作用较大〔2,3〕。因此,寻找新的治疗方式成为迫切需要解决的问题。目前通过分子靶向治疗成为治疗肿瘤的研究热点,探索NPC增殖、凋亡、分化等生物学特性的可能机制,寻找潜在的分子作用靶点,对NPC的治疗和预后具有重要意义〔4〕。甲氨蝶呤(MTX)是一种叶酸类抗肿瘤药物,在临床上主要用于乳腺癌、类风湿关节炎、绒毛膜上皮癌、头颈部肿瘤、肺癌等多种肿瘤疾病〔5,6〕。MTX发挥作用的主要方式是通过抑制二氢叶酸还原酶达到阻碍癌细胞DNA的合成,抑制肿瘤细胞的增殖和生长〔7〕。研究发现,MTX对类风湿关节炎发病过程中的炎性因子白细胞介素(IL)-1β和肿瘤坏死因子(TNF)-α具有抑制作用,其作用机制可能是通过与抑制细胞外调节蛋白激酶(ERK)蛋白磷酸化来抑制丝裂原活化蛋白激酶(MAPK)信号通路的激活起到抗炎作用〔8〕。此外,MTX还可通过调控Janus激酶(JAK)-信号转录子和转录激活子(STAT)信号通路、核转录因子(NF)-κB信号通路参与类风湿关节炎发生、发展的过程〔9〕。相关研究发现,Notch信号通路参与NPC细胞的增殖、分化、凋亡、迁移和侵袭等生物学过程〔10〕。本实验观察MTX对NPC细胞的增殖、凋亡和分化的影响,探讨其作用机制。
1 材料与方法
1.1材料 人低分化NPC细胞株CNE-2,人鼻咽部正常上皮细胞株NP69均由河南省中医院中心实验室冻存。MTX(江苏恒瑞医药股份有限公司);胎牛血清、RPMI1640培养基、胰蛋白酶(美国Invitrogen公司);细胞计数试剂盒(CCK)-8试剂盒(碧云天生物技术研究所);Annexin V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)凋亡试剂盒(上海古朵生物科技有限公司);RNA提取试剂盒(美国Promega公司);逆转录试剂盒、SYBR Green Gene Expression Assay(大连宝生物工程有限公司);Cleaved Caspase-3抗体、p53抗体、辣根过氧化物标记的抗体(美国Abcam公司);Notch1、Notch2蛋白酶联免疫吸附试验(ELISA)试剂盒(上海酶联生物科技有限公司)。
1.2细胞培养和MTX处理 CNE-2细胞常规复苏后,接种于体积分数为0.1的胎牛血清的RPMI1640培养基中(含100 U/ml青霉素、100 μg/ml链霉素),NP69细胞复苏后接种于Defined Keratinocyte-SFM培养液中。将细胞置于37℃、体积分数为5%的CO2,饱和湿度的培养箱中培养,以胰蛋白酶消化传代,取对数生长期的CNE-2细胞和NPY69细胞分别接种于96孔板,调整细胞浓度每孔1.5×104个细胞,加入不同浓度MTX培养液,调整终浓度,以不加MTX正常培养的细胞为对照组,每组设置6个复孔,置于恒温细胞培养箱中继续培养。
1.3CCK-8法检测MTX对细胞的影响 各组细胞于37℃、100%湿度培养箱分别培养24 h,每孔细胞中加入10 μl CCK-8,将细胞培养板置于37℃培养箱中,继续孵育4 h,在酶联免疫检测仪于450 nm处检测各孔细胞吸光度值(A值),以对照组测得的A值为对照,计算各组细胞增殖抑制率百分比,细胞增殖抑制率=1-(实验组A值/对照组A值)×100%。实验重复3次取均值。根据相关标准〔11〕,细胞相对抑制率>50%作为敏感,30%~50%为中度敏感,<30%为不敏感,选择MTX作用浓度。
1.4流式细胞术检测NPC细胞凋亡情况 MTX处理24、48 h的NPC细胞,用胰酶消化后收集细胞,用磷酸盐缓冲液(PBS)洗涤细胞2次,4℃2 000 r/min离心5 min,以结合缓冲液重悬细胞,制成单细胞悬液,分别依次加入5 μl Annexin V-FITC和5 μl PI混匀,于室温下避光孵育15 min,加入不少于104个细胞至流式上样管中,用流式细胞仪检测各组NPC细胞凋亡率。
1.5Western印迹检测NPC细胞中Cleaved Caspase-3和p53蛋白的表达 分别收集培养24 h后的各组NPC细胞,按照蛋白提取试剂盒说明书提取总蛋白,用二喹啉甲酸(BCA)法定量检测蛋白浓度。蛋白样品与电泳缓冲液按照1∶2体积比混匀后,置沸水中加热5 min使蛋白变性,采用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(5%浓缩胶、12%分离胶)分离蛋白,将凝胶蛋白低温下转移至硝酸纤维素膜上,以5%脱脂奶粉室温孵育60 min,分别加入相应的一抗Cleaved Caspase-3(1∶800稀释)、p53(1∶800稀释)结合,4℃过夜反应,再加入1∶1 000稀释的二抗,室温孵育2 h。采用电化学发光,成像系统曝光扫描,以GAPDH为内参,分别以Cleaved Caspase-3、p53灰度值比GAPDH灰度值表示Cleaved Caspase-3、p53蛋白水平,计算各组NPC细胞中Cleaved Caspase-3和p53蛋白表达水平。
1.6定量实时聚合酶链反应(qRT-PCR)检测NPC细胞中环氧合酶(COX)-2和γ-catenin的表达 各组NPC细胞分别培养24 h以后,用胰酶消化后,低温低速离心收集细胞,加入1 ml Trizol后震荡裂解细胞,加入0.2 ml氯仿溶液,震荡后冰浴5 min,4℃、12 377 r/min离心15 min。弃上清至另一新的EP管中,用预冷的异丙醇沉淀RNA,用75%的乙醇洗涤RNA 3次,用RNase-free ddH2O溶解RNA。用分光光度计测定RNA的浓度和纯度,A260/A280为1.97,可用于后续实验。用M-MLV反转录试剂盒合成cDNA,用SYBR Green Gene Expression Assay进行qRT-PCR,反应体系为20 μl〔cDNA模板4 μl,SYBR Green 10 μl,上游引物1 μl,下游引物1 μl,焦碳酸二乙酯(DEPC)-H2O 4 μl〕。以GAPDH为参照,分别计算COX-2和γ-catenin水平。
1.7ELISA测定细胞培养液上清中Notch1、Notch2含量 各组NPC细胞处理后48 h后,收集细胞培养上清液,按照Notch1、Notch2蛋白ELISA检测试剂盒说明书检测培养液上清中Notch1和Notch2含量。
1.8统计学分析 所有实验至少重复3次,采用SPSS21.0软件进行独立样本t检验,多组差异单因素方差分析,组间SNK-q检验。
2 结 果
2.1MTX对NPC细胞增殖的影响 不同浓度梯度的MTX(0.0、0.1、0.5、1.0、5.0、10.0、50.0 μmol/L)作用于人NPC细胞及人正常鼻咽部上皮细胞24 h后,NPC细胞和NP69增殖抑制率随着MTX浓度的增加而升高,呈现出一定的浓度依赖性,差异具有统计学意义(P<0.001)。见表1。提示MTX对NPC细胞增殖具有抑制作用,且呈浓度依赖性,而对人正常的鼻咽上皮细胞增殖抑制作用影响较小。根据药物敏感性标准选取MTX对NPC细胞的作用浓度分别为5.0、50.0 μmol/L用于后续实验。
表1 MTX对CNE-2细胞和NP69细胞增殖的抑制率
1)与0.0 μmol/L组比;2)与0.1 μmol/L组比;3)与0.5 μmol/L组比;4)与1.0 μmol/L组比;5)与5.0 μmol/L组比;6)与10.0 μmol/L组比:均P<0.05
2.2MTX对NPC细胞凋亡的影响 NPC细胞经MTX处理24 h后流式细胞检测结果显示,处理24 h时5.0、50.0 μmol/L MTX处理的NPC细胞凋亡率分别为(18.52±2.21)%、(41.332±4.53)%,与对照组(0.0 μmol/L MTX)(2.42±0.36)%差异具有统计学意义(P<0.05),提示MTX可诱导NPC细胞凋亡,且呈浓度依赖性。见图1。
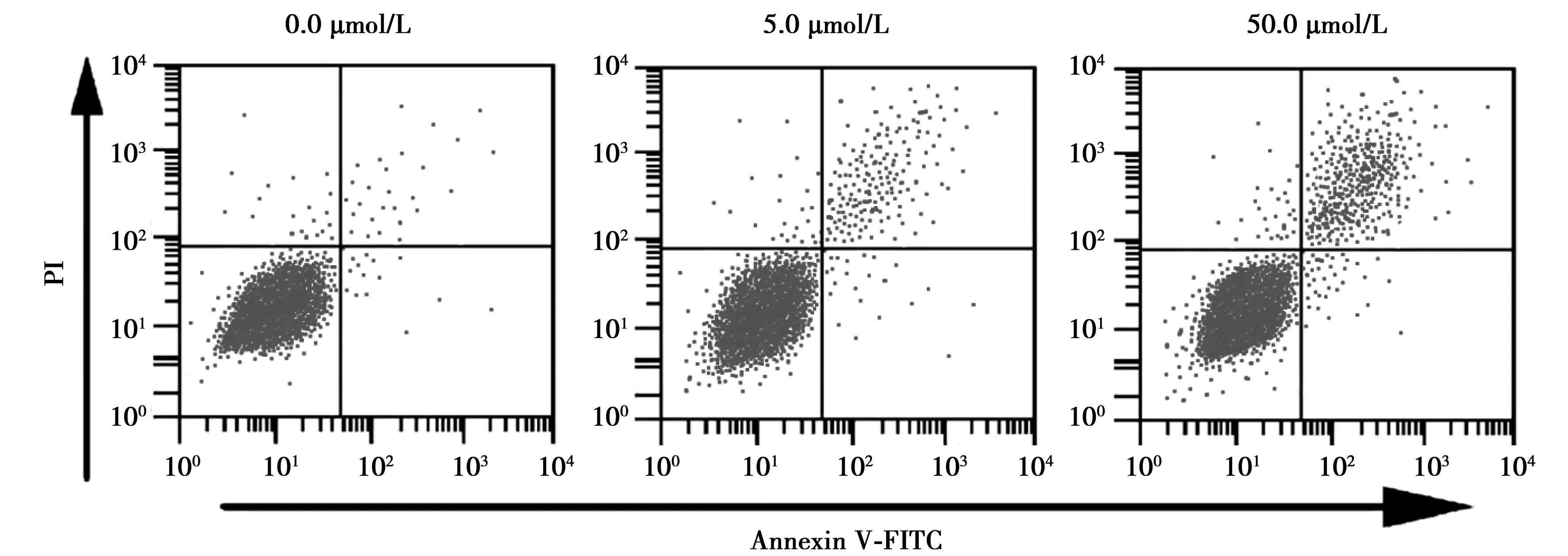
图1 流式细胞仪检测MTX对各组NPC细胞凋亡的影响
2.3MTX对NPC细胞中Cleaved Caspase-3和p53蛋白的影响 MTX处理后NPC细胞24 h后,Western印迹检测NPC细胞中Cleaved Caspase-3和p53的蛋白表达量,0.0、5.0、50.0 μmol/L组NPC细胞中Cleaved Caspase-3蛋白表达水平和p53蛋白表达水平较对照组(0.0 μmol/L MTX)明显升高(P<0.05),5.0 μmol/L组与50.0 μmol/L组差异具有统计学意义(P<0.001)。说明MTX可促进NPC细胞中Cleaved Caspase-3和p53的表达,浓度越高Cleaved Caspase-3和p53的表达量越高。见图2和表2。
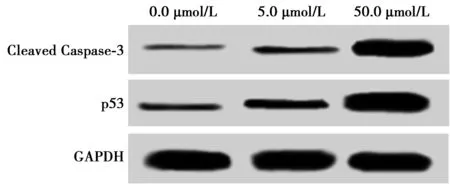
图2 Western印迹检测各组NPC细胞中Cleaved Caspase-3和p53的表达
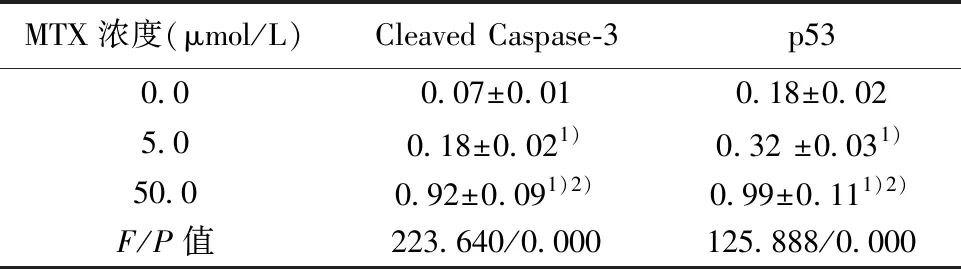
MTX浓度(μmol/L)Cleaved Caspase-3p530.00.07±0.010.18±0.025.00.18±0.021)0.32 ±0.031)50.00.92±0.091)2)0.99±0.111)2)F/P值223.640/0.000125.888/0.000
1)与0.0 μmol/L组比;2)与5.0 μmol/L组比:均P<0.05;表3同
2.4MTX对NPC细胞中COX-2和γ-catenin表达的影响 MTX处理NPC细胞24 h后,qRT-PCR法检测细胞COX-2和γ-catenin mRNA相对表达量,5.0、50.0 μmol/L组NPC细胞中COX-2 mRNA相对表达量分别为0.62±0.07、0.24±0.02,γ-catenin相对表达量分别为0.75±0.08、0.49±0.05,与对照组(0.0 μmol/L)(1.00±0.00、1.00±0.00)相比,差异具有统计学意义(P<0.05),5.0 μmol/L与50.0 μmol/L组差异具有统计学意义(P<0.05),3组间差异均显著(F=245.208,P=0.000;F=65.764,P=0.000)。MTX能够抑制NPC细胞中COX-2和γ-catenin mRNA的表达,且呈浓度依赖性。
2.5MTX对NPC细胞中培养上清液中Notch1、Notch2含量的影响 与对照组(0.0 μmol/L)相比,5.0、50.0 μmol/L组鼻咽癌细胞Notch1和Notch2含量明显降低(P<0.05)。5.0和50.0 μmol/L组间差异具有统计学意义(P<0.05)。MTX可抑制NPC细胞Notch1和Notch2的分泌。见表3。
表3 各组细胞培养液上清中Notch1、Notch2含量变化
3 讨 论
NPC是起源于咽部隐窝的恶性肿瘤,其发病位置相对比较隐蔽,恶性程度较高,易转移且容易侵犯邻近组织,具有区域分布性。目前对NPC治疗的主要手段是放射治疗,化疗和放疗对NPC早期患者能够取得较好的治疗效果,但对中晚期NPC患者放疗和化疗的效果不佳〔12,13〕。MTX是临床上常用的抗癌药物,是一种二氢叶酸还原酶抑制剂,属于代谢类抗肿瘤药物,可抑制核蛋白的合成,干扰肿瘤细胞DNA的合成从而抑制肿瘤细胞的增生,用于治疗恶性肿瘤,其治疗效果明显〔14〕。不同浓度的MTX处理人绒毛膜上皮癌JEG-3细胞后,绒癌细胞生存率下降,酶切的caspase-9蛋白表达水平上调,凋亡增加〔15〕。依西美坦联合MTX对人乳腺癌MCF-7细胞株产生协同抑制作用〔16〕。本实验结果显示,不同浓度MTX处理人NPC细胞和人正常鼻咽上皮细胞后,对NPC细胞增殖抑制作用较明显,对人正常鼻咽上皮细胞影响作用较小,说明MTX起到抗NPC的作用。
细胞凋亡途径包括死亡受体途径和线粒体途径,两条细胞凋亡途径最终执行者都是Caspase-3,导致Caspase-3激活形成有活性的Cleaved Caspase-3,引发一系列后续级联反应,促使细胞发生凋亡,Cleaved Caspase-3可作为检测细胞凋亡的标志性物质〔17〕。p53对细胞凋亡具有调控作用,Bax可与线粒体上的电压依赖性离子通道相互作用,介导细胞色素C的释放,具有促凋亡作用,p53可以上调Bax的表达完成促进细胞凋亡作用。此外,p53还可通过死亡信号受体蛋白途径诱导凋亡〔18〕。研究显示,MTX在类风湿关节炎大鼠滑膜细胞中能够诱导Caspase-3、Caspase-9和Bax蛋白表达上调,导致细胞凋亡〔19〕。采用不同剂量的MTX处理人非小细胞肺癌A549细胞,流式细胞术检测细胞凋亡率发现,细胞凋亡率显著升高,对细胞中p53和p21基因检测结果显示p53和p21基因表达发生了上调〔20〕。MTX可诱导急性淋巴细胞白血病EU-4细胞凋亡,雷帕霉素预处理可增强MTX诱导的细胞凋亡〔21〕。本研究说明MTX诱导NPC细胞凋亡与Caspase-3的激活及p53的上调密切相关。
COX是一种膜脂蛋白,其中COX-2属于诱生型,受致癌剂或癌基因产物诱导表达,在结直肠癌、胃癌、食管癌等多种肿瘤中均有COX-2的高表达。研究表明,COX-2高表达与肿瘤分化相关,COX-2的表达随甲状腺病变分化程度不同而改变,从正常上皮到淋巴细胞性甲状腺炎再到滤泡样腺瘤及滤泡样癌COX-2的表达量依次升高〔22〕。低、中、高分化鼻咽癌中COX-2表达量依次降低〔23〕。提示COX-2的表达与分化程度呈负相关。研究指出γ-catenin是构成桥粒的重要组成成分,且桥粒的数量是上皮细胞分化程度的指标之一。此外,γ-catenin的表达与低分子量的细胞角蛋白表达在一定程度上呈正相关。细胞角蛋白是组成细胞骨架的成分之一,其表达量反映细胞的分化程度。因此,γ-catenin的表达量可在一定程度上反映细胞的分化程度。病毒感染引起的NPC通过抑制γ-catenin的表达来抑制NPC细胞的分化程度〔24〕。本实验结果显示,MTX诱导的NPC细胞中COX-2和γ-catenin的表达显著下降,说明MTX可抑制NPC细胞的分化。
Notch信号通路广泛存在于多种动物体内,在细胞增殖、分化、发育过程中发挥至关重要的作用,研究显示,Notch信号通路与肿瘤的发生和发展密切相关。在结直肠癌细胞中上调Notch1表达,可使蛋白磷酸激酶B激活,抑制由p53介导的细胞凋亡〔25〕。在不同分化程度的子宫颈癌标本中检测到Notch1的表达水平不同,提示Notch信号通路与宫颈癌细胞分化有关〔26〕。本实验提示MTX可通过抑制Notch信号通路的激活调控NPC细胞的增殖、凋亡和分化的过程。
MTX可抑制NPC细胞增殖和分化,促进细胞凋亡的过程,其作用机制与抑制Notch信号通路的激活有关。
