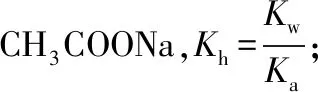例析高考试题中平衡常数的求法
2019-04-24湖北邢泰宇徐文军
湖北 邢泰宇 徐文军
化学平衡常数是表征气相平衡、溶解平衡、电离平衡、水解平衡等平衡体系限度的关键参数,对研究物质在可逆反应中的行为起着重要作用。2018年普通高等学校招生全国统一考试大纲的说明(理科)关于平衡常数有如下描述:“掌握化学平衡的特征,了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算”;与2016年“考试说明”相比,“了解弱电解质在水溶液中的电离平衡”改为“理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算”,“了解难溶电解质的沉淀溶解平衡,了解溶度积的含义及其表达式,能进行相关的计算”改为“了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算”,这些表述或改动强化了平衡常数计算问题,凸显了通过化学计算定量地说明化学问题。下面以有关平衡常数的高考试题为例,谈谈平衡常数的求算方法。
一、定义式法

【试题分析】CO2的转化率是50%,即转化了 0.25 mol·L-1,根据平衡三段法得:

起始浓度(mol·L-1) 1 0.5 0 0
转化浓度(mol·L-1) 0.25 0.25 0.5 0.5
平衡浓度(mol·L-1) 0.75 0.25 0.5 0.5
【策略技巧】根据平衡三段法求出各物质平衡浓度,直接代入平衡常数定义式直接求算即可。
二、定义式迁移法
【例2】(2018·全国卷Ⅰ·28节选)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)的分解反应:


2N2O4(g)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,N2O5(g)完全分解]:

t/min040801602601 3001 700∞p/kPa35.840.342.545.949.261.262.363.1

【试题分析】N2O5完全分解生成N2O4和O2,起始pN2O5=35.8 kPa,其完全分解时pN2O4=35.8 kPa,pO2=17.9 kPa,设平衡时N2O4转化了x,

平衡(kPa) 35.8-x2x

【参考答案】13.4
【策略技巧】平衡分压式平衡常数(Kp)由浓度式平衡常数(Kc)迁移而来,可先根据三段式求出各物质的平衡分压,再用其代替平衡浓度计算即可。
2014年全国卷Ⅰ、2015年四川卷中也出现过分压式平衡常数(Kp)的计算。
三、特殊点法
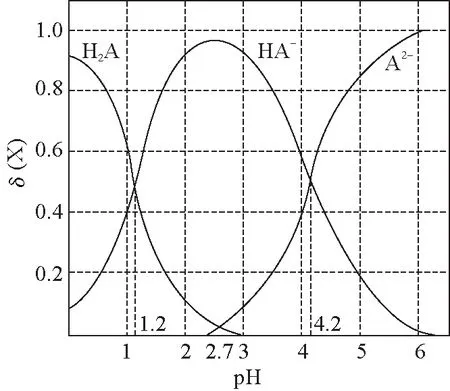
1.图象中的交叉点

B.lg[K2(H2A)]=—4.2 ……
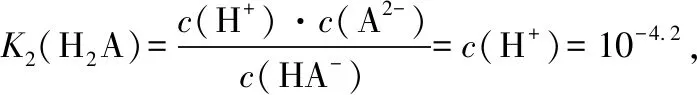
【参考答案】略
【策略技巧】在微粒浓度或物质的量或含量等随pH或时间等变化的图象中,两种微粒的交叉点往往是计算平衡常数的首选点。交叉点时两种微粒浓度相等,平衡常数公式中该两种微粒数值抵消,简化了计算。
2014年浙江卷、2017年江苏卷中也出现过用交叉点来计算平衡常数。
2.图象中有确定坐标值的点
【例4】(2017·全国卷Ⅰ)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是(B、C、D选项省略)
A.Ka2(H2X)的数量级为10-6……


【参考答案】略
【策略技巧】在微粒浓度或物质的量或含量等随pH或时间等变化的图象中,若某点(如起点、交叉点等)有确定的坐标值,可以用该点数据来计算相关平衡常数。
2016年全国卷Ⅰ、2017年全国卷Ⅲ、2018年全国卷Ⅲ中也出现过用特定坐标点的方法来计算平衡常数的试题。
3.速率方程中平衡点


①平衡常数K343K=________(保留2位小数)。

【试题分析】①由图示温度越高反应越快,达到平衡用时就越少,所以a点所在的曲线代表343 K的反应。从图中可以读出,平衡以后反应转化率为22%。设初始加入的SiHCl3的浓度为1 mol/L,则:

起始浓度(mol·L-1) 1 0 0
转化浓度(mol·L-1) 0.22 0.11 0.11
平衡浓度(mol·L-1) 0.78 0.11 0.11



起始浓度(mol·L-1) 1 0 0
起始浓度(mol·L-1) 0.2 0.1 0.1
平衡浓度(mol·L-1) 0.8 0.1 0.1

【参考答案】0.02 1.3

2015年全国卷Ⅰ、2016年海南卷、2017年江苏卷中都曾出现过利用速率方程求算平衡常数的试题。
四、守恒法
【例6】(2012·山东卷)25℃时,将amol NH4NO3溶于水,向该溶液滴加bL氨水后溶液呈中性,则所滴加氨水的浓度为________mol/L(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)。
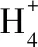

【策略技巧】对于电离平衡或水解平衡常数,若不方便建立平衡三段式计算,可先根据溶液中的电荷守恒、物料守恒等关系找出各微粒的浓度,再代入平衡常数的定义式中计算。
五、“盖斯定律”法


【参考答案】8.7×10-7
【策略技巧】已知多个相关反应的平衡常数,可用“盖斯定律”法将多个方程式相加或相减,得到目标方程式,对应方程式的K是相乘或相除的关系,若目标方程式系数是已知方程式的n倍,则目标方程式K是已知方程式K的n次方。
六、比值等量法


【参考答案】20
【策略技巧】将目标方程式的平衡常数表达式分子、分母同时乘以c(H+)或c(OH-)等与已知方程式相关的量时,比值保持不变,如例题8,该方法通常用于多个相关方程式之间K值求算,与例题7使用“盖斯定律”法实质是一样的,例题8也可以用“盖斯定律”法计算平衡常数。