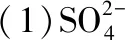浅谈化学实验方案的设计
2019-04-24陕西张公清
陕西 张公清
高中化学实验教学,是化学教学中的重中之重。我们每一名化学教师不仅做好实验设计以保证实验教学的有效开展,还要应该引导学生学会自己设计实验来提高学生的学习效率和学习兴趣。同时,化学实验方案的设计与评价已经成为高考化学的热点题目,该类实验题目不仅符合新课改的精神,还能综合考查学生的实验能力,创新观察能力,所以此类试题应引起大家的高度重视。
1.化学实验方案设计的五项基本原则
2.化学实验方案设计的基本思路
根据实验目的和原理及所选用的药品和仪器,设计合理的装置,并且从几种方案中分析选择出最佳方案。

3.化学实验方案的设计步骤
(1)明确目的,弄清原理

(2)选择实验用品

(3)实施实验操作——注意严谨性、逻辑性、规范性、安全性
(4)记录实验现象、数据——全面而准确
(5)分析、归纳得出结论
4.探究实验题的解题策略
设计实验探究时,要求原理准确、步骤简捷、现象明显、结论易得且不对环境造成污染,中学化学性质实验探究的主要角度有:
(1)物质氧化性、还原性的判断。如探究SO2具有还原性的方法是将气体通入酸性KMnO4溶液中,通过KMnO4溶液是否褪色来说明。
(2)物质氧化性、还原性强弱的判断。如探究Fe3+的氧化性强于I2时,可利用FeCl3与KI淀粉溶液反应,通过溶液变蓝色来说明Fe3+的氧化性大于I2。
(3)同周期、同主族元素性质的递变规律。一般通过设计元素金属性、非金属性强弱的实验来完成,如通过Mg、Al与同浓度盐酸反应产生H2的快慢来说明Mg、Al的活泼性顺序。
(4)电解质强弱的判断。如探究一元酸HA是弱酸的方法是常温下配制NaA的溶液,测pH,若pH>7,则说明HA为弱酸。
(5)物质酸性强弱的判断。如探究碳酸和硅酸的酸性强弱,可利用相对强的酸制备相对弱的酸的反应原理,将CO2气体通入Na2SiO3溶液,看是否有白色沉淀生成来判断。
(6)钢铁发生电化学腐蚀的规律探究。可以通过控制所含的杂质是否与空气接触、所接触的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气压变化等角度设计实验,找出规律。
5.例题鉴赏
例1.(2018·全国卷Ⅰ·26)醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是,仪器a的名称是。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为______。
②同时c中有气体产生,该气体的作用是______。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是、、洗涤、干燥。
(4)指出装置d可能存在的缺点______。
【试题分析】本题主要是醋酸亚铬制备原理的实验探究,考查学生的化学实验探究的能力。要求学生可从提供的新信息中,准确地提取实质性内容,并与已有知识进行整合,重组为新知识块,题目难度中等。明确实验原理、有关物质的性质尤其是题干信息中提取和应用是解答的关键。
【精准分析】(1)在盐酸溶液中锌把Cr3+还原为Cr2+,同时产生氢气排尽装置中的空气防止氧化。生成的氢气导致c中压强增大,可以把生成的CrCl2压入d装置发生反应,则详解:由于醋酸亚铬易被氧化,所以需要尽可能避免与氧气接触,因此实验中所用的蒸馏水均需煮沸后迅速冷却,目的是去除水中的溶解氧;根据仪器构造可知仪器a是分液(或滴液)漏斗。

②锌还能与盐酸反应生成氢气,由于装置中含有空气,能氧化Cr2+,所以氢气的作用是排除c中空气。
(3)打开K3,关闭K1和K2,由于锌继续与盐酸反应生成氢气,导致c中压强增大,所以c中亮蓝色溶液能流入d装置,与醋酸钠反应;根据题干信息可知醋酸亚铬难溶于冷水,所以为使沉淀充分析出并分离,需要采取的操作是(冰浴)冷却、过滤、洗涤、干燥。
(4)由于d装置是敞开体系,因此装置的缺点是可能使醋酸亚铬与空气接触被氧化而使产品不纯。

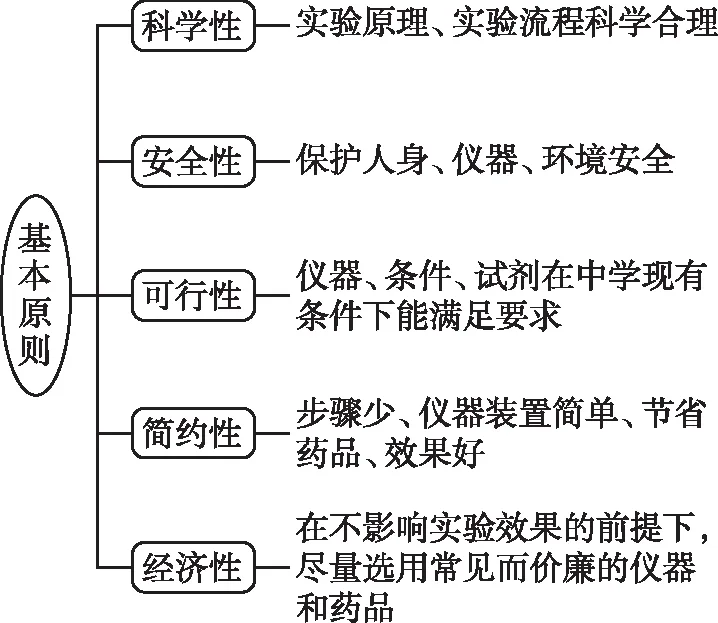
例2.(2018新课标Ⅱ卷·28题)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
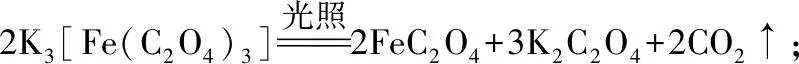
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
①通入氮气的目的是______。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有、。
③为防止倒吸,停止实验时应进行的操作是______。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是______。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。滴定终点的现象是______。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为______。
【试题分析】本题主要是考查物质分解产物检验、元素含量测定等实验方案设计与评价,题目难度中等,明确实验原理和相关物质的性质是解答的关键。关于化学实验从安全角度常考虑的主要因素如下:净化、吸收气体及熄灭酒精灯时要防止液体倒吸;进行某些易燃易爆实验时要防爆炸(如H2还原CuO应先通H2,气体点燃前先验纯等);防氧化(如H2还原CuO后要“先灭灯再停氢”,白磷切割宜在水中进行等);污染性的气体要进行尾气处理;有粉末状物质参加的反应,要注意防止导气管堵塞;防吸水(制取易吸水、潮解、水解的物质时宜采取必要措施,以保证达到实验目的)。
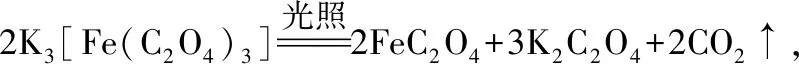
(2)①装置中的空气在高温下能氧化金属铜,能影响E中的反应,所以反应前通入氮气的目的是隔绝空气并排尽装置中的空气;反应中有气体生成,不会全部进入后续装置。②实验中观察到装置B、F中澄清石灰水均变浑浊,说明反应中一定产生二氧化碳。装置E中固体变为红色,说明氧化铜被还原为铜,即有还原性气体CO生成,由此判断热分解产物中一定含有CO2、CO。③为防止倒吸,必须保证装置中保持一定的压力,所以停止实验时应进行的操作是先熄灭装置A、E的酒精灯,冷却后停止通入氮气即可。④要检验Fe2O3存在首先要转化为可溶性铁盐,因此方法是取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3。
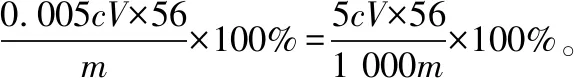
【考点定位】化学实验综合考查,涉及物质检验实验方案设计与评价、化学实验基本操作、氧化还原反应滴定以及定量计算等。

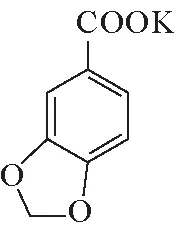
3.(2018江苏卷·22)3,4 - 亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用 KMnO4氧化3,4 - 亚甲二氧基苯甲醛制备,其反应方程式为
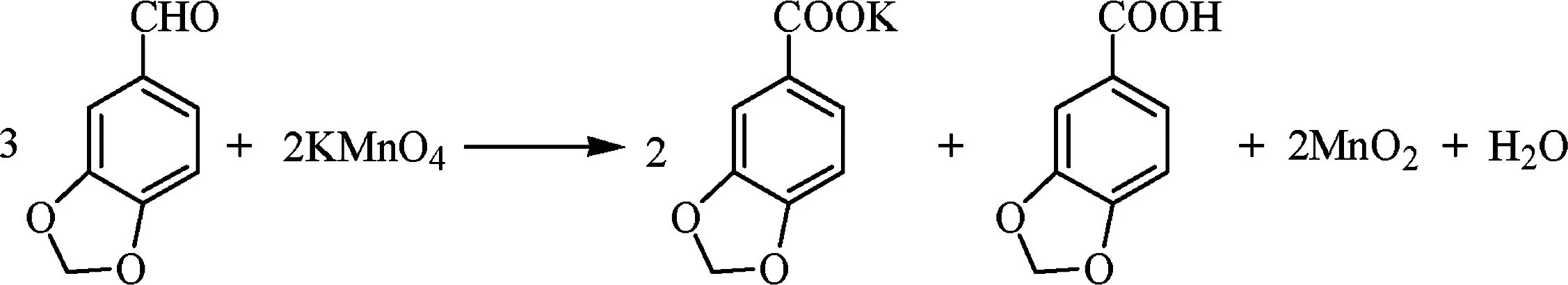
实验步骤如下:
步骤1:向反应瓶中加入3,4 - 亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4 - 亚甲二氧基苯甲酸固体。

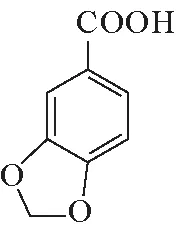
(2)步骤2中,趁热过滤除去的物质是2中,趁热过滤除去的物(填化学式)。
(3)步骤3中,处理合并后溶液的实验操作为2中,趁热过滤除去的物。
(4)步骤4中,抽滤所用的装置包括、吸滤瓶、安全瓶和抽气泵。

(4)抽滤所用的装置包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。