对氢氧化铝沉淀图象问题的深度探究
2019-04-24安徽张茹英
安徽 张茹英 汤 伟
一道好的经典习题,不仅可以锤炼学生的基础知识,还可以较好地提升学生的学习能力,但随着新课标的不断深化和实施,教学过程中我们还要逐步渗透学科素养,过去仅仅注重知识与能力已经不能够跟上时代的步伐,一些经典习题可能不再经典,甚至还可能会误导学生或对学生传播一些错误的、不科学的知识。例如关于Mg2+、Al3+离子在碱性条件下形成沉淀的图象题可谓“经典”中的“经典”,下面我们重点针对该经典问题做出剖析。
一、问题提出
关于Mg2+、Al3+离子在碱性条件下形成沉淀的图象问题,目前为止,在各教辅资料中特别常见,笔者做了市场调研,在10个不同教辅资料中均出现了如下相同或类似的习题(看来是因为“经典”,所以大部分编者会选编该试题)。
【“经典”题】1:将一定质量的镁、铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入5 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的变化如图1所示:

图1
则下列说法不正确的是
( )
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
【答案】D
【“经典”题】2:在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图2所示:
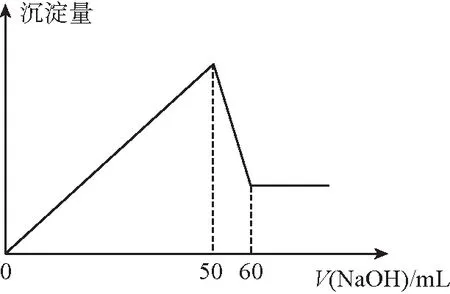
图2
则原混合液中Al2(SO4)3和MgSO4的物质的量浓度之比为
( )
A.6∶1 B.3∶1 C.2∶1 D.1∶2
【答案】D


图3
请填写下列空白:
(1)在该溶液中含有的离子是,它们的物质的量浓度之比为。
(2)所加的淡黄色固体是(化学式)。

(2)Na2O2
分析上面图象特点,我们可以发现Mg2+、Al3+在共存条件下滴加烧碱溶液,命题者认为二者会同时形成沉淀,事实果真如此吗?
二、问题剖析
Mg2+、Al3+在共存条件下滴加烧碱溶液,是否能够同时形成沉淀,我们借助化学的学科观念“宏观辨识与微观探析”、“变化观念与平衡思想”,借助化学的学科思维“证据推理与模型认知”,凭借化学的学科实践“科学探究与创新意识”,本着化学的学科价值取向“科学态度与社会责任”,对该类经典的问题做出进一步剖析。因为试题特点一致,涉及反应本质相同,下面我们仅仅针对“经典”题1做出详细剖析,其他训练题类推即可。

事实果真如此吗?
根据定量计算,我们会发现其结果会远远超出我们的预料之外。查阅教材,可以得出难溶性电解质的溶度积常数Ksp[Al(OH)3]=1.3×10-33,Ksp[Mg(OH)2]=5.6×10-12,针对上述试题,镁、铝混合物溶解于200 mL稀硫酸中,若溶液的体积变化忽略不计,我们容易得出溶液中离子的浓度:c(Al3+) ≈1.0 mol·L-1,c(Mg2+) ≈0.75 mol·L-1,由此我们可以计算出两种离子开始形成沉淀和完全沉淀时的pH。首先我们可以计算推理得出该溶液各离子开始形成沉淀时的pH。
滴加NaOH溶液的过程中,显然二者并非同时沉淀。
两种离子完全形成沉淀时的pH又会是什么样的结论呢?通常情况下,当离子浓度达到1.0×10-5mol·L-1时,我们一般认为沉淀完全。
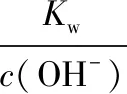
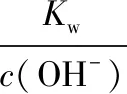
结合以上计算结果,我们可以发现,当铝离子完全沉淀后,镁离子还没有开始沉淀!以上经典的习题常常会错误认为滴加NaOH溶液时,二者会同时形成沉淀,于是命题人常常会想当然的编写出了图象!
针对Al(OH)3沉淀物,如果继续滴加NaOH 溶液,二者能够发生如下反应:Al(OH)3+NaOH=Na[Al(OH)4],此时沉淀又发生溶解,查阅大学教材相关内容,可以得出Al(OH)3沉淀物开始溶解时的pH约为8.0,Al(OH)3沉淀完全溶解时的pH约为12.0。有些大学教材针对铝盐溶液中滴加NaOH溶液,溶液的pH与体系中铝的各种微粒关系给出了如图4所示的结论:
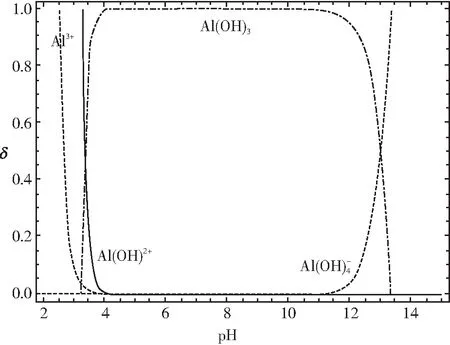
图4
这与我们上面的定量计算结果基本上是一致的结论。
根据以上的剖析,我们可以进一步推断得出,上述“经典”题1的沉淀变化曲线应该如图5所示(或更为复杂):

图5
三、教学建议
经典试题本质上应该通过学生的训练,达到巩固基础知识的同时还能够进一步提升学生的学科素养和能力,一定不应该传播错误的或伪科学知识。针对以上Mg2+、Al3+在碱性条件下形成沉淀的话题,我们希望在以后的教学过程中,教师不要想当然的选编上述习题供学生训练,在学生学习过程中让学生认识到沉淀反应也存在竞争!要能够辩证的看待该类反应,训练过程中针对学生的认识层次,可以选编近年来高考出现的类似试题,引导学生分析高考命题者是如何回避该问题的,例如以下几道高考试题:
2012年安徽高考13题:已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下面图6中表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是
( )

图6
该试题B、C选项是站在常规的思维模式,考查学生的逻辑推理能力,而命题者在命制该试题时一定考虑了铁离子、铝离子共存时滴加NaOH溶液二者沉淀的先后顺序问题。
【答案】C
再如下面安徽与广东的两道高考试题:
2014年安徽高考13题:室温下,在0.2 mol·L-1Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图7所示,下列有关说法正确的是
( )

图7

B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
【答案】C
2009年广东高考24题:超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3,NH4AlO(OH)HCO3热分解的化学反应方程式为。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mL 、pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体g;
②将上述固体置于烧杯中。
(3)在0.1 mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系如图8所示:

图8
NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有。

(2)①4.5 ②再向烧杯中加入100 mL蒸馏水,充分搅拌至固体溶解
2014年安徽高考13题是在真实的数字实验下测定出来的图象,具有真实性、科学性,2009年广东高考试题是在理论计算的前提下得出的图象。仔细研究该试题,我们还能够看出在不同的pH条件下,铝元素是以不同微粒形式存在的,命题者这样设计,才是真正的结论。

