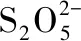价——态推测模型
2019-04-24广东陈彬城
广东 陈彬城
氧化还原反应方程式的书写是近几年高考的热点和难点。最常见的考查模式是根据题目给定的情景(如某些反应物、生成物、反应的酸碱性或图表等信息)书写陌生氧化还原反应方程式。广义的氧化还原反应方程式还包括电化学的电极反应(原电池和电解池的电极反应)。这类题目要求考生能够运用元素化合物的知识、氧化还原反应原理以及其他的基本反应原理(如强酸制弱酸、水解、产物共存等原理)对题目进行综合分析,推测生成物,然后配平、补充物质,按步骤完成化学方程式。
推测生成物是完成题目的关键,也是很多考生最感到头疼的步骤,以下介绍一种以元素化合价存在形态二维图(以下简称“价——态二维图”)为核心,用于氧化还原反应产物(包括电化学反应产物)推测的模型即价——态推测模型。
一、价——态推测模型
1.价——态推测模型简介
价——态推测模型是指根据元素不同化合价在各种条件下(如酸性、碱性、中性等)的存在形态,结合题目信息及必要反应原理(如水解、产物共存等原理),推测产物的思维模型。其主要流程如下:

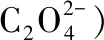
从④到⑤是方程式的最后环节,主要比较④的方程式左右两端H、O的数目,结合反应条件补充H+、OH-或H2O。
2.价——态二维图
价——态二维图是以外界条件(无水、酸性、中性、碱性等)为横坐标,以元素的化合价为纵坐标,在二维平面内绘制元素的各种化合价在不同条件下存在形态的图象。可用于推测化学方程式的反应物、生成物或判断方程式的正误。以下是H、C、O、S、Fe等元素的价——态二维图:
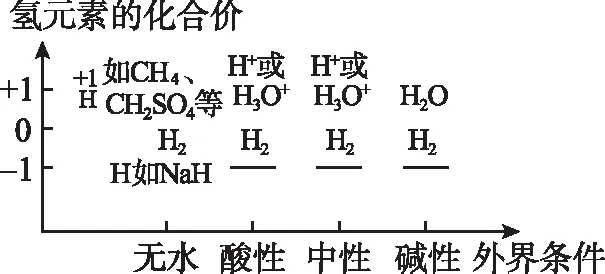
图1 氢元素的价——态二维图

图2 氯元素的价——态二维图

图3 碳元素的价——态二维图

图4 硫元素的价——态二维图

图5 锰元素的价——态二维图
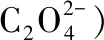
3.氧化还原反应的配平
这里主要配平氧化剂、还原剂、氧化产物、还原产物,要求熟悉电子守恒法配平。
4.物质的补充
这一块的重要原则是“先配平后补充”,因为只有配平氧化剂、还原剂、氧化产物、还原产物后,才能知道需要补充哪些反应物和生成物。常见的补充原则如下:
(1)若左边缺少氢原子,酸性条件下,直接补充H+再配平即可;碱性或中性条件下,应补充H2O生成OH-(每一个H2O失去一个H+生成一个OH-),再配平即可。
(2)若左边缺少氧原子,酸性或中性条件下,直接补充H2O生成H+再配平即可;碱性条件下,应补充OH-生成H2O(每两个OH-失去一个O生成一个H2O),再配平即可。
(3)若左边多氢原子,酸性或中性条件下,生成H+;碱性条件下,应补充OH-生成H2O。
(4)若左边多氧原子,酸性条件下,补充H+生成H2O;碱性或中性条件下,应补充H2O生成OH-。
5.产物共存原理
产物共存原理指的是同一体系的产物之间不再发生反应,能共存。若产物之间会继续反应,则要写出继续反应后的产物,直至产物之间不再发生反应。
如碱性条件下:



二、典例分析
例1.SO2通入酸性高锰酸钾溶液的离子方程式
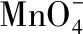


观察以上式子,可发现左边缺少2O,在酸性溶液中,只能从水补充,应加上2H2O,而水失去氧后+1价的H以H+形式存在,右边补充4H+。
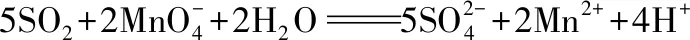
例2.草酸(H2C2O4)使酸性高锰酸钾褪色
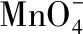
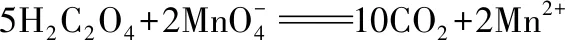
观察以上式子,可发现左边多8O和10H,应结合为5H2O剩下3个-2价的O,根据图2 氧元素的价——态二维图,可知在酸性溶液中,-2价的O以H2O形态存在,故应补充6H+,再生成3H2O,总数为8H2O。

例3.书写甲烷燃料电池的电极反应式(①电解质溶液为氢氧化钾②电解质溶液为稀硫酸)

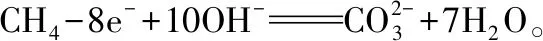






例4.书写电解碱性食盐水的电极反应式


三、真题分析
例5.(2018·全国卷Ⅰ·27节选)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为。