敲减TLR4表达减少LPS诱导的胰腺腺泡AR42J细胞分泌炎症因子*
2019-04-22吴晓梁王学莉王成立
马 丽, 吴晓梁, 王学莉, 伏 添, 王成立
(1汉中市3201医院重症医学科, 陕西 汉中 723000; 2浙江大学第一附属医院重症医学科, 浙江 杭州 310015)
急性胰腺炎是一种常见的临床危重疾病,是较为复杂的瀑布样级联反应,其起始于胰腺腺泡细胞内相关酶的激活,炎性介质释放和氧自由基等都可以降低胰腺细胞的抗氧化能力,引起胰腺损伤[1-2]。胰腺腺泡细胞作为胰腺的外分泌单位,是胰腺组织的重要组成部分,参与胰腺炎病理过程[3]。Toll样受体4(Toll-like receptor 4,TLR4)是Toll样受体蛋白家族成员之一,在中性粒细胞和巨噬细胞等多种细胞表面表达,参与细胞的生长、分化、炎症和氧化应激等过程;另外,TLR4还参与调控肿瘤和动脉粥样硬化等多种疾病发生[4-6]。在胰腺炎患者中TLR4普遍高表达,TLR4参与胰腺腺泡细胞损伤发生[7]。脂多糖(lipopolysaccharides,LPS)是革兰氏阴性菌细胞壁的主要成分,在重症胰腺炎病人发病早期,血浆中存在大量的LPS,急性胰腺炎时,LPS可以通过多种途径诱导组织炎症,促进急性胰腺炎的发生[8]。本实验用LPS处理胰腺腺泡AR42J细胞,探讨TLR4对LPS诱导的胰腺腺泡AR42J细胞炎症因子分泌和细胞损伤的作用,为明确胰腺炎的发病机制提供参考。
材 料 和 方 法
1 材料
大鼠胰腺腺泡AR42J细胞购自成都正能生物技术有限责任公司。SYBR Green Realtime PCR试剂盒购自成都福际生物技术有限公司;cDNA合成第一链试剂盒购自Biomiga;丙二醛(malondialdehyde,MDA)含量检测试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)含量检测试剂盒购自北京索莱宝科技有限公司;白细胞介素1β(interleukin-1β,IL-1β)含量检测试剂盒、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)含量检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性检测试剂盒和过氧化氢酶(catalase,CAT)活性检测试剂盒购自南京建成生物研究所;乳酸脱氢酶(lactate dehydrogenase,LDH)含量检测试剂盒购自南京信帆生物技术有限公司;抗TLR4抗体购自BioVision;携带TLR4小干扰RNA(small interfering RNA, siRNA)的慢病毒购自吉满生物科技(上海)有限公司。
2 方法
2.1细胞模型构建 大鼠胰腺腺泡AR42J细胞用含有双抗的RPMI-1640培养基培养,在培养液中添加10%的胎牛血清,细胞放在CO2浓度为5%、温度为37 ℃的培养箱内培养。用LPS刺激构建胰腺腺泡构建细胞损伤模型。将AR42J细胞接种到6孔板中,每个孔中加2 mL细胞培养液,106个细胞,培养24 h以后,添加LPS,使LPS的终浓度为10 mg/L[9],继续培养24 h以后,用real-time PCR和Western blot测定细胞中TLR4表达的变化。
2.2Real-time PCR和Western blot检测LPS对胰腺腺泡AR42J细胞中TLR4表达的影响 取AR42J细胞,在细胞中添加TRIzol裂解液,提取总RNA,将RNA溶解在DEPC水中。取RNA,用cDNA合成第一链试剂盒合成cDNA,步骤同试剂盒标准流程。再用SYBR Green Realtime PCR试剂盒对TLR4进行定量,内参照为GAPDH,引物由上海生工生物合成。TLR4 的正向引物序列为5’-GAAATGGAGGCACCCCTTC-3’,反向引物序列为5’-TGGATACGTTTCCTTATAAG-3’;GAPDH 的正向引物序列为5’-CGGAGTCAACGGATTTGGTCGTAT-3’,反向引物序列为5’-AGCCTTCTCCATGGTGGTGAAGAC-3’。实验结束后,读取每个反应的Ct值,以GAPDH为内参照,用2-ΔΔCt法计算TLR4水平。取内参照和目的基因Ct值的均值,ΔCt=Ct目的-Ct内参照,ΔΔCt=(实验组目的基因Ct值-实验组内参照基因Ct值)-(对照组目的基因Ct值-对照组内参照基因Ct值)。Real-time PCR程序为: 95 ℃ 15 s、60 ℃ 60 s、72 ℃ 30 s,共40个循环。
取AR42J细胞用PBS洗涤细胞3次以后,在细胞中添加含有RIPA的裂解液,冰上裂解20 min。4 ℃高速离心,用BCA法对蛋白定量以后,将蛋白同上样缓冲液混合煮沸5 min,保存在-80 ℃。配制10%的分离胶和5%的浓缩胶,每个泳道中加入50 μg的蛋白样品,用90 V的固定电压进行电泳,等到溴酚蓝将要进入分离胶时,调大电压到120 V。在100 V固定电压条件下将蛋白转移到NC膜,转膜2 h。将NC膜用5%的脱脂奶粉封闭以后,孵育抗体,I 抗以1∶200稀释,II 抗以1∶3 000稀释,ECL法发光后,用ImageJ分析条带的吸光度(A)值,内参照为GAPDH。
2.3慢病毒感染及沉默效果的检测 AR42J细胞接种到6孔板中,每个孔中加入4×105个细胞,细胞培养24 h后换液,按照每孔添加40 μL的RNA干扰病毒(5×1011TU/L)进行感染,12 h后观察细胞生长状态,更换细胞培养液。继续培养72 h,在显微镜下随机选取10个视野,观察感染效果,感染效率高于90%,用于后续实验。将稳定感染TLR4 siRNA慢病毒和阴性对照慢病毒的AR42J细胞用10 mg/L LPS培养,分别记为LPS+si-TLR4组和LPS+si-NC组;把0 mg/L LPS培养的未经感染的AR42J细胞记为control组;把用10 mg/L LPS培养的未经感染的AR42J细胞记为LPS组。用real-time PCR和Western blot检测TLR4 siRNA慢病毒沉默效果,步骤同上。
2.4MTT法检测细胞活力 各组AR42J细胞分别按照上述处理方法接种到96孔板内,细胞培养24 h以后,在每个孔中加入20 μL的MTT溶液,孵育4 h以后,把上清溶液吸弃,加入DMSO将结晶溶解,检测490 nm的A值,用空白孔调零。把control组细胞的存活率定义为100%,检测其它各组细胞的活力。
2.5二硝基苯肼法测定LDH的漏出率 各组AR42J细胞按照上述方法培养24 h以后,收集培养液上清和细胞悬浮液,分别用二硝基苯肼法检测细胞悬浮液和培养液上清中的LDH含量,步骤同LDH含量检测试剂盒标准流程。用培养液上清中LDH含量与细胞悬浮液中LDH含量的比值表示LDH漏出率。
2.6ELISA法检测细胞分泌IL-1β和TNF-α的水平 各组AR42J细胞按照上述方法培养24 h以后,收集细胞培养液上清,用ELISA方法测定细胞培养液上清中的IL-1β和TNF-α含量,步骤同试剂盒标准检测流程。
2.7细胞培养液上清中MDA含量及SOD、GSH-Px和CAT活性的检测 各组AR42J细胞按照上述方法培养24 h以后,收集细胞培养液上清,用硫代巴比妥酸法测定上清中MDA含量,用黄嘌呤氧化法测定上清中SOD活性,比色法检测GSH-Px活性和CAT活性,步骤均按照试剂盒标准流程进行。
3 统计学分析
用SPSS 21.0软件进行统计分析。所有实验数据以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,组间多重比较经SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 LPS处理诱导胰腺腺泡AR42J细胞中TLR4的表达
经过10 mg/L LPS处理后,胰腺腺泡AR42J细胞中TLR4 mRNA和蛋白的水平均升高(P<0.05),见图1,说明LPS可以诱导胰腺腺泡细胞中TLR4的表达。
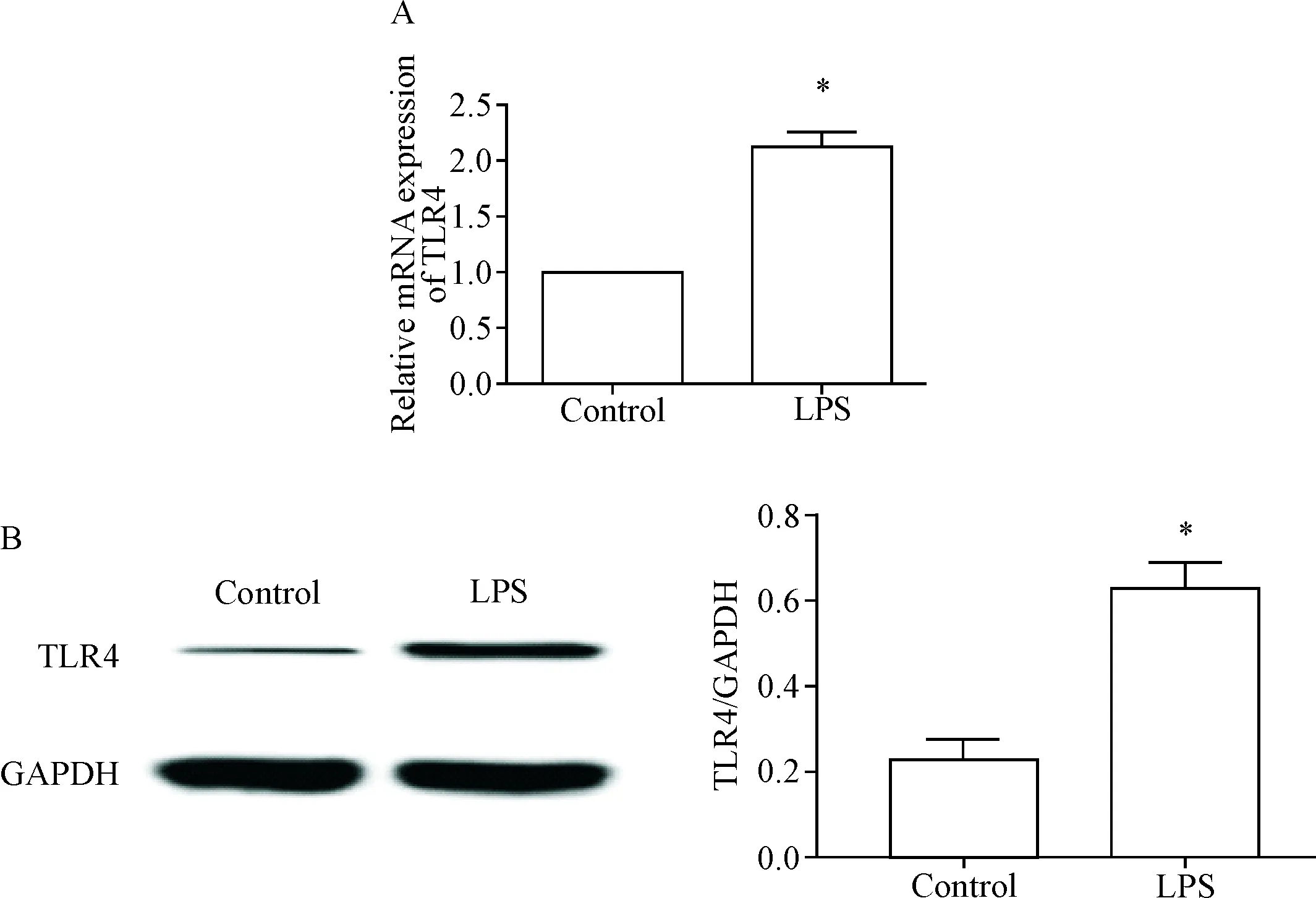
Figure 1.The changes of TLR4 expression in the pancreatic acinar AR42J cells after LPS treatment. A: the mRNA expression level of TLR4 in the pancreatic acinar AR42J cells after LPS treatment; B: the results of Western blot for detecting the protein expression of TLR4 in the pancreatic acinar AR42J cells after LPS treatment. Mean±SD.n=6.*P<0.05vscontrol group.
图1LPS处理后胰腺腺泡AR42J细胞中TLR4表达水平的变化
2 携带TLR4 siRNA的慢病毒感染能有效沉默LPS刺激下的胰腺腺泡AR42J细胞中TLR4的表达
胰腺腺泡AR42J细胞感染携带TLR4 siRNA的慢病毒后,经10 mg/L LPS处理,细胞中TLR4的mRNA和蛋白水平均降低(P<0.05),见图2,说明携带TLR4 siRNA的慢病毒可以成功下调LPS刺激下胰腺腺泡细胞中TLR4的表达水平。

Figure 2.Silencing effect of lentivirus infection on the expression ofTLR4 in the pancreatic acinar AR42J cells stimulated with LPS. A: the effect of lentivirus infection on the mRNA expression of TLR4 in the pancreatic acinar AR42J cells stimulated with LPS; B: the results of Western blot for detecting the effect of lentivirus infection on the protein level of TLR4 in the pancreatic acinar AR42J cells with LPS stimulation. Mean±SD.n=6.*P<0.05vsLPS group and LPS+si-NC group.
图2慢病毒感染对LPS刺激条件下胰腺腺泡AR42J细胞TLR4的沉默效果
3 下调TLR4提高LPS处理后的胰腺腺泡AR42J细胞活力并降低LDH漏出率
下调TLR4的胰腺腺泡AR42J细胞经10 mg/L LPS处理,细胞LDH漏出率降低,细胞活力升高(P<0.05),见表1,说明下调TLR4可以减轻LPS处理后的胰腺腺泡细胞损伤。
表1各组AR42J细胞LDH漏出率和细胞活力的比较
Table 1.The changes of LDH leakage rate and cell viability in each group (Mean±SD.n=6)

GroupLDH leakage rate (%)Cell viability (%)Control25.46±2.14100.00 LPS65.34±4.17∗54.25±4.13∗LPS+si-NC64.79±5.1256.14±7.46LPS+si-TLR448.69±4.28&72.46±6.23&
*P<0.05vscontrol group;&P<0.05vsLPS group.
4 下调TLR4减少LPS诱导的胰腺腺泡AR42J细胞分泌IL-1β和TNF-α
下调TLR4的胰腺腺泡AR42J细胞经10 mg/L LPS处理,细胞培养液上清中的IL-1β和TNF-α水平降低(P<0.05),见表2,说明下调TLR4可以减少LPS处理后的胰腺腺泡细胞分泌IL-1β和TNF-α。
5 敲减TLR4表达降低LPS刺激下胰腺腺泡AR42J细胞培养液上清中MDA水平并提高SOD、GSH-Px和CAT活性
敲减TLR4表达的胰腺腺泡细胞经10 mg/L LPS处理,细胞培养液上清中的MDA水平降低,SOD、GSH-Px和CAT活性升高(P<0.05),见表2。这说明下调TLR4可以减轻LPS处理后的胰腺腺泡细胞氧化损伤。
讨 论
急性胰腺炎是一种明显的全身炎症反应,可以引起全身多个器官功能损伤。炎症反应、微循环障碍等都与急性胰腺炎的发生有关。胰腺腺泡细胞是胰腺组织的功能单位,其占胰腺组织的80%,参与胰酶分泌、蛋白质消化等过程。在受到外界因素和内部因子刺激以后,腺泡细胞释放高水平的炎症因子。这些炎症因子不仅可以引起炎症细胞过度浸润、血管出血和诱发炎症级联反应,还可以反过来刺激腺泡细胞,引起腺泡细胞损伤[10-11]。LPS参与胰腺炎发生,其可以激活巨噬细胞等释放大量的炎症因子,诱导组织炎症和组织损伤,LPS是常见体外构建胰腺腺泡细胞损伤模型的诱导因子,可以诱导腺泡细胞释放炎症因子,诱导炎性损伤[12-15]。本实验表明,LPS刺激后的胰腺腺泡细胞活力降低,细胞释放的LDH水平增多,同时细胞释放的TNF-α等炎症因子水平升高,说明成功构建了LPS胰腺腺泡细胞损伤模型。
表2各组AR42J细胞分泌IL-1β和TNF-α水平及MDA、SOD、GSH-Px和CAT水平的比较
Table 2.The releases of IL-1β and TNF-α, the content of MDA and the activity of SOD, GSH-Px and CAT in the AR42J cells of each group (Mean±SD.n=6)

GroupIL-1β (ng/L)TNF-α (ng/L)MDA (μmol/L)SOD (U/L)GSH-Px (U/L)CAT (U/L)Control112.4±9.4284.63±29.565.30±0.51175.67±19.42195.26±11.47128.14±12.25LPS1 345.3±30.6∗7 956.47±414.93∗8.63±0.84∗96.43±11.52∗116.54±9.41∗78.20±9.13∗LPS+si-NC1 347.3±31.77 682.46±383.968.35±0.9398.46±10.20115.46±10.9780.15±9.57LPS+si-TLR4864.2±22.4&2 454.36±216.32&6.23±0.47&143.69±11.86&147.65±12.89&102.58±11.64&
*P<0.05vscontrol group;&P<0.05vsLPS group.
TLR4是TLRs家族中最为重要的成员之一,是天然免疫过程识别病原体的关键受体,在几乎人类的所有细胞中均有表达,其可以分为跨膜区、胞内区和胞外区,参与调控细胞的多种生理功能[16-17]。TLR4参与炎症和细胞生长等过程,在肿瘤、肺损伤和心肌损伤等疾病中具有调控作用,TLR4表达上调可以促进炎症反应、抑制细胞生长[18-20]。目前的研究显示,TLR4在急性胰腺炎腺泡细胞中表达水平升高,并且可能参与胰腺腺泡细胞损伤和炎症因子分泌过程[21]。本实验表明,LPS处理后的胰腺腺泡AR42J细胞中的TLR4的表达水平升高,敲低TLR4后的胰腺腺泡AR42J细胞活力升高,细胞分泌的TNF-α等炎症因子水平降低,提示TLR4具有抗LPS诱导的胰腺腺泡细胞炎性损伤的作用。
胰腺腺泡细胞氧化应激是急性胰腺炎发生的重要原因之一。急性胰腺炎发生时,细胞产生大量的氧自由基,同时还伴随有抗氧化酶如SOD过度消耗,而胰腺腺泡细胞氧化损伤的发生与过度炎症反应有关[22]。细胞内过量的氧自由基可以靶向作用于细胞膜脂质中不饱和脂肪酸,生成MDA,细胞膜脂质被过氧化导致细胞膜完整结构被破坏,细胞内的MDA和LDH等被释放到细胞外,因此,检测细胞外LDH水平可以间接反应细胞损伤程度,检测细胞外MDA水平可以间接反应细胞氧化损伤程度[23-25]。有研究表明,TLR4不仅参与天然免疫反应,还具有促进细胞氧化应激作用,目前在急性肺损伤、大鼠脊髓损伤等中已经证实TLR4的作用[26-27]。本实验的结果表明,敲减TLR4表达的大鼠胰腺腺泡AR42J细胞经LPS诱导后,细胞培养液中SOD活性升高,MDA含量降低,提示敲减TLR4表达具有减轻LPS诱导的胰腺腺泡细胞氧化损伤作用。
综上所述,TLR4参与急性胰腺炎腺泡细胞损伤,其在LPS诱导的胰腺腺泡AR42J细胞损伤中高表达,敲减其表达一方面可能通过减少胰腺腺泡AR42J细胞分泌炎症因子,从而降低炎症因子对胰腺腺泡细胞炎性损伤,另一方面敲减TLR4可能通过降低胰腺腺泡细胞氧化应激水平发挥抗LPS损伤作用。这对于研究急性胰腺炎发病机制具有重要意义。TLR4的具体调控机制尚未明确,还需要在以后的实验中进行验证。本实验存在一定的局限性,比如没有在原代胰腺腺泡细胞中进行验证,后续实验将对上述部分进行探讨。
