蛇六谷提取物抑制K562细胞增殖并诱导分化的作用*
2019-04-22高瑞兰赵燕娜余潇苓尹利明
李 赛, 潘 磊, 高瑞兰, 赵燕娜, 余潇苓, 尹利明△
(1浙江中医药大学第一临床医学院, 浙江 杭州 310053; 2浙江中医药大学附属第一医院, 浙江 杭州 310006)
蛇六谷是天南星科(Araceae)魔芋属(Amorphophallus)多年生草本植物的干燥块茎,又名魔芋、蒟蒻。经考证,浙江地区药用“蛇六谷”为花魔芋的块茎[1-2]。本文所用蛇六谷提取物(the extract fromAmorphophalluskonjactuber,TuAKe)是天南星科魔芋属花魔芋的干燥块茎,经用95%乙醇提取、乙酸乙酯萃取后再经石油醚萃取回收溶剂而成。研究表明,蛇六谷石油醚萃取物能明显抑制肿瘤细胞增殖[3-4];当前蛇六谷多用于胰腺癌、乳腺癌和恶性淋巴瘤等恶性肿瘤中,对白血病的治疗仍未有确切报道。
材 料 和 方 法
1 主要试剂
人慢性髓系白血病细胞株K562由浙江省中医院血液病研究所保存。IMDM培养基购自Gibco;小牛血清购自杭州四季青公司;TuAKe由浙江省中医院中药房用天南星科魔芋属花魔芋的干燥块茎以95% 乙醇提取、乙酸乙酯萃取后再经石油醚萃取回收溶剂制成;PE标记的小鼠抗人CD11b、CD14和CD42b 抗体购自BD;抗细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)、细胞周期蛋白E1(cyclin E1)和红系分化核转录因子GATA-1抗体购自 Cell Signaling Technology(CST);抗β-actin抗体购自联科生物技术有限公司。
2 主要方法
2.1细胞培养和实验分组 将K562 细胞常规培养于含10%胎牛血清的IMDM完全培养基中,置于37 ℃、5% CO2、饱和湿度培养箱中培养,隔天换液。TuAKe用IMDM培养基配成所需浓度, 脂溶物以DMSO助溶, DMSO 最终浓度小于0.1%。实验分为对照(control)组、50 mg/L TuAKe组和100 mg/L TuAKe组。
2.2瑞氏-姬姆萨染色观察细胞形态的改变 取对数生长期的K562 细胞,调整细胞浓度至1×108/L,分别加入不同浓度的TuAKe,分别接种于6孔培养板,每孔2×105细胞(3 mL),TuAKe终浓度分别为0、50 和100 mg/L。上述培养体系置37 ℃、5% CO2及饱和湿度的培养箱中,隔天换液,培养3 d 后收集细胞,细胞离心涂片机制作细胞涂片。瑞氏-姬姆萨复合染色法染色,倒置显微镜下观察细胞形态变化。
2.3MTT比色法检测细胞活力 取对数生长期的K562细胞,调整细胞浓度至1×108/L,将各组细胞分别接种于96孔培养板,每孔2×104/L细胞(200 μL),复种6孔。上述培养体系置37 ℃、5% CO2、饱和湿度培养箱中培养72 h后,加入浓度为5 g/L 的MTT 20 μL,在相同条件下继续孵育4 h。离心弃上清,每孔加入DMSO 150 μL,微量振荡器振荡5 min,使结晶完全溶解,酶标仪检测490 nm波长的吸光度(A)值,计算各实验组细胞生长的抑制率。该实验重复3次。细胞生长抑制率(%)=(对照组A值-实验组A值)/对照组A值×100%。
2.4K562细胞半固体集落形成实验 计数并调整细胞浓度为5×106/L,进行K562白血病细胞集落培养,培养体系为IMDM培养液、30%新生牛血清、1% L-谷氨酰胺、100 U青/链霉素和0.3%琼脂,接种于24孔板,每孔2.5×102个细胞(0.5 mL),重复3 孔。置于37 ℃、5% CO2的饱和湿度培养箱中培养7 d。以大于40个细胞的聚合为1个K562白血病细胞集落,记录K562的细胞集落数,并计算抑制率(%)=(对照组集落数-实验组集落数)/对照组集落数×100%。同样的实验重复3次。
2.5流式细胞术检测细胞周期分布 收集各组细胞,PBS洗涤并调整细胞浓度为1×109/L,各组取100 μL细胞悬液,按试剂盒说明书将1 mL DNA staining solution和1 μL permeabilization solution分别加入各组细胞悬液中,4 ℃孵育30 min,流式细胞术检测各组细胞周期,每个检测标本记录10 000个细胞。MFL T32软件进行细胞周期分析。同样的实验重复3次。
2.6流式细胞术检测分化相关抗原阳性表达率 收集各组细胞,PBS洗涤并调整细胞浓度为1×109/L,取100 μL细胞悬液分别加入抗分化相关抗原CD11b、CD14和CD42b 的单克隆抗体,4 ℃孵育30 min,PBS洗去未结合的抗体,流式细胞术检测细胞阳性表达率,每个检测标本记录10 000个细胞。DIVA软件进行阳性率的分析。同样的实验重复3次。
2.7Western blot法检测K562细胞周期相关蛋白的表达 按照本研究所已报道的方法,采用细胞裂解液(含50 mmol/L TRIS、150 mmol/L NaCl、1% Triton X-100和蛋白酶抑制剂)提取总蛋白。制备SDS-PAGE凝胶,上样量为每孔40 μg,80 V电泳6 h,电压100 V转膜1 h,将蛋白条带转至NC膜上,PBST洗膜3次,5% BSA封闭1 h,分别加抗CDK2、cyclin E1和GATA-1等抗体,4 ℃孵育过夜,PBST洗膜3次后加入Ⅱ抗(购自联科生物)孵育1 h,经充分洗涤后用ECL发光剂采用灰度扫描系统测定并分析目的蛋白条带。同样的实验重复3次。
3 统计学处理
用SPSS 19.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 TuAKe诱导细胞形态学的改变
镜下显示,TuAKe作用K562细胞3 d,相较于对照组,50和100 mg/L剂量组可见不同程度的细胞体积增大,细胞内可见空泡,胞浆丰富,细胞核偏向一侧,部分甚至出现裸核等形态学改变,见图1。
2 TuAKe抑制K562细胞增殖
TuAKe处理K562细胞3 d,50和100 mg/L TuAKe 组的A值明显低于对照组(P<0.01)。TuAKe处理K562细胞7 d,50和100 mg/L TuAKe组K562细胞的集落数明显低于对照组(P<0.01),见图2。
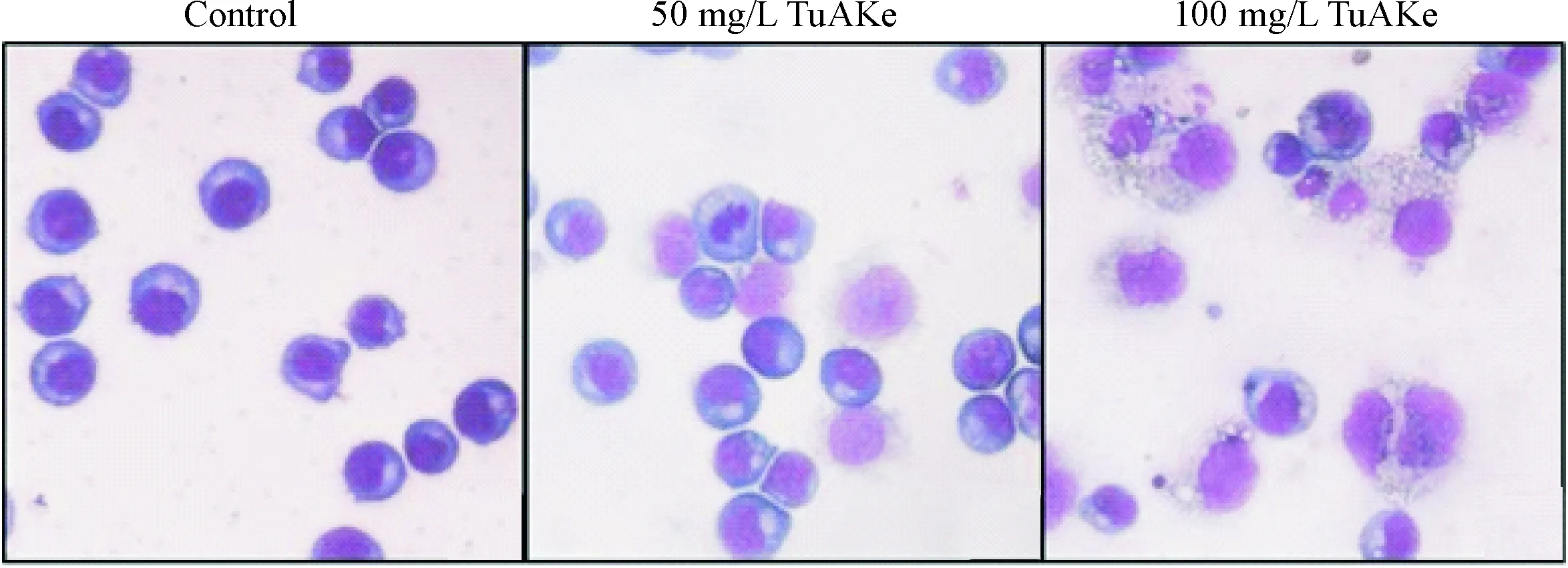
Figure 1.The morphological changes of K562 cells induced by TuAKe (×400).
图1TuAKe对K562细胞形态的影响
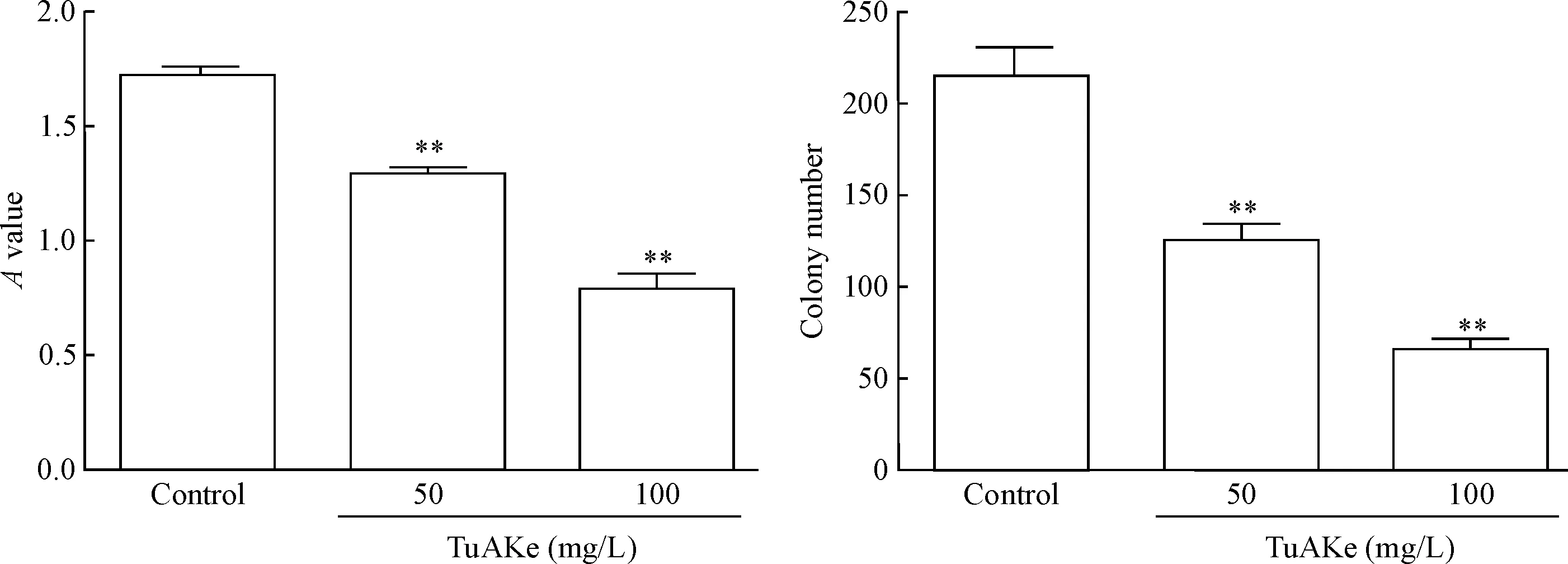
Figure 2.The viability of K562 cells detected by MTT assay and colony formation assay. Mean±SD.n=3.**P<0.01vscontrol group.
图2MTT实验和集落形成实验证实TuAKe抑制K562细胞增殖
3 TuAKe对K562 细胞周期分布的影响
分别处理K562细胞3 d,流式细胞术分析细胞周期分布情况,结果显示在TuAKe作用下,50和100 mg/L组G0/G1期的细胞比例明显增高,G2/M期的细胞比例明显增加,S 期细胞比例逐渐下降(P<0.05),见图3。
4 TuAKe提高K562 细胞分化相关抗原阳性表达率
TuAKe处理K562细胞7 d,流式细胞术检测K562 细胞分化程度,结果显示K562细胞分化相关抗原CD11b、CD14和CD42b的阳性表达率均明显高于对照组(P<0.01),见图4。
5 TuAKe对K562细胞CDK2、cyclin E1和GATA-1蛋白表达水平的调节作用
Western blot 实验结果显示,随着药物浓度增加,TuAKe能够下调K562细胞的CDK2和cyclin E1的表达,上调GATA-1的表达(P<0.05或P<0.01),见图5。
讨 论
Cyclin E1调控细胞从G1期向S期转换,通过激活CDK2,调控细胞的有丝分裂过程[5]。Cyclin E-CDK2复合物是细胞从G1期进入S 期的关键激酶,能促进细胞由G1期向S 期转化,从而促进细胞增殖[6-8]。Cyclin E1表达上调是诱导细胞周期调控异常导致肿瘤发生的主要原因之一。研究表明[9],cyclin E1在多种肿瘤细胞中过度表达,在肿瘤细胞中其表达见于整个细胞周期。我们的实验结果显示,TuAKe处理K562细胞72 h,下调细胞周期蛋白cyclin E1和周期蛋白依赖性激酶CDK2的表达,抑制细胞进入S期,同时细胞阻滞在G2/M 期;同时,我们观察到,浓度为50和100 mg/L TuAKe能够显著减少K562细胞集落形成的,抑制K562细胞增殖,抑制率达到41.9%~69.1%。MTT结果显示50~100 mg/L TuAKe可明显抑制K562细胞活力,抑制率达到25.1%~53.8%,说明TuAKe通过下调cyclin E1和CDK2的表达,部分阻滞K562细胞从G2/M进入S期,抑制K562细胞增殖。
诱导分化是指利用分化诱导剂,不杀伤肿瘤细胞,诱导其细胞形态、功能及生物学行为等综合指标向正常细胞靠拢,使恶性肿瘤细胞具有分化为正常或接近正常细胞的能力。研究表明,K562细胞在体外被药物诱导后可向巨核系、粒系、单核系或红系分化[10-12]。我们观察了TuAKe对K562细胞分化的诱导作用,结果显示,在50~100 mg/L浓度范围内K562细胞可诱导K562细胞分化。K562细胞的形态也发生变化,相较于对照组,各剂量组出现不同程度的细胞体积增大,细胞内空泡,细胞核侧偏等形态学改变。我们检测了粒系分化抗原CD11b、粒-单系细胞分化抗原CD14、巨核系分化抗原CD42b和红系分化蛋白GATA-1,结果显示分化相关抗原阳性表达率皆有不同程度的增高,红系分化蛋白GATA-1表达增高,其促进分化相关抗原阳性表达的作用呈现出浓度依赖性,而50~100 mg/L剂量组范围,各系分化的差异具有统计学意义,说明TuAKe具有较强的诱导K562细胞多向分化的能力。
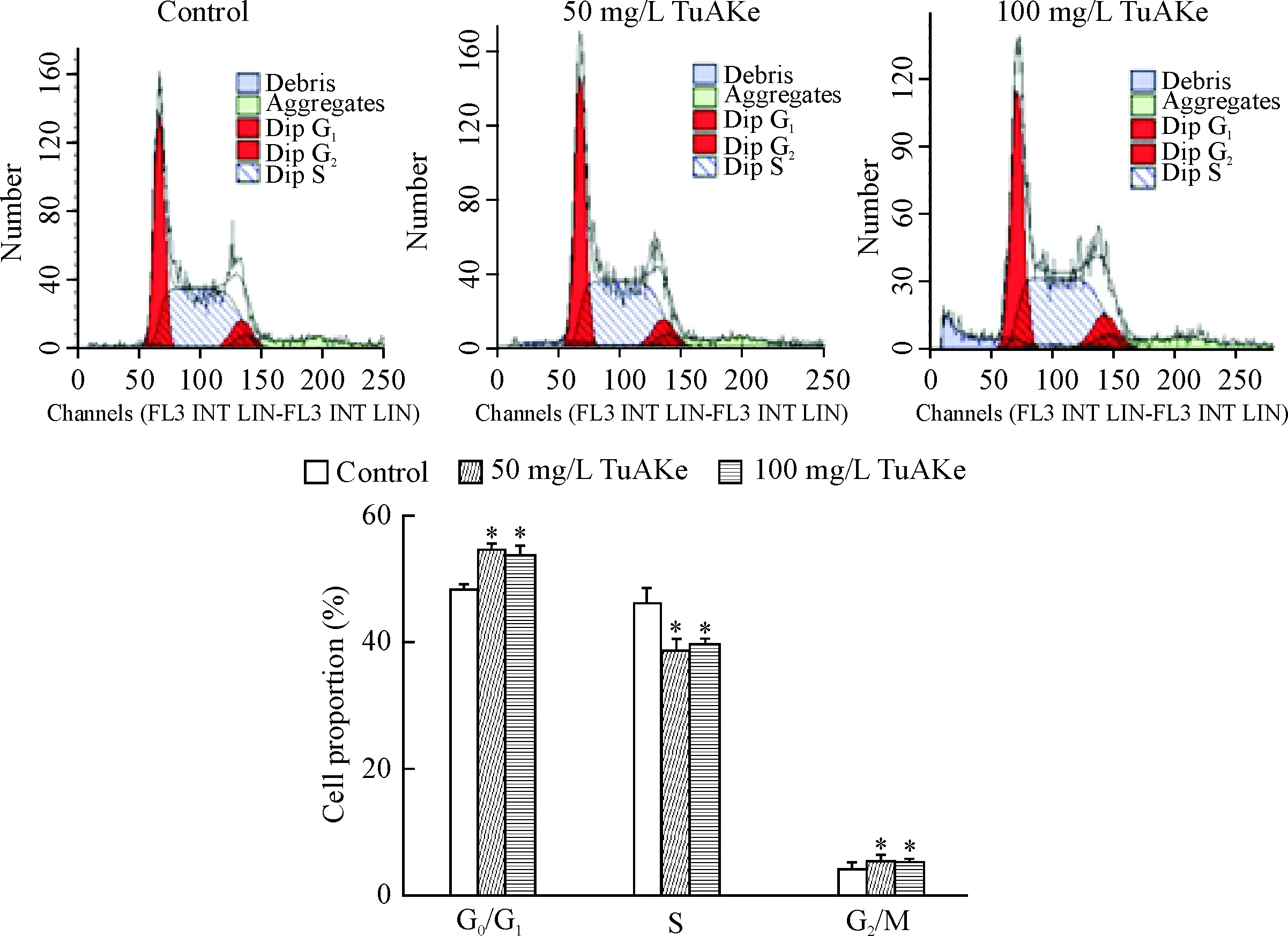
Figure 3.TuAKe changed the cell cycle distribution of the K562 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3TuAKe对K562细胞周期分布的影响
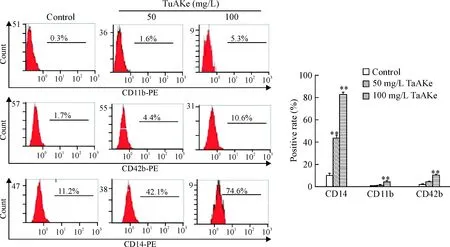
Figure 4.TuAKe changed the differentiation of the K562 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图4TuAKe对K562细胞分化的影响
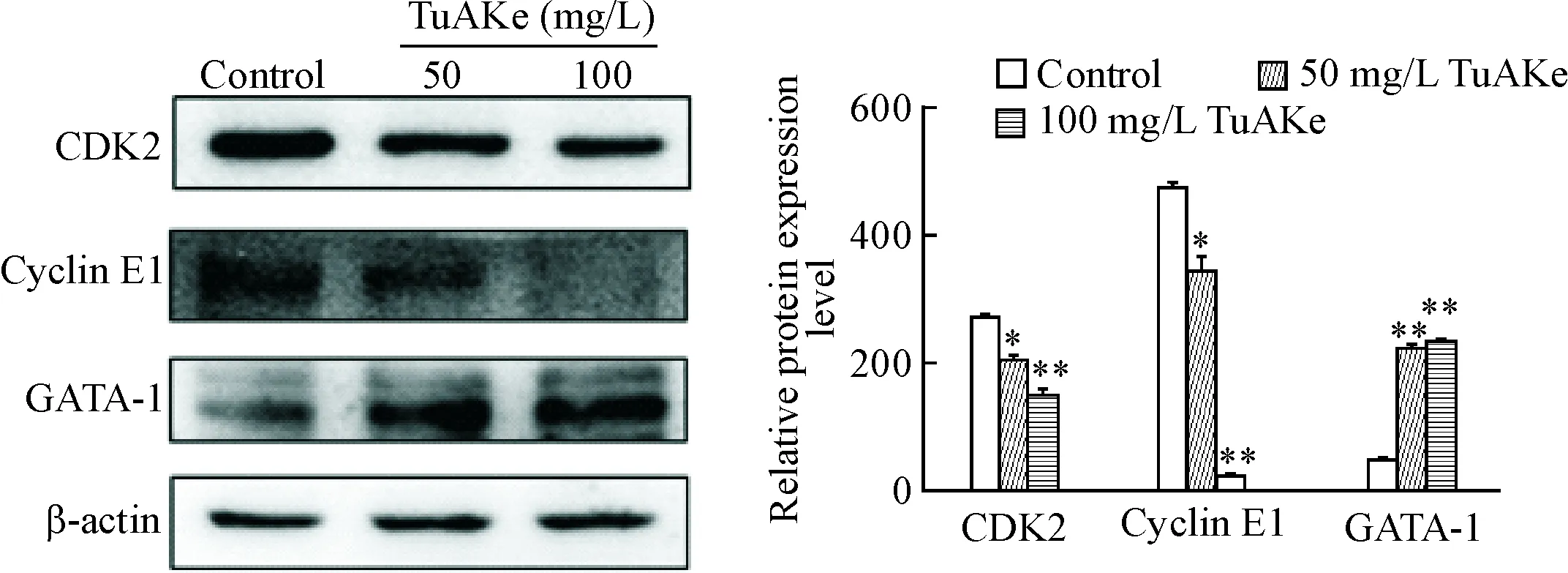
Figure 5.TuAKe regulated the protein expression of CDK2 and cyclin E1 in the K562 cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图5TuAKe对K562细胞周期蛋白表达水平的调节作用
目前人们试图找到特异性更高、作用点更明确、不良反应更小的药物来抑制CDK2及其相关蛋白的活性,从而阻止肿瘤细胞的增殖以达到控制甚至根治肿瘤的目的已成为人们治疗肿瘤的新方向[13-15]。TuAKe是目前常用的抗肿瘤及抗肿瘤转移的中药,但目前对TuAKe杀死肿瘤细胞的有效化学成分、作用机制以及有效作用靶点尚不明确,对其毒性成分及其机制的研究也很少,所以作为抗癌中药,TuAKe有着很高的研究价值,本研究首次将TuAKe应用于慢性髓系白血病细胞株K562细胞增殖抑制研究中,并初步证实TuAKe抑制K562细胞增殖并诱导分化,其抑制K562细胞增殖的作用是通过下调cyclin E1和CDK2的表达并将细胞阻滞在G2/M期而实现的。
