利用MHC-I/肽结合的预测与免疫学实验相结合的方法鉴定肿瘤抗原表位*
2019-04-22李清扬宋婵婵李亮平
李清扬, 胡 伟, 宋婵婵, 李亮平
(暨南大学附属第一医院临床肿瘤研究所, 广东 广州 510630)
近年来,用肿瘤抗原特异性T细胞开展肿瘤过继细胞治疗在临床试验中取得了明显疗效。目前这一肿瘤治疗新策略已得到了广泛的重视,具有重大应用前景[1-3]。肿瘤抗原蛋白质中的抗原肽需要经过细胞内蛋白水解酶的切割以及一系列处理加工,形成9~14个氨基酸残基的短肽(抗原表位),与主要组织相容性复合体(major histocompatibility complex, MHC)肽槽结合并被提呈转移到细胞表面,T细胞借助多样性的肿瘤抗原特异性T细胞受体(T-cell receptor,TCR)识别各种对应的MHC/肽复合体[4]。人类的MHC分子称为人类白细胞抗原(human leukocyte antigen,HLA)。
用克隆的肿瘤抗原特异性TCR 修饰T细胞,将普通T细胞改造为抗癌T细胞,靶向肿瘤抗原表位,可以治疗各种肿瘤(TCR-T细胞治疗)。肿瘤抗原表位作为TCR识别的靶标,是肿瘤免疫治疗研发的基础。因此,建立肿瘤抗原表位的快速鉴定技术对肿瘤免疫治疗具有重要意义。然而传统抗原表位的鉴定方法需要借助复杂的技术分析HLA/肽复合物与TCR特异性结合产生的免疫反应,实验过程繁琐,耗时耗力。随着HLA分子结构学和计算机算法的进展,许多研究建立了以西方人常见的HLA-A2为基础的MHC/肽亲和力预测技术,简化了抗原表位的鉴定方法,但针对中国人常见的HLA分子(如A11和A24等)的研究较少。
本研究选择3种常见的肿瘤/睾丸抗原(cancer/testis antigen, CTA) NY-ESO、MAGE-A1和KK-LC-1作为研究对象,选择中国人常见的HLA I 类分型,借助MHC/肽结合预测技术建立中国人常见的HLA I 类限定的抗原表位预测方法,通过分子免疫学实验快速验证KK-LC-1抗原预测的结果。该实验技术为快速有效地鉴定肿瘤抗原表位提供了新途径,为下一步克隆特异性TCR基因和TCR-T细胞治疗提供了参考资料。
材 料 和 方 法
1 外周血白细胞
为了选择合适的HLA血液供者,本研究召集6名年龄20~35岁无传染性疾病的中国志愿者。根据暨南大学附属第一医院伦理委员会的标准,所有招募的志愿者均签署知情同意书。用SBT 技术对志愿者的外周血单个核细胞(peripheral blood mononuclear cells, PBMC)进行HLA分型。
2 主要试剂
RPMI-1640培养液、青霉素、 链霉素和L-谷氨酰胺购自中国赛默飞世尔公司;人细胞因子白细胞介素2(interleukin-2, IL-2)、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophoge colony-stimulating factor, GM-CSF)、IL-4、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、IL-1β和IL-6购自PeproTech;ELISPOT试剂盒和人淋巴细胞分离液(Ficoll)购自中国达科为生物技术公司;流式细胞分析用抗人抗体[CD83-PE/CY5(305310)、CD86-APC(305412)、CD3-FITC(300406)、 CD4-APC(300514)、CD8-APC/Cy7(301016)和 CD137-PE(309804)]购自Biolegend。
3 主要方法
3.1肿瘤抗原表位的预测 根据2013年中华骨髓库发布的《中国常见及确认的HLA等位基因表(CWD)》[5],中国人群中>1%的HLA等位基因有35个(频率大于10%有6个等位基因:A*11:01,20.9%;C*01:02,15.9%;A*24:02, 15.5%;C*07:02,15.2%;A*02:01,12.0%;B*46:01,10.3%)。实验选定这35个常见的HLA等位基因,为了缩小表位筛选范围和防止漏筛,用NetMHC 4.0以及NetMHCpan 4.0(http://www.cbs.dtu.dk/ser-vices/NetMHC/)MHC/肽结合分析软件,对MAGE-A1、NY-ESO和KK-LC-1的全长蛋白质序列进行HLA I型抗原表位和亲和力的预测。选择的参数为:表位的长度设定为9mer-11mer,肽的排序(Rank值)按MHC/肽结合亲和力排列,强结合(strong binding, SB)为%Rank≤0.50,弱结合(weak binding, WB)为%Rank≤2.0。设定条件后,输入抗原蛋白质氨基酸序列,得到预测结果。选出标有SB和WB的预测表位和肽亲和力等参数资料,对中国人群常见HLA分型的肿瘤抗原表位,用BLAST软件进行表位位置比对和分析。
3.2HLA分型供体的选择与肽的合成 采集志愿者血液测序(华大基因公司),用基因分型法(Sequencing Based Typing,SBT)进行HLA 分型检测。结合表位预测和志愿者HLA预测结果,选择含有中国人群常见的HLA-A*11:01和HLA-B*46:01等位基因的志愿者作为健康血液捐献者,携带HLA-B*46:01的志愿者编号为D001,携带HLA-A*11:01的志愿者编号为D002。为了简化实验验证的复杂性,选择蛋白质较小的KK-LC-1表位进行进一步研究。为了避免抗原短肽不需要蛋白质水解加工直接与MHC分子结合产生假阳性结果的可能性,模拟细胞内抗原肽处理加工过程,选择KK-LC-1预测结果中强结合表位,在预测表位的基础上前后延伸,合成19mer长肽氨基酸序列。对最佳实验的长肽,合成相对应的表位短肽。肽由上海生工生物工程公司采用固相合成法合成,采用HPLC纯化,纯度≥90%,产品进行ESI质谱检测,保证序列正确。
3.3免疫细胞分离与培养 采集志愿者血液,用Ficoll密度梯度离心法分离PBMC。新鲜抗凝血与PBS液1∶1混匀后小心加入与血液等体积的Ficoll细胞分离液液面上,800×g离心20 min。收集中间的PBMC层,再用PBS混合,以200×g离心10 min,洗涤2次。树突状细胞(dendritic cells,DC)制备与培养:(1)将分离的PBMC用 RPMI-1640培养液调节密度为1.0×107/L,置于6孔板内,放置于37 ℃、5% CO2培养箱中孵育2 h贴壁;洗去悬浮细胞,贴壁细胞继续用RPMI-1640培养液,并添加人GM-CSF(1×106U/L)、人IL-4 (5×105U/L)和10%自体血清,37 ℃、 5% CO2培养箱中培养;(2)3天后半量换液并补足细胞因子;(3)第6天加入人TNF-α 2.0×105U/L),IL-1β(1.0×107U/L)和IL-6 (1.0×106U/L),诱导DC细胞成熟;(4)第8天收获成熟DC(mature DC, mDC)。通过两步诱导分化的实验条件,可以在8 d内利用1×107个PBMC获得1.0×106个mDC。T 细胞培养:去除贴壁细胞剩下的悬浮细胞用于培养T细胞,培养液为RPMI-1640、1.0×105U/L青霉素、100 mg/L链霉素、2 mmol/L-谷氨酰胺、10%自体血清和3.0×104U/L IL-2,每3天半量换液并补充3.0×104U/L IL-2,每7 d开始新一轮抗原刺激培养。
3.4抗原特异性T细胞的刺激 DC加载肽体外激活T细胞以测试长肽的反应性。第1轮刺激:PBMC置于6孔板中(每孔1.0×107),培养液为RPMI-1640 + 10%自体血清+2.0×104U/L IL-2,并加入合成的长肽(5 mg/L),置于37 ℃、 5% CO2培养箱中培养7 d,3 d后换液1次并补充细胞因子。第2轮刺激:用mDC细胞提呈抗原,将第1轮刺激扩增后的T细胞与mDC以10 ∶1的比例继续加肽(5 mg/L)刺激培养,置于37 ℃、 5% CO2培养箱中培养7 d,3 d后换液1次并补充细胞因子。第3轮刺激:重复第2轮的步骤。用经过肽-DC刺激3周后的T细胞检测抗原激活的T细胞反应性指标(IFN-γ的分泌与CD137上调),用酶联免疫斑点法(ELISPOT)检测T细胞产生分泌的IFN-γ,用流式细胞术检测T细胞CD137的上调。
3.5酶联免疫斑点测定 将T细胞(每孔1.0×105个)与mDC(每孔1.0×104个)置于用IFN-γ单抗预包被的培养孔中, 用RPMI-1640培养。实验组加入多肽(5 mg/L),对照组孔不加肽,阳性对照孔加入植物血凝素(phytohaemagglutinin, PHA)。每组各重复1次。检测板置于37 ℃、 5% CO2培养箱中培养22 h后,按试剂盒说明书进行显色检测。对检测条扫描拍照,并进行IFN-γ斑点记录统计。
3.6流式细胞检测 将T细胞(每孔1.0×105)与mDC细胞(每孔1.0×104)置于96孔板中,用RPMI-1640进行培养。实验组加入多肽(5 mg/L),对照组孔不加肽。20~24 h后,实验组和对照组各重悬细胞于400 μL的PBS,将细胞等分成2部分,一部分加入2 μL不同荧光标记的CD3、CD4、CD8和CD137抗体,另一部分用同型抗体(isotype)做阴性对照染色。室温避光孵育20 min,PBS洗涤2次后重悬细胞,用BD FACS Canto 流式细胞仪(BD Bioscience)检测染色的细胞,用同型抗体染色的细胞设定各种条件荧光抗体的检测参数(激光电压等),设定条件后检测实验组的细胞。用BD FACS Canto软件和FlowJo软件分析流式检测数据,确定CD3+CD4+CD137+以及CD3+CD8+CD137+的T细胞亚群分布情况。
4 统计学处理
用SPSS 16.0和GraphPad Prism 6.0统计软件分析数据,数据均用均数±标准差(mean±SD)表示,两组间比较采用独立样品t检验,以P<0.05为差异有统计学意义。
结 果
1 肿瘤抗原表位的预测
MAGE-A1、NY-ESO和KK-LC-1抗原与中国人群中>1%的35个HLA等位基因结合的预测表位在蛋白质序列中的位置分析显示,抗原表位的位置各有所不同,NY-ESO的表位高度集中在2个部位,MAGE-A1的表位分布较均匀,KK-LC-1的表位大部分位于蛋白质多肽的前部,见图1。其中针对中国人群中>10%的6个HLA等位基因,MAGE-A1有36肽,NY-ESO有22肽,KK-LC-1有12肽,见表1。上述结果表明这3个CTA中含有许多中国人常见的HLA分型提呈的表位,可以用作T细胞识别的靶标,其中KK-LC-1蛋白序列最少,位点最易分析,因此选择KK-LC-1做进一步实验。

Figure 1.Location of the predicted epitopes of tumor-associated antigens. The predicted epitopes of three TAAs were analyzed with NCBI protein BLAST software to localize the position of epitopes within proteins. The predicted strong binding epitopes restricted by HLA-A/B/C greater than 1%frequency in Chinese population were shown. A: NY-ESO; B: MAGE-A1; C: KK-LC-1.
图1肿瘤相关抗原预测表位的位置
表1中国人群中频率大于10%的HLA所限定的抗原表位个数
Table 1.Numbers of the epitopes defined by HLA with a frequency greater than 10% in the Chinese population
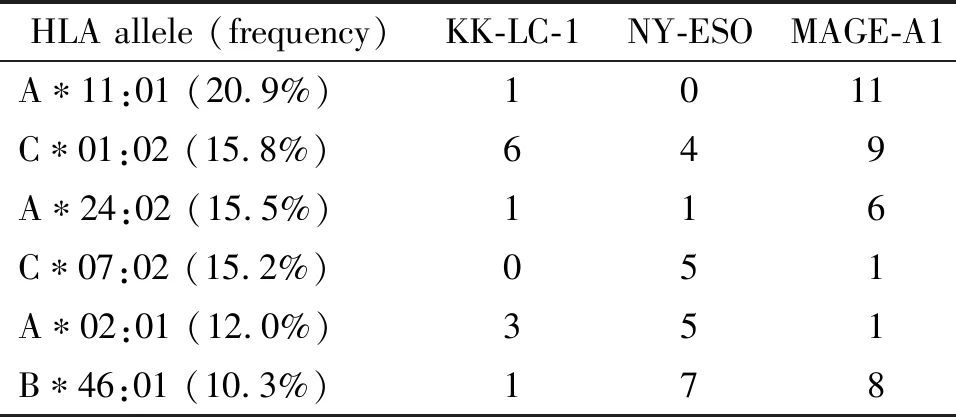
HLA allele (frequency)KK-LC-1NY-ESOMAGE-A1A∗11:01 (20.9%)1011C∗01:02 (15.8%)649A∗24:02 (15.5%)116C∗07:02 (15.2%)051A∗02:01 (12.0%)351B∗46:01 (10.3%)178
2 健康志愿者HLA分型与抗原表位的选择
志愿者D001和D002的HLA分型检测结果显示,D001携带HLA-B*46:01,D002携带 HLA-A*11:01,见表2。KK-LC-1抗原表位与中国人群中>10%的HLA等位基因的分析预测结果显示,5个常见HLA限定的KK-LC-1强结合抗原表位有12个,见表3。根据表位预测与志愿者HLA分型检测结果, 选择设计合成2个长肽:与HLA-B*46:01匹配的长肽氨基酸序列为LASSILCALIVFWKYRRFQR;与HLA-A*11:01匹配的长肽氨基酸序列为LSRDILNNFPHSIARQKRI。

表2 实验志愿者PBMCs的HLA分型
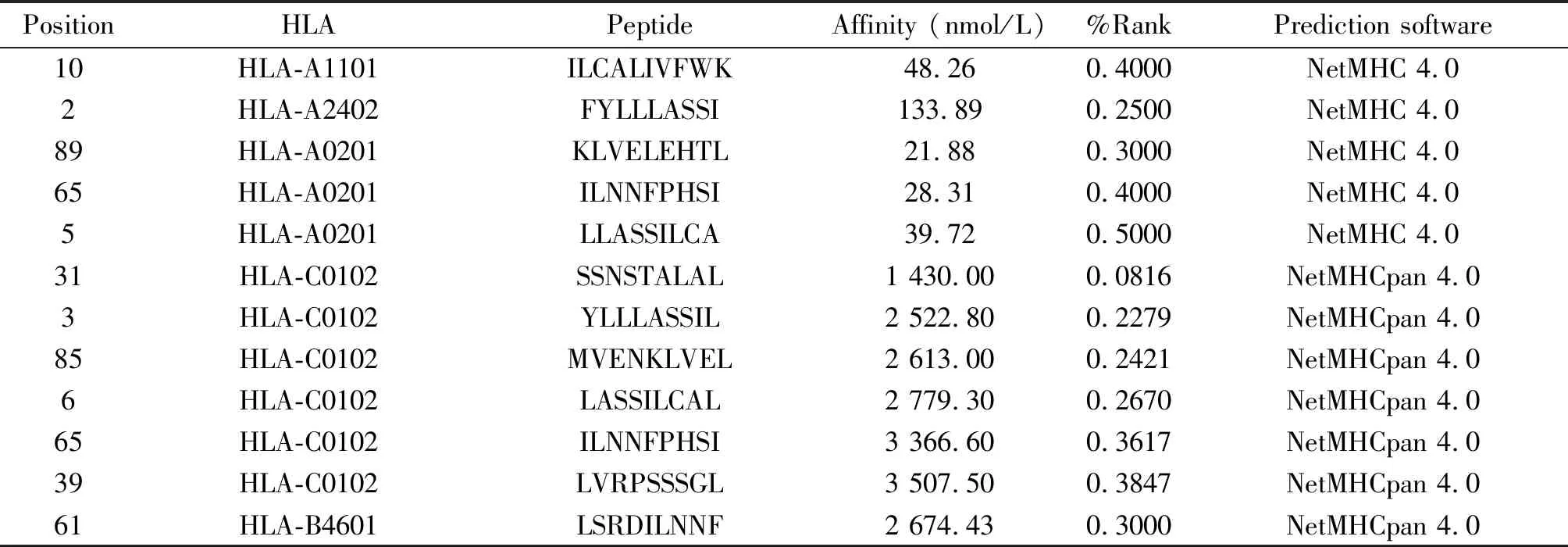
表3 KK-LC-1抗原HLA I型强结合肽表位预测
3 KK-LC-1长肽刺激T细胞产生的抗原特异性反应
从PBMC中制备抗原提呈功能最强的mDC,光镜下呈葡萄状,见图2A;流式细胞术结果显示表达mDC特有的CD83和CD86表面标志,见图2B。用mDC加载抗原长肽刺激T细胞,实验组的T细胞经mDC提呈的长肽刺激后呈现比对照组更明显的细胞聚团现象,见图3。刺激结果提示长肽被吞噬加工提呈到细胞表面,可以刺激抗原特异性T细胞活化,产生扩增反应。
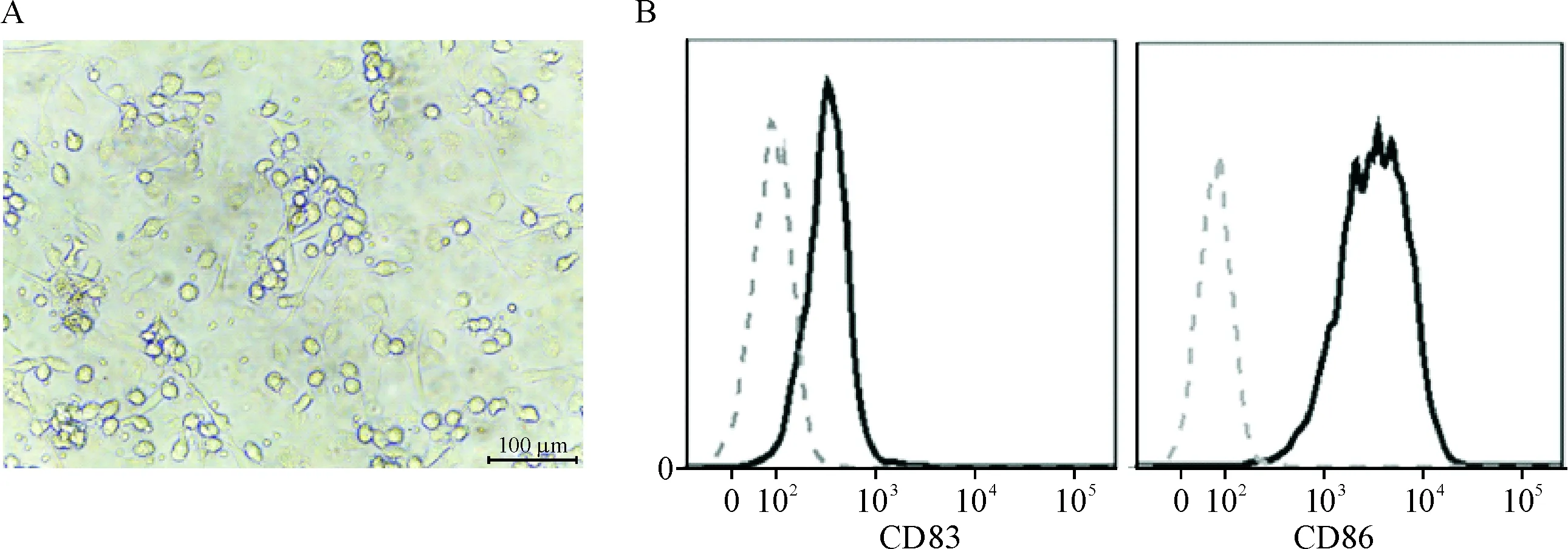
Figure 2.Identification of mDC. A: morphology of mDC under microscope; B: expression of the mDC markers CD83 and CD86 mea-sured by flow cytometry.
图2成熟DC的形态和分子标志鉴定
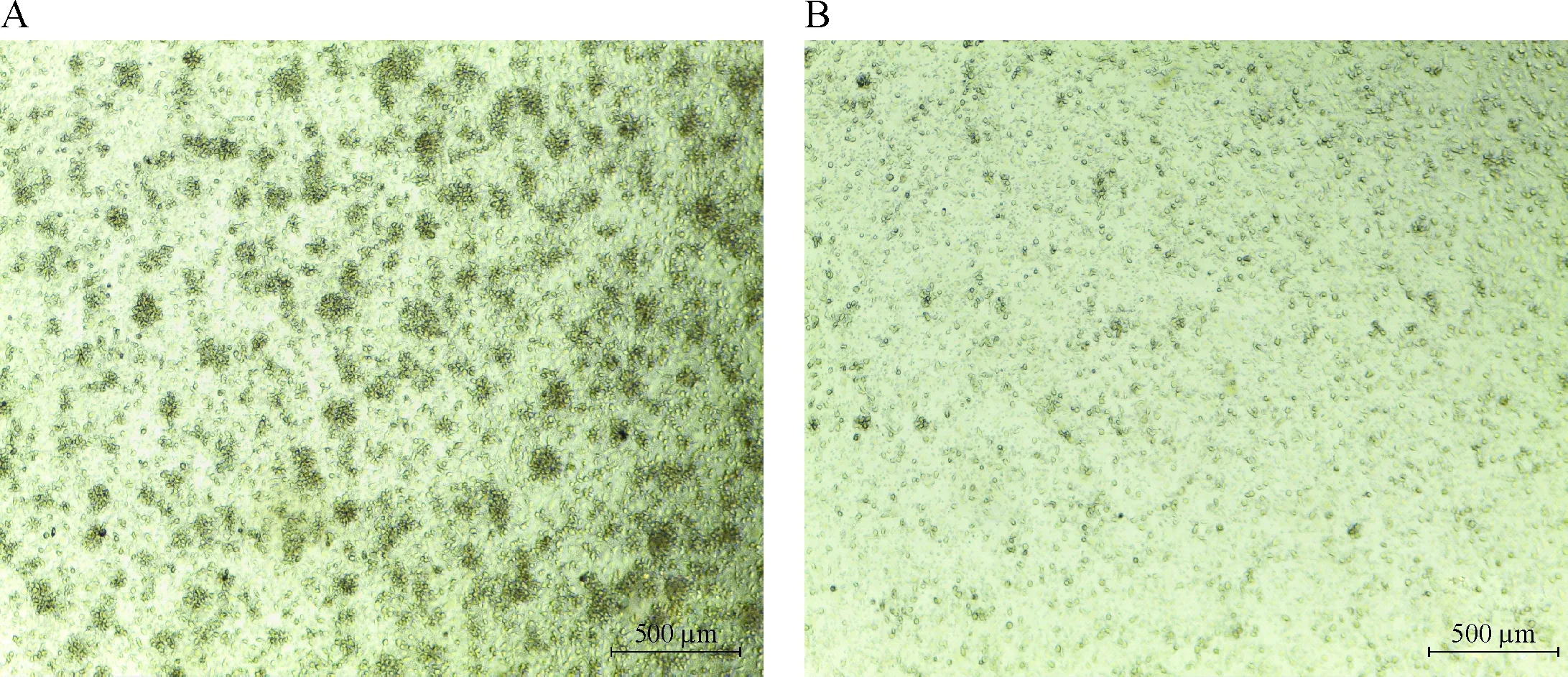
Figure 3.Microscopic morphology of the peptide-activated T cells (culture for 3 weeks). A: experimental group, T cells and DC cells were stimulated by peptide; B: control group, T cells and DC cells without peptide.
图3T细胞刺激的镜下形态
IFN-γ ELISPOT实验结果显示,刺激3周后,与只有T细胞和DC的对照组对比,D001加载LSRDIL肽的T细胞释放IFN-γ斑点数显著增高(P<0.05),见图4A; D002加载LASSIL肽的T细胞释放IFN-γ斑点数亦显著增高(P<0.05),见图5A。
对D001的T细胞选择LSRDIL肽刺激后进行流式细胞术检测,加肽的实验组中CD137阳性表达CD8+T细胞对比不加肽的对照组显著增高(P<0.05),见图4B,说明经抗原刺激后,D001组有针对LSRDIL肽的特异性CD8+T细胞。对D002的T细胞选择LASSIL肽刺激后进行流式细胞术检测,加肽的实验组中CD137阳性表达CD8+T细胞对比不加肽的对照组显著增高(P<0.05),见图5B,说明经抗原刺激后,D002组有针对LASSIL肽的特异性CD8+T细胞。
ELISPOT和流式细胞术结果显示KK-LC-1 2个长肽可刺激CD8+T细胞产生抗原特异性反应,表明长肽中含有KK-LC-1的HLA I类抗原表位,其中D002组长肽反应效果好,HLA-A*11:01是纯合子。因此用LASSIL长肽预测结合最强的表位合成短肽(序列为LCALIVFWK),进一步确定抗原表位。
4 KK-LC-1短肽刺激T细胞抗原特异性反应和CD137+ T细胞的分离
比较D002经LASSIL长肽和LCALIV短肽刺激后T细胞活化反应,IFN-γ ELISPOT结果显示: T细胞不加肽的对照组没有明显激活反应;LASSIL长肽组斑点数较多; LCALIV短肽组斑点数显著增高(P<0.05),见图6A。流式细胞术结果显示:LCALIV短肽组中CD137阳性表达CD8+T细胞与LASSIL长肽组和不加肽组相比均显著增高(P<0.05),见图6B。实验结果证明短肽比长肽刺激效果显著增高,能够更精确地确定抗原表位。
讨 论
肿瘤过继T细胞治疗的靶标为各种肿瘤抗原,确定抗原表位是特异性免疫治疗的基础。CTA在不同种类肿瘤细胞中均有一定的表达,在正常组织细胞中很少或没有表达。CTA是理想的抗肿瘤TCR药物研发靶标[6], 因此,我们选择CTA作为研究模型,建立抗原表位实验鉴定技术。基于本课题组李亮平等研究西方人常见的HLA-A2限定的MAGE-A1和NY-ESO肽的前期实验基础[7-8]及美国NIH的Rosenberg实验室最近关于KK-LC-1是一个免疫原性比较强的CTA抗原[9]的报道,首选NY-ESO、MAGE-A1和KK-LC-1作为研究模型,建立技术体系。
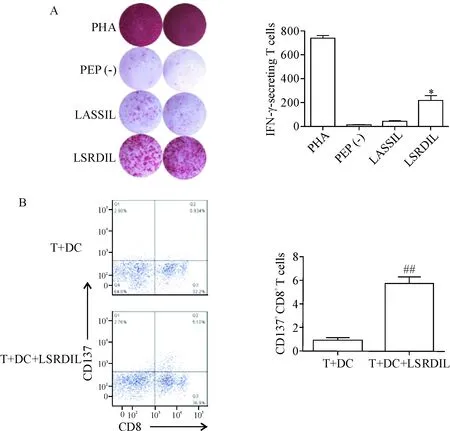
Figure 4.T-cell activation of D001 stimulated by the 2 long peptides of KK-LC-1. A: production of IFN-γ was measured by ELISPOT assay; B: flow cytometric detection of CD137. Mean±SD.n=3.*P<0.05vsPEP (-) group;##P<0.01vsT+DC group.
图4D001对KK-LC-12种长肽的反应
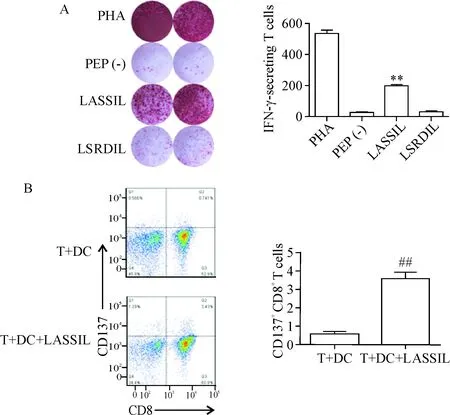
Figure 5.T-cell activation of D002 stimulated by the 2 long peptides of KK-LC-1.A: production of IFN-γ was measured by ELISPOT assay; B: flow cytometric detection of CD137. Mean±SD.n=3.**P<0.01vsPEP (-) group;##P<0.01vsT+DC group.
图5D002对KK-LC-12种长肽的反应
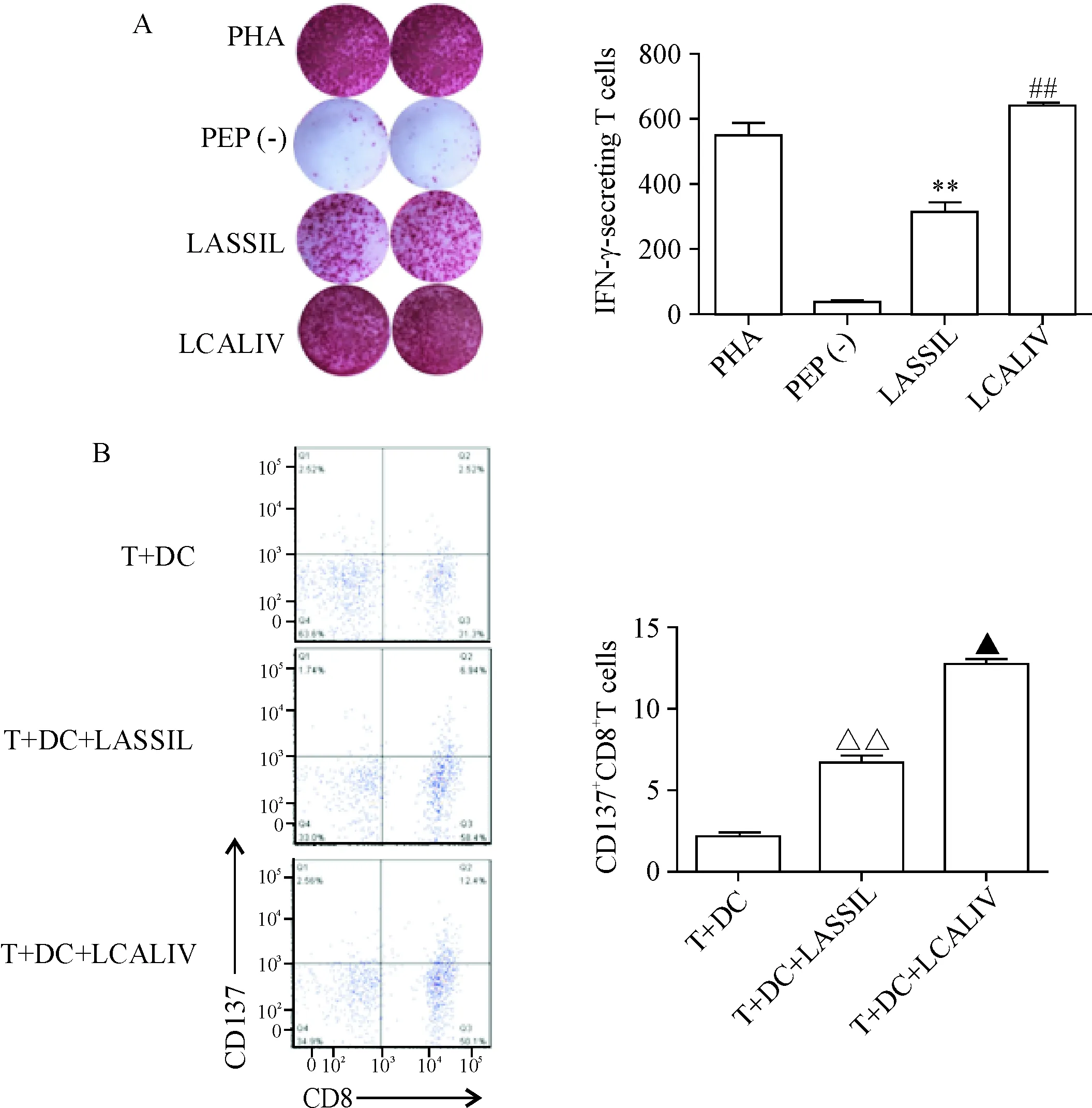
Figure 6.T-cell activation of D002 stimulated by LASSIL long peptide and LCALIV short peptide of KK-LC-1.A: production of IFN-γ was measured by ELISPOT assay; B: flow cytometric detection of CD137. Mean±SD.n=3.**P<0.01vsPEP (-) group;##P<0.01vsLASSIL group;△△P<0.01vsT+DC group;▲P<0.05vsT+DC+LASSIL group.
图6D002对KK-LC-1LASSIL长肽和LCALIV短肽的反应
传统的抗原表位鉴定[10-11]涉及复杂的技术。首先需要得到抗原反应性T细胞杂交瘤或T细胞系;合成完整抗原蛋白质,经过蛋白水解酶处理,形成大小不等的肽段,经过高效液相色谱法分离,用一系列分离的肽刺激T细胞杂交瘤或T细胞系产生反应,最终确定有刺激作用的肽段序列,即抗原表位。这些实验耗时耗力或者需要昂贵的设备。因此,建立快速有效的抗原表位鉴定技术显得十分重要。
随着HLA分子结构研究的进展,建立了以研究西方人常见的HLA-A2为基础的MHC/肽亲和力预测技术。根据免疫原性肽的氨基酸序列的分布特点,建立了预测肽与MHC分子结合的初步方法[12]。但这些预测方法不够准确,对中国人常见的HLA位点基因更不准确,难以确定肽/MHC的结合亲和力。
随着免疫原性肽资料的积累,HLA分子结构的解析精度的提高和计算机算法的改进,丹麦技术大学生物进样器生物序列分析中心的Morten Nielsen课题组建立了一种神经网络方法,改进了T细胞I类表位的预测[13]。新方法的性能大大高于其他方法,能更准确地预测抗原表位以及肽/MHC的结合亲和力。利用HLA/肽预测技术可以简化抗原表位的鉴定。
目前国际上的研究主要集中在西方人最常见的HLA-A*02:01等位基因上,针对中国人群常见HLA分型(如HLA-A*11:01和HLA-B*46:01等)匹配的肿瘤抗原则少有研究。我们针对中国人群常见的HLA I类分型,利用这一改进的预测工具对常见的CTA进行抗原表位预测,结果分析表明存在众多中国人常见HLA分子限定的抗原表位。
NY-ESO中西方人常见的等位基因HLA-A2限定的表位较多,MAGE-A1的分子量较大,实验分析相对复杂,而KK-LC-1有中国常见HLA分型(如A*11:01和B*46:01)限定的数个表位,易于实验验证。因此选择KK-LC-1抗原进行后续深入的验证研究。KK-LC-1是由Fukuyama等[14]于2006年发现的,陆续有研究表明KK-LC-1在81%胃癌[15]、53%三阴性乳腺癌[16]、40%转移性宫颈癌和40%非小细胞肺癌中表达[9],但不在除睾丸外正常的组织中表达,这表明它可能被T细胞安全地靶向。
由于肿瘤病人体内能引起有效T细胞免疫反应的抗原比例很低,加上免疫功能系统减弱,直接采集病人血液进行体外实验比较困难,因此采用健康人的PBMC进行刺激,健康人免疫系统未受肿瘤细胞的抑制及药物影响,具有更丰富的T细胞库,筛选到特异性T细胞的几率更大。
通过体外实验验证预测结果的有效性和可靠性:CD137和IFN-γ的双阳性结果表明长肽可刺激T细胞产生免疫活化反应,T细胞已被完全激活并开始行使功能,随即进行短肽刺激得到特异性更高的T细胞并确定精准抗原表位。预测的抗原表位结果与实验结果相匹配,表明预测结果准确,KK-LC-1可以作中国人群肿瘤特异性免疫疗法的新靶标。这一研究也为分离克隆肿瘤抗原特异性的TCR提供了基础,为TCR-T细胞治疗提供了可能性。
由于健康志愿者献血量有限,得到的特异性T细胞较少,目前难以直接进行功能性实验和动物实验。我们后续将建立RACE-PCR和单个T细胞TCR的基因扩增克隆与测序技术,以分离抗肿瘤TCR基因,在短时间里产生大量具有抗癌活性的T细胞,用于TCR-T细胞治疗研发。大量抗肿瘤TCR基因的分离与应用,将对肿瘤的T细胞免疫治疗领域产生重要的影响[17-18]。
综上所述,本研究建立了快速鉴定肿瘤抗原表位并确定精准抗原表位的技术方法,为分离抗癌T细胞以及相应的TCR基因提供了基础。快速鉴定技术的建立与推广,将有利于推动中国癌症病人的特异性免疫治疗(TCR-T)的开发与应用。
