HAPLN1通过IKK/p65信号通路诱导大肠癌HT-29细胞产生MTX耐药*
2019-04-22贺红柳崔美英冯晔子
贺红柳, 崔美英, 王 丰, 冯晔子, 袁 磊
(1郑州大学第一附属医院病理科, 河南 郑州 450052; 2郑州市第七人民医院心血管内科, 河南 郑州 450000; 3漯河医学高等专科学校漯河市医学生物工程重点实验室, 河南 漯河 462002)
大肠癌即结直肠癌(colorectal cancer,CRC)是威胁我国居民健康的主要恶性肿瘤之一。二十年前,中国大肠癌的发病率和死亡率均低于世界平均水平,但近年来其发病率逐年攀升,目前稳居恶性肿瘤发病谱第3位,其死亡率也高居肿瘤死亡原因第5位[1-2]。由于我国大肠癌早期筛查工作还未能广泛开展,大部分大肠癌患者在确诊时已属于中晚期[3]。目前对晚期大肠癌主要采用以化疗为主的综合治疗方案,但多药耐药性的产生是导致大肠癌化疗失败的主要原因之一[4]。因此如何逆转多药耐药性以改善大肠癌患者的预后仍是目前亟待解决的问题。活化的IKK/p65信号通路可通过上调多药耐药蛋白1(multidrug resistance protein 1,MDR1)、多药耐药相关蛋白1/2/3(multidrug resistance-associated protein 1/2/3,MRP1/2/3)和ATP结合盒转运体G2(ATP-binding cassette transporter G2,ABCG2)等导致大肠癌产生多药耐药性[5-7]。透明质酸蛋白聚糖连结蛋白1(hyaluronan and proteoglycan link protein 1,HAPLN1),是一种细胞外基质蛋白,稳定蛋白聚糖与透明质酸的结合,有易于透明质酸激活其受体,如Toll样受体2(Toll-like receptor 2,TLR2)、CD44和透明质酸介导运动的受体(receptor for hyaluronan-mediated motility,RHAMM)等[8-9]。Mebarki等[10]研究发现,HAPLN1是影响肝癌患者预后的独立危险因素,并在维持肝癌细胞的干细胞特性中发挥着重要作用。Huynh等[11]证实,HAPLN1是导致多发性骨髓瘤产生硼替佐米耐药的关键分子。但关于HAPLN1在大肠癌多药耐药产生中的作用目前尚不明确。因此,本研究通过构建人大肠癌甲氨蝶呤(methotrexate,MTX)耐药细胞株HT-29/MTX,观察HAPLN1表达的变化及其对HT-29/MTX细胞MTX耐药性的影响,并探究其可能的分子机制。
材 料 和 方 法
1 材料
人大肠癌HT-29细胞购自中国科学院昆明细胞库。胎牛血清(fetal bovine serum,FBS)和RPMI-1640培养基购自HyClone;MTX购自中国食品药品检定研究院;嘌呤霉素(puromycin,Puro)和IκB激酶(IκB kinase,IKK)抑制剂IKK16购自Sigma;人HAPLN1干扰质粒pRS-HAPLN1、人MRP2干扰质粒pRS-MRP2和无义对照质粒 pRS-scrambled 购自Origene;CCK-8试剂盒、TRIzol试剂、RIPA裂解液和ECL化学发光试剂盒购自碧云天生物技术有限公司;RT-PCR试剂盒购自大连宝生物公司;PCR引物由大连宝生物公司合成;兔抗人HAPLN1、MRP2、IKKα/β、p-IKKα/β(Ser176/Ser177)、p65、p-p65(Ser536)和β-actin单克隆抗体及辣根过氧化物酶标记山羊抗兔IgG购自Abcam。
2 方法
2.1细胞培养 人大肠癌HT-29细胞用含10 % FBS的RPMI-1640培养液,在37 ℃、5 % CO2条件下中进行培养。当细胞覆盖率达到80%以上时,按1 ∶3的比例传代。
2.2建立耐药细胞株HT-29/MTX 取对数生长期HT-29细胞,用0.01 μmol/L MTX处理48 h后,更换为正常培养液继续培养,待细胞覆盖率再次达到80%时,重复以上处理,当HT-29细胞在该药物浓度下能稳定生长传代时,将MTX提高至下一浓度。MTX的浓度梯度为0.01 μmol/L、0.02 μmol/L、0.05 μmol/L、0.1 μmol/L、0.2 μmol/L、0.5 μmol/L和1 μmol/L,整个诱导过程历时7个月,最终得到耐药细胞株HT-29/MTX。HT-29/MTX细胞用含有1 μmol/L MTX的培养液培养以维持耐药性。停用MTX 2周后,取对数生长期细胞进行后续实验。
2.3构建稳定干扰HAPLN1和MRP2的细胞株 取对数生长期的HT-29/MTX细胞,用脂质体转染试剂Lipofectamine®2000将质粒pRS-HAPLN1、pRS-MRP2和pRS-scrambled分别转染HT-29/MTX细胞;转染48 h后,用含0.5 mg/L Puro的培养液进行筛选,2周后得到稳定转染细胞株。转染后的细胞分别命名为shHAPLN1、shMRP2和shControl。
2.4RT-PCR检测mRNA水平 用TRIzol试剂提取总RNA,取2 μg总RNA进行反转录反应,反转录条件为42 ℃ 60 min、70 ℃ 15 min。取2 μL上述反应液进行PCR,PCR反应条件为94 ℃ 1 min; 94 ℃ 30 s、60 ℃ 30 s、72 ℃ 1 min,32个循环。引物采用Primer Premier 5.0软件设计,并经BLAST验证。HAPLN1(211 bp)的上游引物序列为5’-ACTGTTGTGGTAGCACTGGA-3’,下游引物序列为5’-TGGGATATTGCACAGAGCCA-3’;MRP2(206 bp)的上游引物序列为5’-GCAGACCTGCCACTTTGTTT-3’,下游引物序列为5’-TCTGTGAGTACAAGGGCCAG-3’;GAPDH(207 bp)的上游引物序列为5’-AATTCCATGGCACCGTCAAG-3’,下游引物序列为5’-GGGCAGAGATGATGACCCTT-3’。取5 μL扩增产物进行1%琼脂糖凝胶电泳,紫外灯下拍照,用ImageJ 1.45s软件进行灰度分析,以目的产物与内参照GAPDH的灰度值比值表示目的基因mRNA的相对表达水平。实验重复3次。
2.5CCK-8法检测细胞活力 取对数生长期细胞,以每孔5 000个接种于96孔板,培养24 h。去上清,加入100 μL含有不同浓度MTX的培养液。对于非耐药细胞株,MTX的终浓度分别为0.01 μmo/L、0.02 μmol/L、0.03 μmol/L、0.04 μmol/L、0.05 μmol/L和0.06 μmol/L;对于耐药细胞株,MTX的终浓度分别为2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L、32 μmol/L和64 μmol/L。每个浓度设5个复孔,同时设对照孔和调零孔。继续培养48 h后,每孔加入10 μL CCK-8溶液,37 ℃孵育1 h,用酶标仪检测各孔450 nm波长吸光度(A)值。实验重复3次。细胞活力抑制率(%)=(1-加药孔A值/对照孔A值)×100%。使用SPSS 16.0软件的Probit回归模型计算半数抑制浓度(half maximal inhibitory concentration,IC50),并计算出耐药倍数与逆转倍数。耐药倍数=耐药细胞IC50/敏感细胞IC50,逆转倍数=耐药细胞IC50/逆转细胞IC50。
2.6流式细胞术检测细胞凋亡 分别取shControl组、shHAPLN1组和shMRP2组细胞,加入MTX(终浓度为4 μmol/L)。培养48 h后,收集各组细胞,PBS洗涤2次,用200 μL结合缓冲液重悬细胞;加入5 μL Annexin V-FITC,轻轻混匀;加入10 μL PI染色液,轻轻混匀;室温避光孵育15 min后,用FACSCalibur流式细胞仪(BD)检测各试验样本的细胞凋亡率。实验重复3次。
2.7Western blot法检测蛋白水平 取shControl组和shHAPLN1组细胞,并向shControl组细胞加入IKK16(终浓度为10 μmol/L)。培养48 h后,用RIPA裂解各组细胞提取总蛋白,用紫外分光光度法测定蛋白质浓度;取25 μg蛋白样品进行SDS-PAGE并转移至PVDF膜;用脱脂奶粉封闭1 h,加入抗HAPLN1、p-IKKα/β、IKKα/β、p-p65、p65、MRP2和β-actin抗体(1 ∶1 000稀释),4 ℃孵育过夜;TBST洗膜3次,加入II抗(1 ∶2 000稀释)室温下孵育1 h;TBST洗膜3次,加入ECL进行发光反应,暗室X胶片显影,拍照。使用ImageJ 1.45s软件进行灰度分析,以目标蛋白与内参照β-actin的灰度比值作为目标蛋白的相对表达水平。实验重复3次。
3 统计学处理
采用SPSS 16.0分析数据。实验数据用均数±标准差(mean±SD)表示。两组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),并用SNK法进行组间两两比较。以P<0.05为差异有统计学意义。
结 果
1 MTX耐药前后HAPLN1和MRP2表达的变化
Western blot结果显示,与亲代HT-29细胞相比,耐药细胞株HT-29/MTX中HAPLN1和MRP2蛋白表达水平显著上调(P<0.05),见图1;RT-PCR结果也同样表明,HT-29/MTX细胞中HAPLN1和MRP2的mRNA表达水平显著高于HT-29细胞(P<0.05),见图2。这提示HT-29细胞MTX耐药性的产生可能与HAPLN1和MRP2高表达有关。
2 RNA干扰对HAPLN1和MRP2 mRNA表达水平的影响
RT-PCR结果显示,与shControl组相比,shHAPLN1组中HAPLN1和MRP2的mRNA表达水平均显著降低(P<0.05),而shMRP2组仅MRP2的mRNA表达水平明显下降(P<0.05),见图3。这表明特异性shRNA可抑制HT-29/MTX细胞中HAPLN1和MRP2基因表达,此外HAPLN1还可调控MRP2基因的表达。
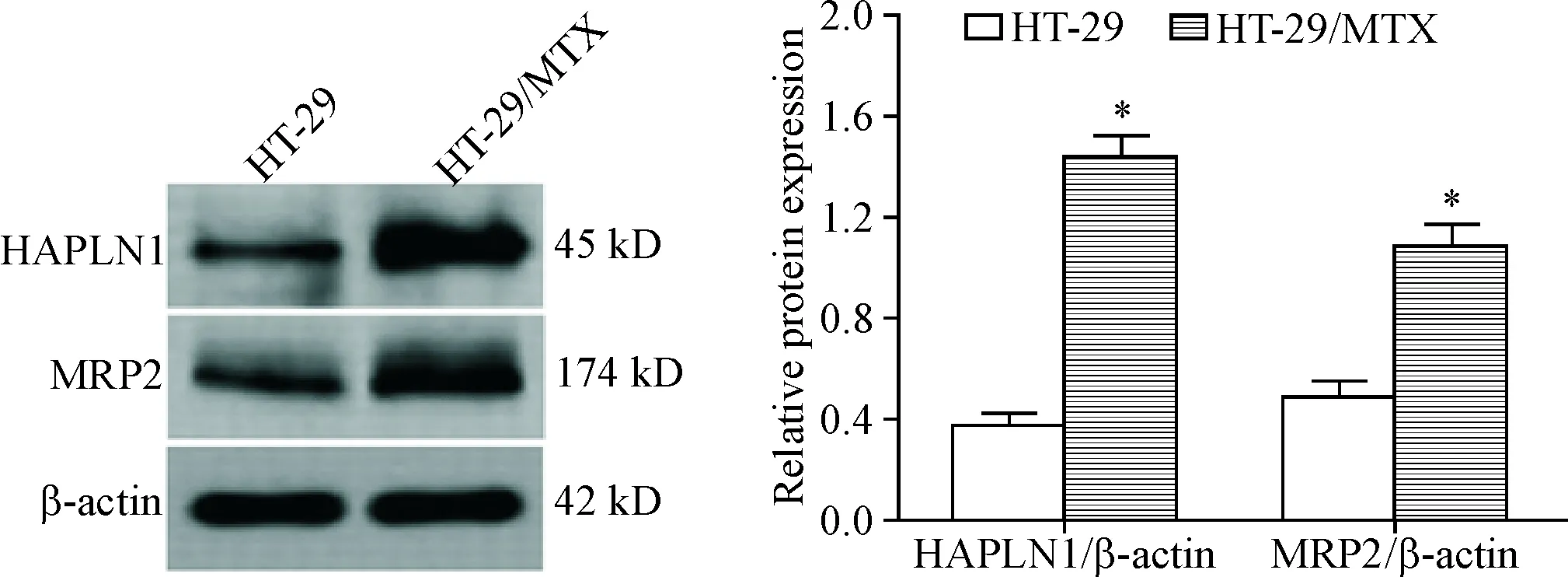
Figure 1.The protein levels of HAPLN1 and MRP2 before and after MTX resistance in the HT-29 cells were determined by Western blot. Mean±SD.n=3.*P<0.05vsHT-29 group.
图1MTX耐药前后HT-29细胞中HAPLN1和MRP2蛋白表达水平的变化
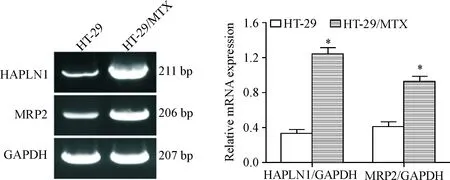
Figure 2.The mRNA levels of HAPLN1 and MRP2 before and after MTX resistance in the HT-29 cells. Mean±SD.n=3.*P<0.05vsHT-29 group.
图2MTX耐药前后HT-29细胞中HAPLN1和MRP2mRNA表达水平的变化
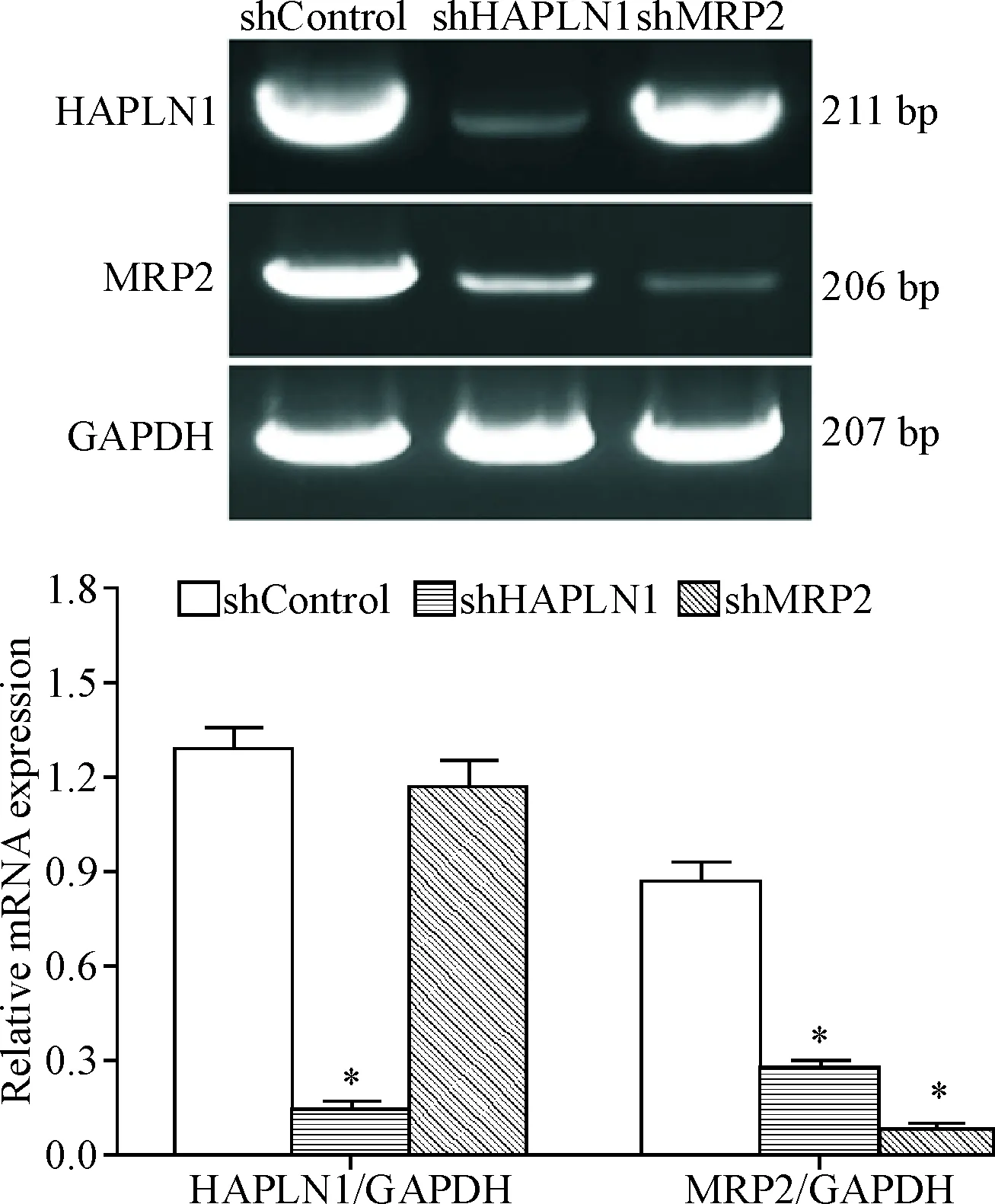
Figure 3.The mRNA expression of HAPLN1 and MRP2 before and after silencing ofHAPLN1 gene orMRP2 gene in the HT-29/MTX cells. Mean±SD.n=3.*P<0.05vsshControl group.
图3沉默HAPLN1或MRP2基因前后HT-29/MTX细胞中HAPLN1和MRP2mRNA表达水平的变化
3 沉默HAPLN1和MRP2基因对MTX毒性作用的影响
CCK-8实验结果显示,与0 μmol/L组相比,0.02~0.06 μmol/L MTX组的HT-29细胞活力均明显降低(P<0.05),HT-29/MTX细胞和shControl细胞的活力从4 μmol/L MTX组开始显著降低(P<0.05),2~64 μmol/L MTX组的shHAPLN1细胞和shMRP2细胞的活力都明显下降(P<0.05);MTX作用HT-29细胞、HT-29/MTX细胞、shControl细胞、shHAPLN1细胞和shMRP2细胞48 h的IC50分别为0.033 μmol/L、15.304 μmol/L、15.182 μmol/L、6.119 μmol/L和7.801 μmol/L; HT-29/MTX细胞、shControl细胞、shHAPLN1细胞和shMRP2细胞的耐药倍数分别为463.756、460.061、185.424和236.394;shHAPLN1细胞和shMRP2细胞的逆转倍数分别为2.501和1.962。这表明沉默HAPLN1和MRP2基因可提高耐药株HT-29/MTX细胞对MTX的敏感性,见图4。
4 沉默HAPLN1和MRP2基因对MTX诱导的细胞凋亡的影响
流式细胞术结果显示,与shControl组相比,shHAPLN1组和MRP2组细胞凋亡率的差异无统统计学显著性,而shControl+MTX组、shHAPLN1+MTX组和shMRP2+MTX组的细胞凋亡率均显著升高(P<0.05);同时,shHAPLN1+MTX组和shMRP2+MTX组的细胞凋亡率均明显高于shControl+MTX组(P<0.05)。这表明抑制HAPLN1或MRP2基因表达并不影响HT-29/MTX细胞凋亡,但可增强MTX诱导的HT-29/MTX细胞凋亡,见图5。
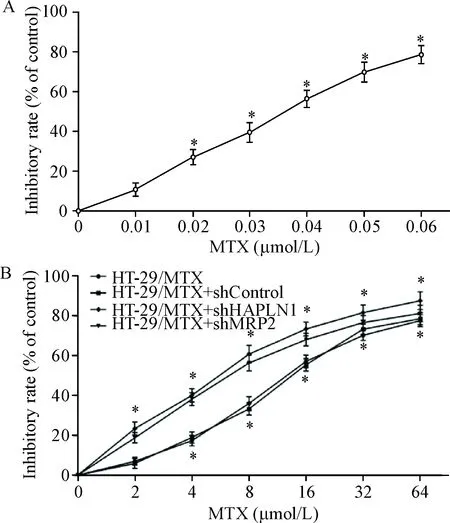
Figure 4.The effect of MTX at different concentrations on the cell viability in each group. A: HT-29 cells; B: HT-29/MTX cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图4不同浓度MTX对各组细胞活力的影响
5 沉默HAPLN1基因对IKKα/β和p65蛋白磷酸化水平以及MRP2蛋白表达水平的影响
Western blot实验结果显示,与shControl组相比,shHAPLN1组和shControl+IKK16组细胞中的p65和IKKα/β蛋白磷酸化水平以及MRP2的蛋白表达水平均显著降低(P<0.05);此外,shHAPLN1组细胞的HAPLN1蛋白表达水平明显低于shControl组(P<0.05),但shControl组与shControl+IKK16组在HAPLN1蛋白表达水平上的差异无统计学显著性。这提示IKK/p65信号通路可能参与了HAPLN1对MRP2表达的调控,见图6。
讨 论
HAPLN1是一种分子量约为45 kD的细胞外基质蛋白,由1段信号肽、1个免疫球蛋白结构域和2个蛋白聚糖串联重复(proteoglycan tandem repeat,PTR)结构域构成。HAPLN1可稳定透明质酸与肿瘤细胞表面受体的结合,继而促进肿瘤细胞迁移、侵袭、转移以及肿瘤血管生成[12-15]。HAPLN1在未分化的HepaRG祖细胞中呈高表达,但在已分化的肝细胞样的HepaRG细胞中几乎检测不到,沉默HAPLN1基因可下调HepaRG祖细胞中Snail、Acta2、Col4a1和Lgr5等间叶细胞或干细胞标志物的表达;同时,在HAPLN1高表达的肝癌病理组织中干细胞标志物PROM1也呈高表达[10]。这表明HAPLN1可能在维持肿瘤干细胞特性方面发挥着重要作用。由此推测,HAPLN1可能与肿瘤细胞耐药性的发生有关。
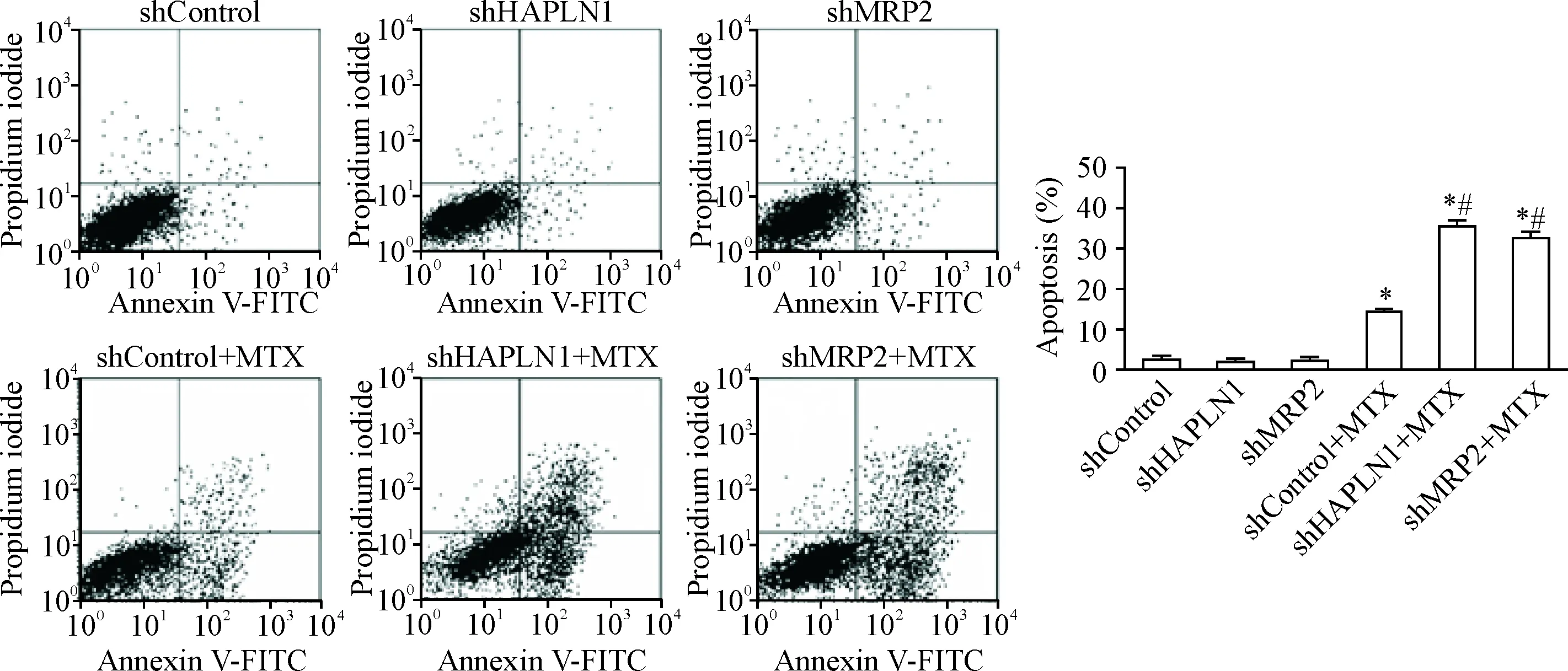
Figure 5.Silencing ofHAPLN1 gene orMRP2 gene enhanced MTX-induced apoptosis in the HT-29/MTX cells. Mean±SD.n=3.*P<0.05vsshControl group;#P<0.05vsshControl+MTX group.
图5沉默HAPLN1或MRP2基因增强MTX诱导的HT-29/MTX细胞凋亡
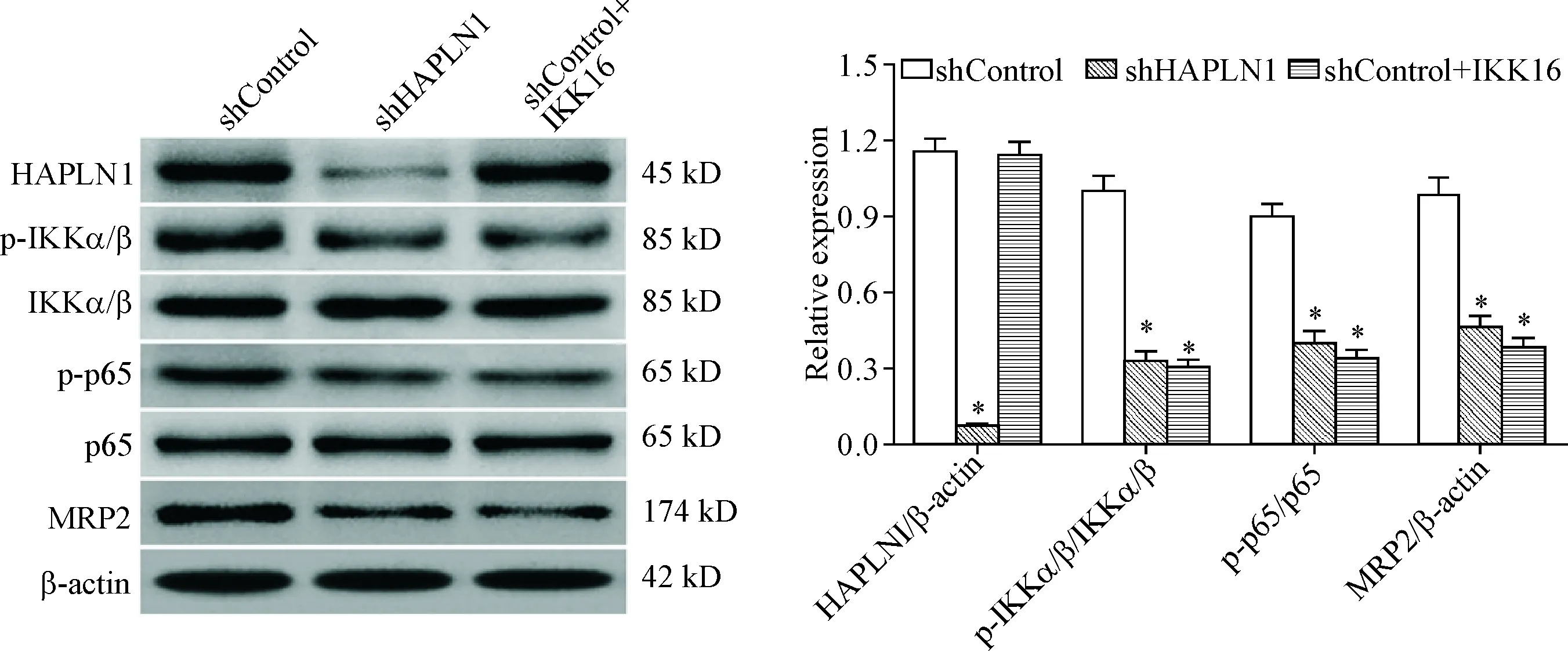
Figure 6.Silencing ofHAPLN1 gene inhibited the phosphorylation of IKKα/β and p65 and down-regulated the protein expression of MRP2 in the HT-29/MTX cells. Mean±SD.n=3.*P<0.05vsshControl group.
图6沉默HAPLN1基因抑制IKKα/β和p65蛋白磷酸化以及MRP2蛋白表达
MRP2过表达是导致大肠癌细胞产生多药耐药性的重要机制之一[16]。MRP2属ATP结合盒转运蛋白(ATP-binding cassette transporter,ABC transporter)家族成员,也被称为ABCC2。MRP2通过水解ATP获取能量,将肿瘤细胞内的多种化疗药物(如MTX)转运至细胞外,降低肿瘤细胞内的药物浓度,导致肿瘤细胞产生多药耐药性[17]。临床研究也证实,MRP2与MTX在急性淋巴细胞白血病患者体内的分布和清除密切相关[18-20]。
本研究结果显示,在人大肠癌耐药细胞株HT-29/MTX中HAPLN1和MRP2的mRNA和蛋白表达水平均显著高于其亲代HT-29细胞,耐药倍数高达463.756倍。采用shRNA干扰技术沉默HAPLN1或MRP2基因后,MTX对HT-29/MTX细胞的IC50从15.304 μmol/L分别降至6.119 μmol/L和7.801 μmol/L,逆转倍数分别为2.501倍和1.962倍。流式细胞术结果也证实,抑制HAPLN1和MRP2基因均可增强MTX诱导的HT-29/MTX细胞凋亡。这些研究结果表明,下调HAPLN1或MRP2基因表达可逆转HT-29/MTX细胞对MTX的耐药性。
Ke等[21]研究发现,激活NF-κB信号通路可通过上调MRP2蛋白表达降低人小细胞肺癌NCI-H446细胞对喜树碱和顺铂的敏感性。Zhang[22]也发现,高氨血症可增强血脑屏障中MRP2和ABCB1的表达,NF-κB信号通路介导了该作用。已有学者研究证实,NF-κB可直接与MRP2基因的启动子结合从而调控其表达[23]。这表明MRP2可能是受NF-κB信号通路调控的下游靶基因。而Huynh等[11]研究发现,HAPLN1可通过其PTR结构域,以不依赖透明质酸受体的方式激活NF-κB信号通路,诱导多发性骨髓瘤细胞产生硼替佐米耐药性。
NF-κB蛋白家族由5种转录因子构成:p50、p52、p65(RelA)、c-Rel和RelB,各成员之间可两两组合形成同型或异型二聚体,即NF-κB,在哺乳动物细胞中最常见的NF-κB是由p65和p50形成的异型二聚体。细胞质中的NF-κB通常与抑制蛋白IκB形成复合体而以无活性状态存在。IKK由2个催化亚基(IKKα和IKKβ)和1个调节亚基(IKKγ)组成的三聚体,活化的IKK可磷酸化IκB而使其降解,同时也可磷酸化p65而促进其移位入核,以调控靶基因的表达[24]。本研究发现,敲减HAPLN1基因表达可下调HT-29/MTX细胞中IKKα/β和p65蛋白磷酸化水平,从而抑制了IKK/p65信号通路活化,同时还下调了MRP2的mRNA和蛋白表达水平;而IKKα/β抑制剂IKK16在阻断IKK/p65信号通路的同时也可下调MRP2蛋白表达水平。由此可见,HAPLN1可能是通过活化NF-κB信号通路以上调MRP2基因表达的,这可能是其降低HT-29/MTX对MTX敏感性的重要机制之一。
综上所述,敲减HAPLN1基因表达可在体外增强人大肠癌耐药细胞株HT-29/MTX对MTX的敏感性,这可能与其抑制IKK/p65信号通路活化,继而下调MRP2基因表达有关,具体的分子机制还有待进一步阐明。
