TAK-242对脂多糖诱导的脓毒症脑病小鼠学习记忆功能障碍的改善作用*
2019-04-22陈伟明刘先保吴亚芬黄梦婷陈晓彤王寿平
庹 鹏, 陈伟明, 刘先保, 吴亚芬, 黄梦婷, 陈晓彤, 王寿平△
(1广州医科大学附属第三医院麻醉科, 广东 广州 510150; 2中山大学孙逸仙纪念医院博济医疗中心, 广东 广州 510120)
脓毒症相关脑病(sepsis-associated encephalopathy,SAE)是指大脑在无直接感染的临床证据前提下,因全身感染引起的弥漫性或多灶性脑功能障碍,临床表现主要为情绪不稳定、定向障碍和学习认知障碍等,是ICU患者发生脑病的主要形式[1]。此病非由脑出血、颅内感染和肺脏感染等其它引起的相关性脑病,其确切发病机制也尚未明确,是临床医学的突出难题[2-3]。有研究表明,对于由脂多糖(lipopolysaccharide,LPS)诱发的脓毒症脑病老年小鼠,抑制炎症通路TLR4/NF-κB下游靶点可改善认知功能[4]。TAK-242作为 Toll样受体4(Toll-like receptor 4,TLR4)的特异性拮抗剂,目前已被证实可以透过血脑屏障,在缺血-再灌注损伤和脑中风等动物模型中能有效降低炎症因子的释放,从而对脑组织起保护作用[5]。本研究拟探讨TAK-242对脓毒症脑病小鼠学习记忆功能障碍的改善效应并探究其可能的作用机制,为临床治疗脓毒症脑病提供理论依据。
材 料 和 方 法
1 实验动物
80只健康雌性SPF级C57BL/6小鼠,质量20~30 g,10~12月龄,均由广东省实验动物中心提供,许可证号为SCXK(粤)2013-0002。所有小鼠实验前进行1周的检疫,饲养于12 h/12 h的明暗周期环境中,温度20 ℃~25 ℃,湿度20%~30%,动物可自由活动,按时提供饲料和饮用水。所有的实验经广州医科大学实验动物中心伦理委员会批准,按照广州医科大学实验动物中心实验指南进行。
2 主要仪器
离心机(Sigma);微量血气分析仪(雅培i-STAT 1);Image-Pro Plus多功能真彩色细胞图像分析管理系统(Media Cybernetics);酶标仪、蛋白电泳仪和蛋白凝胶成像扫描仪(Bio-Rad)。
3 主要试剂
TAK-242(MCE);脂多糖(大肠杆菌来源,25MG,批号L2880,Sigma);BCA蛋白定量试剂盒(KGA801)和ECL化学发光液(KGP1123)购自江苏凯基生物技术股份有限公司;抗离子钙结合衔接分子1(ionized calcium-binding adapter molecule-1,Iba-1)兔单克隆抗体(货号ab178847)、抗NF-κB p65兔多克隆抗体(货号ab16502)、抗TLR4兔多克隆抗体(货号ab13556)、抗Aβ1-42兔单克隆抗体(货号ab201060)和抗p-tau (S396)兔单克隆抗体(货号ab109390)购自Abcam。
4 方法
4.1动物模型制作及分组 健康雌性C57BL/6小鼠80只,用随机数字法将其平均分为空白对照(control,CON)组、TAK-242对照组(TAK组)、脓毒症脑病模型组(LPS组)和TAK-242预处理组(T+L组)。参照文献[6],LPS组腹腔注射250 μg/kg LPS,每天1次,持续7 d; T+L组则每天在注射LPS前30 min按5 mg/kg腹腔注射TAK-242,持续7 d。CON组和TAK组分别每天注射等量的0.9%生理盐水和TAK-242 1次,持续 7 d。造模完成后,随机选取各组小鼠(n=4)采集左心室血进行血气分析,取肺组织进行HE染色。
4.2行为学实验 旷场实验(open-field test, OFT)、高架十字实验(elevated plus-maze test, EPMT)和水迷宫实验(water maze test,WMT)均在暨南大学粤港澳中枢神经再生研究院完成。(1)旷场实验在安静的房间中进行,敞箱设备由不透明材料制成,底面为50 cm×50 cm正方形,边缘墙高50 cm,定义中央区25 cm×25 cm,将小鼠放入敞箱中央,使之自由活动5 min,使用Ethovision XT8系统相机记录小鼠活动情况,记录进入中央区次数和中央区停留的时间,每次结束后,用75%乙醇清理小鼠排泄物,尽量减少小鼠残留气味,待乙醇挥干后,再进行下一只小鼠实验。(2)高架十字迷宫为长100 cm×宽12 cm的塑料十字架,离地面高50 cm,高架分为3部分,中央区12 cm×12 cm,开臂区和闭臂区均为44 cm×12 cm,开臂边缘外5 cm定义为点头区,正式实验时,将小鼠置于中央区,头面向开放臂,实验者迅速离开,通过录像系统,记录小鼠的活动情况,检测其进入开放臂次数和开放臂停留时间,进入点头区次数及在点头区停留时间。总时间5 min,结束后用75%乙醇清洗再进入下一只小鼠实验。(3)Morris水迷宫为直径120 cm、高100 cm的圆柱形水缸,平台高度为30 cm,直径为10 cm,平台在水下1 cm,水缸分为4个象限,在水缸壁四周不同位置标记有不同的几何图形以供小鼠观察定位。造模结束后,所有动物正式开始前按组别依次入水让其自由游泳1 min。30 min后正式实验,水温保持25 ℃,头4 d先进行定位航行(place navigation)实验,第5天开始空间探索(spatial probe)实验,撤去平台,从平台象限的对侧入水,每只小鼠持续1 min,检测其逃避潜伏期(escape latency)。
4.3小鼠脑内海马区病理学检查 取行为学实验后每组小鼠随机选取8只,使用10%水合氯醛麻醉,按照4 mL/kg剂量麻醉,0.9%生理盐水和4%多聚甲醛依次各灌注10分钟,后取出大脑进行内固定48 h,固定完成后,PBS清洗3次,每次2 h,然后用梯度乙醇脱水,并将脑组织浸泡于二甲苯中透明处理,处理30 min,然后取出脑组织并用滤纸吸净表面二甲苯。使用石蜡对脑组织进行浸渗处理,将预热好的石蜡过滤,并将脑组织浸泡于石蜡中,在恒温箱中浸渗60 min,最后将石蜡与组织倒入蜡槽中,自然冷却,在石蜡切片机中进行切片,以正常组小鼠大脑组织石蜡切片,标注海马CA1、CA3和齿状回(dentate gyrus,DG)区域,见图1。取出小鼠大脑石蜡切片,使用二甲苯脱腊,然后用梯度浓度的乙醇进行复水处理,浸泡于蒸馏水中待用。每块脑切片使用50 μL 3%过氧化氢溶液室温下孵育10 min,PBST冲洗3次,每次5 min。取500 mL EDTA抗原修复液,加热至微沸,将脑组织缓慢放入烧杯中,保持微沸20 min,室温下取出冷却,PBST清洗3次,每次5 min。去除PBST液,加入已稀释的(1 ∶1 000) I抗50 μL,4 °C过夜18h,去除 I抗,PBST清洗3次,每次5 min,去除PBST液,每张切片加入50 μL II抗,37 ℃孵育60 min,PBST冲洗3次,每次5 min,去除PBST液,加入50 μL新鲜配置的DAB溶液,显色3 min,用蒸馏水冲洗,使用苏木素染色10 min,蒸馏水冲洗,加入0.1%盐酸进行分化,使用PBS进行返蓝,最后中性树脂封片。每组选取相应的海马组织,参照小鼠大脑图谱,采用多功能彩色细胞图像分析系统,在20倍光镜下观察海马CA1、CA3及DG区域阳性细胞的形态和数量,进行统计分析。

Figure 1.Distribution of different parts of hippocampus in normal mouse brain (×20).
图1正常小鼠脑组织海马不同部位的分布
4.4Western blot测定小鼠体内中枢神经炎症通路相关蛋白 取每组剩余的8只小鼠,使用10%水合氯醛麻醉,按照4 mL/kg剂量麻醉,取海马组织,使用4 ℃的PBS清洗脑组织3次,用滤纸吸干液体后,称重,在冰上加入裂解液匀浆,匀浆液在室温静置30 min,在4 ℃、15 000 r/min离心1 h,取上清,分装,采用BCA法测定蛋白浓度。取蛋白样品溶液,取总蛋白30 μg,进行SDS-PAGE。电泳结束后将蛋白转至PVDF膜。转膜后用5%的脱脂奶粉封闭液常温摇床振荡孵育2 h,加入I抗(浓度均为1∶1 000)4 ℃孵育过夜,次日用TBST洗膜3次,每次5 min。加入HRP标记的 II 抗(1∶5 000),常温振荡孵育1 h。TBST洗膜5次,每次5 min。将ECL化学发光液显影,曝光,所得条带用ImageJ软件分析灰度值。
5 统计学分析
采用SPSS 19.0进行统计分析。所有数据采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 小鼠造模情况分析
与CON组相比,其余各组小鼠动脉血气分析未发生明显变化,见表1;肺脏病理切片HE染色结果也未发生明显炎症病变,见图2。
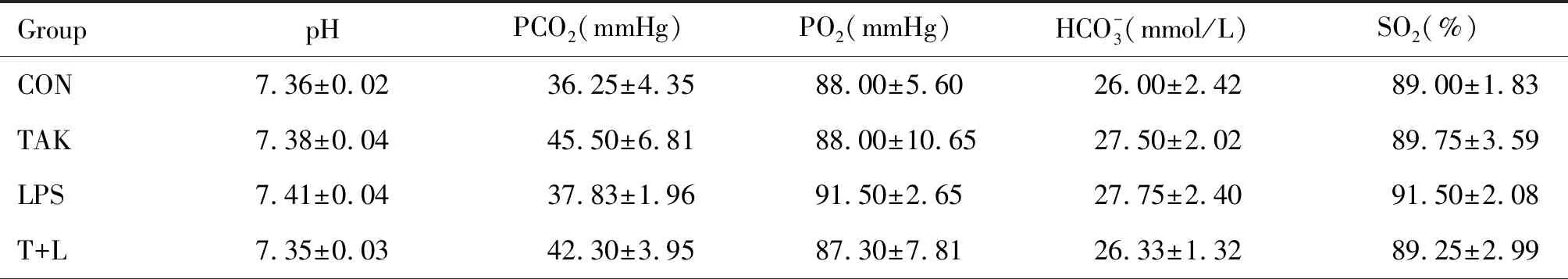
表1 各组小鼠动脉血气分析结果

Figure 2.Pathological observation of lung tissues with HE staining in each group (×200).
图2HE染色观察肺脏病理情况
2 各组小鼠行为学的变化
2.1旷场实验 与CON组相比,LPS组的中央区活动时间和穿过中央区次数都显著降低(P<0.01);与LPS组相比,T+L组的中央区活动时间及穿过中央区次数显著增加(P<0.01),TAK组与CON组比较没有显著统计学差异,见表2。

表2 各组小鼠在旷场实验中的活动情况
**P<0.01vsCON group;##P<0.01vsLPS group.
2.2高架十字实验 与CON组相比,LPS组的开臂进入次数和点头区进入次数均明显减少(P<0.05),与LPS组相比,T+L组的开臂进入次数和点头区进入次数显著增加(P<0.05),TAK组与CON组比较没有显著统计学差异,见表3。
2.3Morris水迷宫实验 在第1~2天训练定位航行中,各组到达平台区所用时间无显著差异,在第3~4天的训练中,与CON组相比,LPS组小鼠找到目标平台区的逃避潜伏期显著延长(P<0.05);与LPS组相比,T+L组在第4天的逃避潜伏期明显缩短(P<0.05)。第5天撤去平台的空间探索中,与CON组相比,LPS组小鼠找到目标平台区的逃避潜伏期显著延长(P<0.05);与LPS组相比,T+L组的逃避潜伏期明显缩短(P<0.05);TAK组与CON组比较没有显著统计学差异,见表4。
3 小鼠大脑组织海马区的免疫组化染色观察
与CON相比,LPS组小鼠海马区小胶质细胞特异性标志物Iba-1阳性细胞(尤其是CA1、CA3与DG区)数量增多,胞体变大,呈分枝状;TAK组结果与CON组基本一致,提示TAK-242对正常海马组织没有明显损伤作用;与LPS组相比,T+L组海马CA1、CA3与DG 区Iba-1阳性细胞数量显著减少,见图3。这一结果提示腹腔预防性注射TAK-242可减轻由LPS造成的小鼠海马损伤。
*P<0.05vsCON group;#P<0.05vsLPS group.
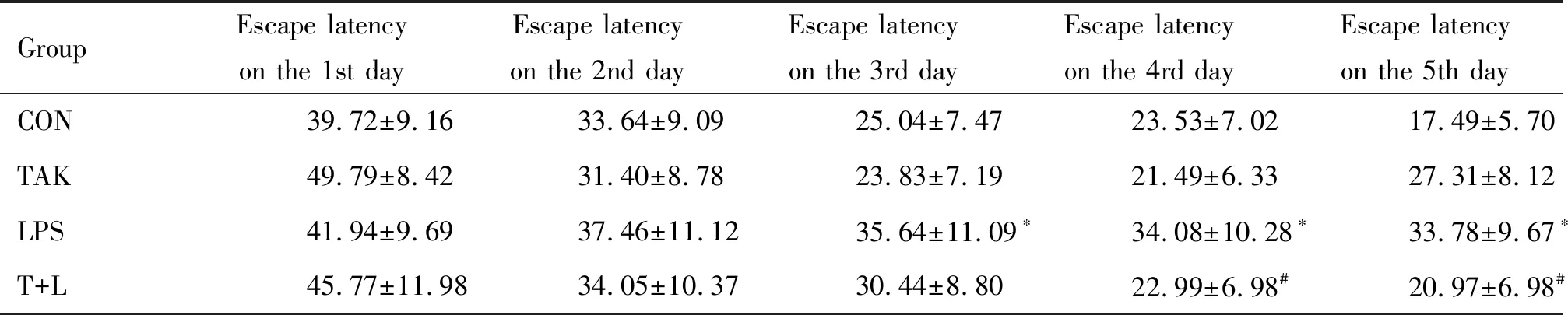
表4 各组小鼠在Morris水迷宫实验中的活动情况
*P<0.05vsCON group;#P<0.05vsLPS group.
4 Western blot实验结果分析
在CON组及TAK组中,小鼠脑内的中枢神经炎症相关蛋白NF-κB p65、TLR4、Aβ1-42和p-tau(S396)的表达均较低,无显著差异;与CON组相比,LPS组小鼠脑内中枢神经炎症相关蛋白显著上调(P<0.01);与LPS组相比,T+L组的NF-κB p65、TLR4、Aβ1-42和p-tau (S396)表达水平显著降低(P<0.01),表明TAK-242在5 mg/kg的给药浓度下,可显著降低小鼠脑内中枢炎症相关蛋白的表达,减轻炎症反应,见图4。
讨 论
脓毒症是危重症患者中的常见并发症,具有发病率高,死亡率高的特点,确切机制尚不明确。脓毒症引起的认知功能障碍与中枢神经炎症关系密切,中枢神经炎症是导致认知功能障碍的重要原因[7],理想的动物疾病模型是人们研究疾病发病机制和防治的基础,因此建立合理的动物疾病模型相当重要。
LPS是诱发炎症反应的经典药物,其小鼠模型具有对全身功能影响小、对行为学研究干扰小、易操作和死亡率低等优点,少量多次持续注射LPS能很好地模拟人体感染病灶缓慢持续释放细菌或毒素入血的特征,可使宿主有充分的时间启动免疫炎症反应,通过动脉血气分析以及肺部病理切片检测,排除肺部明显炎症,为中枢神经炎症研究的可靠模型[8],因此本研究参照文献,连续7 d腹腔注射LPS 250 μg可成功诱发外周感染模型。
旷场实验和高架十字实验是评价小鼠探索功能以及焦虑和恐惧情绪的经典方法, 小鼠在焦虑恐惧状态下会表现出特有的呆滞状态,探索行为减少。本研究结果显示, LPS引起的脓毒症脑病小鼠穿越旷场中央区、高架十字的开臂区和点头区的时间和次数减少;此外, Morris水迷宫实验评价小鼠学习和记忆功能,结果显示,脓毒症脑病小鼠逃避潜伏期延长,而通过TAK-242干预后,小鼠的焦虑情况和学习记忆功能也有所改善。
海马是学习记忆的重要结构,海马区炎症反应是导致脓毒症脑病认知障碍的主要病理生理之一,其作用机制是LPS可与中枢神经系统小胶质细胞表面TLR4受体结合,激活并释放大量炎症因子,导致海马组织损伤,从而影响其记忆形成与维持功能[9-10]。通过观测LPS组小鼠海马区活化的小胶质细胞数目及密度均增加,呈分枝状,突起变短,细胞数量减少。免疫组化海马区Iba-1阳性细胞进一步揭示了LPS诱导的小胶质细胞的过度活化导致小鼠认知功能的障碍[11]。
NF-κB是广泛存在于细胞中的凋亡相关因子,是细胞核重要的转录因子,p65是NF-κB核转录因子的核心亚基,参与机体的免疫、炎症和组织损伤修复等,同时还会调节凋亡相关基因的表达。细胞外的LPS、TNF-α和IL-1β等可激活NF-κB,并激活其下游一系列蛋白,最终使细胞通过线粒体途径凋亡。

Figure 3.Immunohistochemical staining of Iba-1 in the hippocampus of the mice.The arrows indicate active microglia.Mean±SD.n=8.**P<0.01vsCON group;#P<0.05vsLPS group.
图3小鼠大脑海马Iba-1免疫组化染色情况
TLR4信号通路是免疫系统中的重要炎症通路之一,是各类炎症的重要靶点,可被LPS中的脂质A部分激活,因此常用作炎症反应模型制作的重要指标[12]。Aβ1-42是Aβ蛋白家族中的一种亚型,是神经中枢中小胶质细胞炎症反应的激活蛋白,并可通过异常磷酸化大量累积而影响患者认知功能。在正常生理状态下,Aβ1-42蛋白浓度极低,但在神经炎症刺激状态下,Aβ蛋白大量产生,并转变为不溶性的β折叠结构,在组织中大量沉积,促使小胶质细胞产生炎性介质及炎症因子,加剧中枢神经炎症的发展,因此其表达水平可从一定程度反映患者认知功能损伤水平[13]。本实验中,通过腹腔注射LPS,其通过血液循环透过血脑屏障,可直接与神经中枢中的小胶质细胞TLR4相结合,导致NF-κB p65显著上调,诱导炎症的发生,进而致Aβ1-42蛋白的大量沉积,损伤海马组织,而经过TAK-242干预以后,NF-κB p65、TLR4和Aβ1-42表达显著下降。Tau蛋白也是神经炎症反应的重要指标,其功能主要是促进微管的形成和保持微管的稳定性,目前发现了21个tau蛋白磷酸化的结合位点,在神经炎症发生时,tau蛋白与微管结合能力减弱,导致细胞骨架被破坏,同时在神经元中形成神经原纤维缠结,导致突触蛋白功能缺失,进而影响认知功能[14-15]。在本实验中,中枢炎症老年小鼠p-tau (S396)在海马中表达量都较对照组明显增多,表明中枢炎症时会导致大脑中tau蛋白磷酸化程度大量地增加;经过TAK-242治疗,中枢炎症老年小鼠海马组织中p-tau (S396)的表达量明显减少。
综上所述,TAK-242对脓毒症脑病小鼠学习记忆功能障碍具有改善效应,其机制可能是:通过抑制中枢炎症反应,减少大脑中小胶质细胞的活化,从而减少海马区炎症因子的产生并下调炎症相关蛋白的表达。

Figure 4. Western blot analysis of inflammatory proteins NF-κB p65, TLR4, Aβ1-42 and p-tau (S396) in brain tissues. Mean±SD.n=8.**P<0.01vsCON group;#P<0.05,##P<0.01vsLPS group.
图4各组海马炎症相关蛋白NF-κBp65、TLR4、Aβ1-42和p-tau(S396)蛋白水平
