结肠癌组织中STC1的表达及其与肿瘤微环境的关系*
2019-04-22赵素平王宗艳刘瑞廷吕飒美史丽萍王国荣
张 健, 赵素平, 王宗艳, 刘瑞廷, 陈 倩, 吕飒美, 史丽萍, 王国荣
(陕西省人民医院 1消化内二科, 2普外一科, 陕西 西安 710068)
结肠癌是常见的消化道肿瘤,是第3大最常见的恶性肿瘤,具有高侵袭性和高死亡率等特点。而目前针对结肠癌的治疗,主要是手术联合术后辅助化疗和靶向治疗的方式,但治疗效果不尽如人意,因此鉴定开发新的结肠癌治疗靶标具有重大意义[1]。斯钙素1(stanniocalcin 1,STC1)是一类糖蛋白,最初在硬骨鱼中发现,在多种组织中普遍表达,参与机体多种生理过程[2]。先前的研究发现,STC1在肝癌、肺癌和乳腺癌的发展过程中发挥重要的作用[3-4],而目前关于STC1在结肠癌中的研究还鲜有报道,同时有研究发现缺氧和炎症等结肠肿瘤组织微环境是影响结肠癌发生发展的重要因素[5]。大量的报道证明在实体瘤中普遍存在缺氧,而缺氧还能够通过调控大量靶基因参与结肠癌的耐药过程[6]。同时值得注意的是,大量的研究表明炎症组织存在转化为肿瘤的可能,尤其在结肠癌的发生发展过程中炎症更是扮演着重要的角色。本研究探究STC1在结肠癌中表达的意义及其与患者预后的关系,并进一步分析STC1与结肠癌肿瘤微环境的关系,为结肠癌的诊断与治疗提供理论依据。
材 料 和 方 法
1 细胞株及标本
人结肠癌细胞株HT-29购自美国模式培养物集存库(American Tissue Culture Collection,ATCC),并由供应商进行鉴定。结肠癌及癌旁临床标本来自我院2010年1月~2015年6月外科手术切除的结肠癌组织及远切端结肠黏膜组织,同期我院结肠镜检查术中活检所取正常结肠黏膜标本为对照,标本采集后迅速置于液氮中速冻,后储存于超低温冰箱保存备用。取样前,患者均未进行化疗、放疗及其它治疗手段。标本的采集事先获得病人同意,并签署病人知情同意书。
2 主要试剂
McCoy’s 5A 细胞培养基购自Thermo;胎牛血清、青霉素和链霉素购自Gibco;RNA提取试剂TRIzol购自Roche;cDNA第一链合成试剂盒和RT-qPCR试剂盒均购自上海翊圣生物技术有限公司;荧光定量PCR引物根据引物设计网站(http://primer3.ut.ee/)设计,并由上海生工有限公司合成,引物序列见表1;缺氧诱导化学试剂CoCl2购自Selleck;抗STC1和GAPDH抗体以及辣根过氧化物酶标记的 II 抗均购于武汉三鹰生物技术有限公司;其它化学试剂均购自国药化学试剂有限公司。
表1RT-qPCR引物序列
Table 1.The sequences of the primers for RT-qPCR

NamePrimer sequence (5-3)Product (bp)STC1Forward AGCACAATCAGAGACAGCCT206 Reverse TGGGATGTGCGTTTGATGTGGAPDHForward GGATTTGGTCGTATTGGGCG240Reverse ATCGCCCCACTTGATTTTGG
3 主要方法
3.1组织中总RNA 的提取 组织中总RNA的提取过程如下:组织中加入2 mL的RNA提取试剂TRIzol,经充分匀浆后,置于-80 ℃冻融1次,促进细胞裂解,加入2 mL 的氯仿,上下剧烈振荡1 min,室温静置15 min,12 000 r/min于4 ℃离心20 min。取上清于新的离心管中,加入等量体积预冷的异丙醇,振荡30 s,室温静置 10 min,12 000 r/min于4 ℃离心20 min,白色沉淀即为提取的总RNA。吸去上清,加入75% 乙醇 (DEPC处理过的去离子水)清洗2次,置于超净工作台风干。加入经DEPC处理的去离子水50 μL,测定RNA浓度,保证RNA纯度。
3.2RT-qPCR实验 cDNA第一链的合成采用的是cDNA第一链合成试剂盒,逆转录反应体系的配制如下:总RNA(1 μg),2×HifairTMSuperMix (10 μL),补充RNase free ddH2O至20 μL。反应程序为 25 ℃ 5 min、50 ℃ 60 min、85 ℃ 5 min。反应结束后,测定产物浓度,进行qPCR。采用HieffTMqPCR SYBR® Green Master Mix(High Rox Plus)试剂盒,反应体系冰上配制:逆转录产物 (100 ng), 正反向引物 (0.2 μmol/L),SYBR® Green Master Mix(25 μL),补足RNase free ddH2O至50 μL。充分混匀后低速离心,进行PCR反应。预变性:95 ℃,2 min;循环程序 (循环数40): 95 ℃ 10 s、60 ℃ 30 s;熔解曲线:95 ℃ 15 s、 60 ℃ 60 s、95 ℃ 15 s。数据分析采用2-ΔΔCt方法计算。
3.3UALCAN数据库分析 UALCAN数据库是用于分析肿瘤转录组数据的开放式网络资源[7]。使用UALCAN(http://ualcan.path.uab.edu/index.html)分析STC1 mRNA在结肠癌组织中的表达情况进行预后分析, 分析的结肠癌样本来源于TCGA数据库。
3.4Oncomine数据库分析 利用包含大量肿瘤样本数据的Oncomine数据库(https://www.oncomine.org)分析STC1 mRNA在结肠癌组织中的表达水平,结合UALCAN数据库,确认STC1基因的mRNA表达在结肠癌组织及其正常组织中的表达差异。
3.5细胞培养 HT-29细胞培养在含有10%胎牛血清的McCoy’s 5A 细胞培养基中,培养基中添加1×105U/L的青霉素和100 mg/L的链霉素。正常培养条件设置为 5% CO2、37 ℃。
3.6构建结肠癌细胞缺氧微环境 使用150 μmol/L化学诱导剂CoCl2处理结肠癌细胞6 h和12 h以及1% O2培养HT-29细胞6 h和12 h。诱导时间结束后,收集样品:吸去培养基,用预冷的PBS 缓冲液洗2次,提取细胞中总RNA,进行RT-qPCR,分析缺氧条件下STC1蛋白及mRNA的表达变化。
3.7脂多糖 (lipopolysaccharide,LPS)诱导结肠癌细胞炎症反应 使用100 μg/L的LPS分别处理结肠癌HT-29细胞 2、6和12 h,提取细胞总RNA,分析炎症环境下,结肠癌细胞HT-29中STC1蛋白及mRNA的表达情况。
3.8TIMER数据库分析 运用TIMER(https://cistrome.shinyapps.io/timer/)[8]分析结肠癌组织中STC1mRNA表达水平与缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF1α)mRNA及其下游基因金属蛋白酶组织抑制剂1(tissue inhibitor of metalloproteinase 1,TIMP1)mRNA的相关性;分析结肠癌组织中STC1 mRNA表达及其与炎症免疫调节因子白细胞介素(interleukin,IL)-6、IL-8、IL-10、IL-1β、转化生长因子β1(transforming growth factor-β1, TGF-β1)、TGF-β2、肿瘤坏死因子(tumor necrosis factor, TNF)及趋化因子CCL3和CCL4 mRNA表达的相关性。
3.9Western blot实验检测蛋白水平 收集细胞于离心管中,加入RIPA裂解液,振荡数次,冰上裂解30 min,4 ℃、12 000 r/min离心15 min,吸取上清,采用BCA法进行蛋白定量。制备好的样品进行SDS-PAGE,并转移到PVDF膜上,5%的脱脂奶粉室温封闭1 h后4 ℃下过夜孵育 I抗,TBST溶液洗涤3次,室温孵育 II抗1 h。TBST 溶液再次洗涤3次,最后采用ECL增强发光液进行显影检测。蛋白表达定量采用Quantity One软件。
4 统计学处理
用GraphPad Prism 5统计软件以及R语言软件进行作图分析。数据库中结肠癌组织与正常结肠组织中STC1的mRNA表达,采用R包edgeR包来构建表达矩阵,评估基因表达数据,表达数据取log2对数,两组间差异采用双尾法t检验;STC1基因表达水平与患者生存期分析采用Kaplan-Meier模型进行分析,两组间生存率的比较采用Log-Rank检验,结肠癌组织中STC1基因与HIF1α等基因表达的相关性分析采用皮尔森相关性系数分析(Pearson’s correlation),置信区间选择95%;手术收集的20例结肠癌患者样本以及缺氧、脂多糖诱导处理结肠癌细胞的RT-qPCR及Western blot数据采用均数±标准差(mean±SD)表示,两组间比较采用双尾法t检验。以P<0.05为差异有统计学意义。
结 果
1 STC1在结肠癌组织中的表达
通过UALCAN数据库,调取41例的正常结肠组织以及286例结肠癌组织,通过分析发现肿瘤组织中STC1的表达显著高于正常结肠组织(P<0.01),见图1A。进一步通过Oncomine数据库调取Skrzypczak样本信息,分析24例的正常结肠组织和36例结肠癌组织中STC1的表达,显示结肠癌组织中STC1的表达是正常结肠组织的3.54倍(P<0.01),见图1B。对临床收集的20例结肠癌患者组织行RT-qPCR实验发现结肠癌组织(T)与对应癌旁组织(N)中STC1的mRNA表达水平的比值(T/N)如下:T/N≥10的有6例,T/N≥5且<10的有4例(T/N≥5,癌组织的STC1显著高于癌旁组织);T/N≥1.25且<5的有6例(1.25≤T/N<5,被认为癌组织STC1表达显著高于癌旁组织);T/N≥0.75且<1.25的有2例(0.75≤T/N<1.25,被认为癌组织与癌旁组织中的STC1表达水平的差异无统计学显著性),T/N<0.75的有2例(T/N<0.75,被认为癌组织中的STC1的表达显著低于癌旁组织),见图1C。同时,Western blot检测了4例结肠癌患者组织中STC1的蛋白表达水平,发现在癌组织中STC1蛋白表达水平显著高于癌旁组织(P<0.01),这一结果与RT-qPCR的结果类似,见图2。
2 STC1的表达与结肠癌的肿瘤分期和预后的关系
通过对TCGA结肠癌患者数据库中41例正常人对照,45例1期患者,110例2期患者以及80例3期患者结肠组织的分析,发现不同分期的结肠癌组织STC1的表达都显著高于正常的结肠组织(P<0.01),而且通过分析比较发现,肿瘤分期越高,STC1的表达水平越高(P<0.05),见图3A。通过对TCGA数据库440例结肠癌患者的生存期分析发现,STC1高表达组的生存期显著小于STC1低表达组(P<0.05),见图3B。
3 缺氧条件下诱导STC1的表达
用CoCl2模拟体外缺氧环境,发现HT-29细胞STC1的mRNA水平和蛋白水平均显著上调(P<0.01),见图4A、C。采用1% O2的条件培养HT-29细胞,发现STC1的表达也随着缺氧诱导时间的延长而上调(P<0.01),见图4B、D。进一步通过TIMER数据库分析发现,STC1的mRNA表达水平与HIF1α的mRNA表达水平呈正相关关系(相关系数为0.518),而且HIF1α的下游基因TIMP1的mRNA表达与STC1的mRNA水平也存在一定的正相关关系(相关系数为0.393),见图5。

Figure 1.The mRNA level of STC1 was over-expressed in colon cancer tissues. The expression of STC1 was evaluated in TCGA samples (A) and Skrzypczak samples (B) in Oncomine. The mRNA expression levels of STC1 (C) in 20 paired collected colorectal cancer tissues and corresponding paratumor tissues from clinical surgery were determined by RT-qPCR T: tumor tissue; N: corresponding paratumor tissue. Mean±SD.**P<0.01vsnormal colorectal tissues.
图1STC1mRNA在结肠癌组织中的表达水平
4 炎症刺激条件下STC1的表达变化
脂多糖处理结肠癌HT-29细胞2、6和12 h,STC1的mRNA表达和蛋白表达水平显著增加(P<0.01),并且通过时间梯度的分析发现,炎症刺激的条件下,结肠癌HT-29细胞中STC1的表达水平迅速变化,在诱导6 h后,STC1的蛋白及mRNA的表达达到最高水平,见图6。
5 STC1与炎症分子的表达和肿瘤组织中免疫细胞浸润水平的关系
分析发现结肠癌组织中STC1的mRNA表达水平与多种炎症免疫分子之间存在正相关的关系,STC1的mRNA表达水平与IL-6、IL-8、IL-10、IL-1β、TGF-β1、TGF-β2、TNF、CCL3和CCL4 mRNA水平的相关系数依次为0.568、0.454、0.327、0.357、0.389、0.449、0.267、0.452、0.462,见图7。并且在结肠癌中,STC1的mRNA表达与肿瘤组织中免疫细胞(巨噬细胞、中性粒细胞和树突状细胞)的浸润水平存在正相关的关系,其中STC1的mRNA表达水平与结肠癌肿瘤组织中巨噬细胞、中性粒细胞及树突状细胞的浸润水平的相关系数分别为0.329、0.518和0.409,见图8。
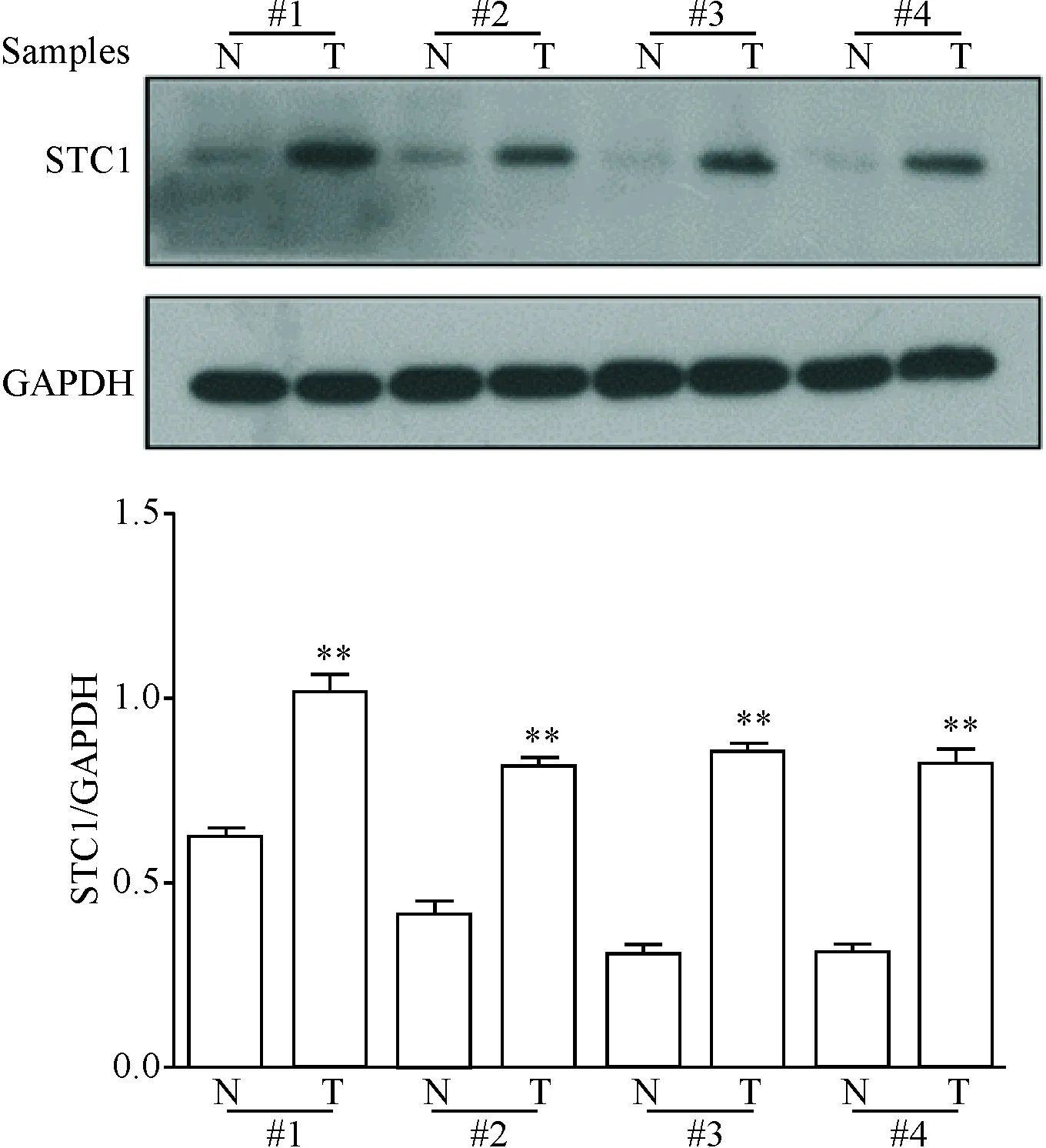
Figure 2.The protein expression of STC1. T: colon tumor tissue; N: corresponding paratumor tissue. Mean±SD.n=3.**P<0.01vsN.
图2STC1蛋白在结肠癌组织中高表达
讨 论
斯钙素是一类调节机体钙、磷平衡,参与骨骼发育、应激反应等机体生理活动的糖蛋白[9-10]。目前关于STC1生物学功能的研究主要集中在恶性肿瘤领域。已有研究报道,STC1在肝癌、肺癌和乳腺癌等恶性肿瘤的发展过程中发挥重要的作用。Chan等[3]报道在肝癌中STC1的高表达与不良预后密切相关,并且能够通过影响JNK信号网络促进肝癌的转移;Bai等[11]发现在前列腺癌中STC1能够通过影响细胞周期促进增殖,并且STC1可以作为新的前列腺癌诊断的分子标志物;Chang等[4]发现在乳腺癌中STC1的表达水平与肿瘤的增殖和转移能力存在紧密联系;这些证据提示我们,STC1在多种恶性肿瘤中扮演着促癌分子的角色,介导肿瘤的多种生理过程,然而也有研究发现在宫颈癌中STC1可以抑制肿瘤的增殖转移过程[12],而STC1在结肠癌中的研究还鲜有报道。我们通过UALCAN和Oncomine等数据库筛选发现,在结肠癌组织中,相对于正常结肠组织,STC1呈过度表达的状态。为了进一步验证数据库筛选的结果,我们通过RT-qPCR和Western blot实验检测了临床收集的20例结肠癌患者样本,分析癌组织与癌旁组织中STC1的mRNA和蛋白表达水平,进一步证实STC1在结肠癌组织中高表达,其可能参与结肠癌的调节过程。
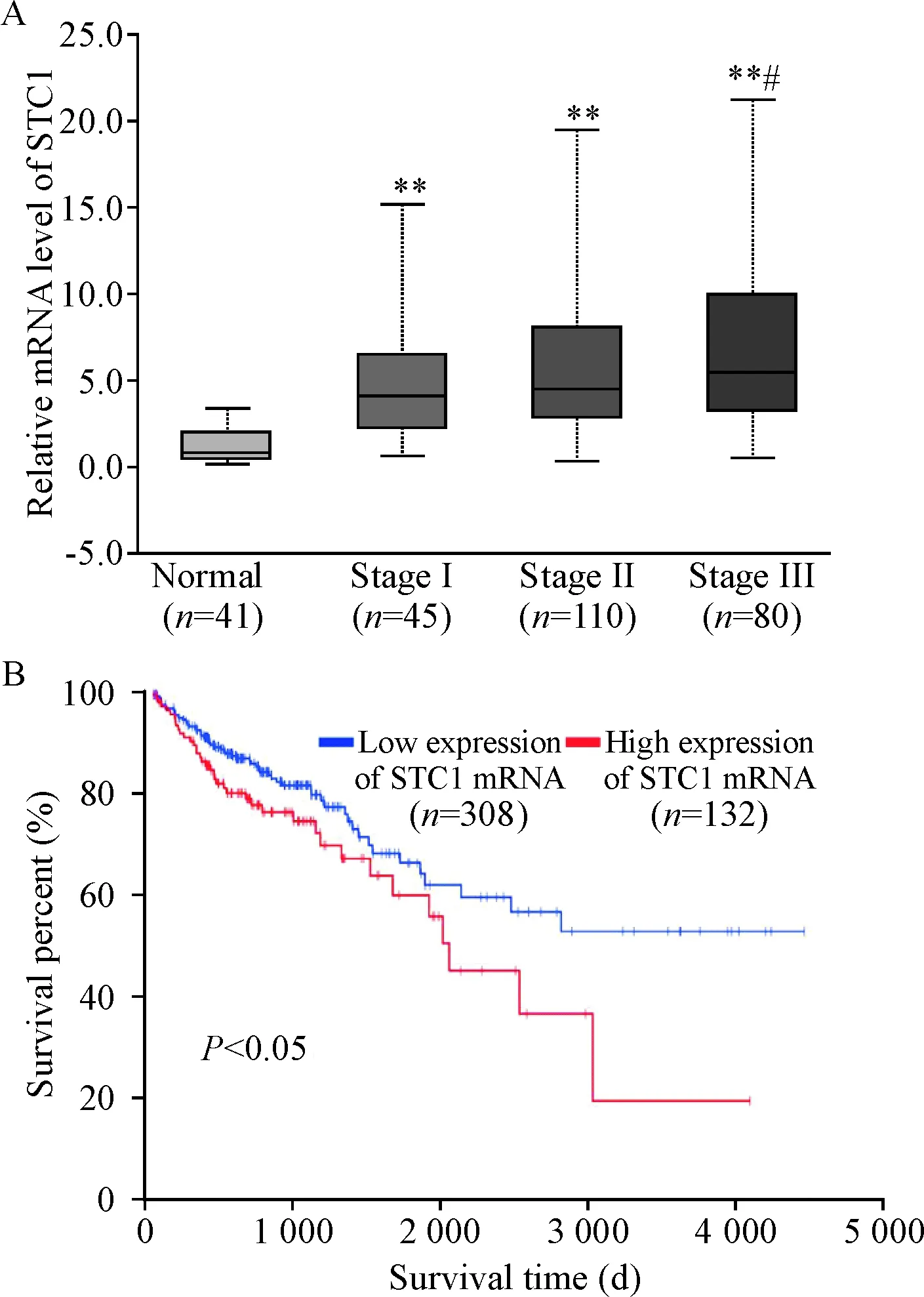
Figure 3.The mRNA expression of STC1 was closely correlated with the tumor (A) stage and prognosis (B) in colorectal cancer in TCGA database.**P<0.01vsnormal;#P<0.05vsstageⅠ.
图3TCGA数据库中STC1的mRNA表达与结肠癌患者肿瘤分期及预后密切相关
预后是恶性肿瘤治疗过程中的一个重要方面,为治疗方案的选择及干预提供重要的参考[13]。本研究中发现STC1在结肠癌组织中存在过表达的情况,那么STC1的表达水平是否和结肠癌患者的预后水平存在联系呢?我们通过对不同肿瘤分期的结肠癌患者STC1表达分析发现,随着肿瘤分期的升高,STC1的表达水平也随之上调,提示STC1可能介导结肠癌的发展。同时相对于正常结肠组织,即使是初期结肠癌患者组织中STC1的表达水平也显著上升,因此STC1有可能成为结肠癌早期诊断的重要指标。本研究还通过对患者生存期的分析,发现STC1的过表达预示结肠癌患者的预后不良。因此STC1是一个新颖的结肠癌预后的分子诊断标志物,有可能为结肠癌的诊断和治疗提供科学的理论支持。
肿瘤微环境是肿瘤细胞赖以生存的复杂环境,主要由细胞成分和非细胞成分组成,近年来,大量研究发现肿瘤微环境在肿瘤的增殖、转移以及耐药性方面扮演着重要的角色,其中缺氧和炎症是肿瘤微环境最重要的2个方面[14]。本研究中发现,缺氧刺激条件下,STC1的表达显著上升,而且STC1与HIF1α及其下游基因TIMP1的表达存在正相关的关系。而大量的研究报道组织缺氧环境能够促进结肠癌的疾病进程[15],这表明STC1可能在结肠癌肿瘤缺氧微环境中发挥重要的功能,而缺氧是如何诱导STC1表达的,还有待进一步深入的研究。炎症免疫反应是另一个非常重要的肿瘤微环境,炎症细胞和免疫细胞是重要的肿瘤微环境细胞组成成分,而各种介导炎症免疫的细胞因子和趋化因子是肿瘤微环境重要的非细胞成分[16]。本研究中我们发现脂多糖诱导的炎症反应条件下,结肠癌HT-29细胞中STC1会被大量诱导表达,并且通过分析TCGA结肠癌组织中STC1与炎症调节分子IL-6、IL-8、IL-10、IL-1β、TNF-、CCL3和CCL4表达的相关性发现,STC1与多种炎症免疫分子存在正相关关系。此外我们发现结肠癌组织中STC1的表达水平与肿瘤组织中免疫细胞的浸润水平亦存在正相关关系。这些证据提示STC1可能在炎症介导的结肠癌发生发展过程中发挥关键作用。在结肠癌中,STC1与炎症免疫调节的具体方式和机制,以及两者调控网络在结肠癌的增殖和转移方面发挥着怎样的作用,有待进一步的研究。

Figure 4.STC1 was over-expressed under hypoxia condition. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsnormoxia group.
图4缺氧促进STC1的mRNA和蛋白表达

Figure 5.The mRNA expression of STC1 was positively correlated with the expression of HIF1α and TIMP1 in the 457 colon cancer tissues with analysis of TIMER database.n=457.
图5TIMER数据库中457例结肠癌组织的STC1mRNA水平与HIF1α和TIMP1之间存在正相关关系

Figure 6.LPS induced the expression of STC1 at mRNA (A) and protein (B) levels in the colon cancer HT-29 cells at the indicated time points. Mean±SD.n=3.**P<0.01vs0 h.
图6脂多糖(LPS)处理不同时间对结肠癌HT-29细胞STC1表达的影响
Figure 7.The mRNA expression of STC1 was positively correlated with the expression of inflammatory factors in the 457 colon cancer tissues with analysis of TIMER database.n=457.
图7TIMER数据库中457例结肠癌组织STC1mRNA水平与炎症基因的表达呈正相关关系
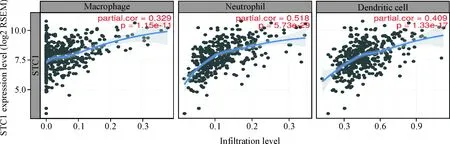
Figure 8.STC1 mRNA expression was positively correlated with the levels of tumor-infiltrating immune cells in 457 colon cancer tissues with analysis of TIMER database.n=457.
图8TIMER数据库中457例结肠癌组织的STC1mRNA表达与肿瘤组织免疫细胞的浸润水平存在正相关关系
综上所述,本研究发现STC1在结肠癌组织中呈高表达,且STC1的过表达与结肠癌的分期和不良预后呈正相关的关系,STC1有可能是结肠癌早期诊断和不良预后的一个新的分子标志物。非常有意思的是,本研究还发现STC1与结肠癌肿瘤微环境,特别是与结肠癌的缺氧及炎症免疫调节存在密切的调控关系。
