SO2 衍生物通过 NLRP3 炎症小体促进气道上皮细胞炎症发生*
2019-04-22刘华勇骆文志陈嘉伟黄志宏刘升明
陈 丽, 刘华勇, 骆文志, 陈嘉伟, 吴 义, 黄志宏, 刘升明
(暨南大学附属第一医院, 广东 广州 510632)
NLRP3 炎症小体是宿主细胞识别病原微生物、启动固有免疫应答的关键炎症信号平台,位于细胞胞浆,由NLRP3 N端的pyrin结构域(pyrin domain, PYD)与接头蛋白 ASC(apoptosis-associated speck-like protein containing a caspase recruitment domain)和caspase-1相互结合形成[1]。目前认为, NLRP3 炎症小体的激活调控分为2个步骤[1-2]: 第1步启动阶段,经NF-κB或激活AP-1等活化途径,上调 NLRP3 和其它组分的 mRNA 表达,再进行翻译后修饰;第2步激活阶段,促进 NLRP3/ASC/pro-caspase-1 蛋白复合物组装, pro-caspase-1 自剪切成活化形式,活化的 caspase-1 将白细胞介素1β和白细胞介素18前体剪切活化释放到胞外,引起炎症发生,甚至细胞死亡。活性氧簇(reactive oxygen species, ROS)、ATP、病毒、支原体及其它病原体和晶体颗粒等都可以激活 NLRP3 炎症小体[2]。但是,这些不同的刺激物激活 NLRP3 炎症小体的机制尚不清楚。有研究显示 NLRP3 炎症小体参与哮喘、慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)和肺纤维化等肺部疾病的发生发展[1, 3-4]。

为了探讨气道上皮细胞内 NLRP3 炎症小体是否直接参与 SO2及其衍生物引起的气道炎症反应,本文拟使用不同浓度 SO2衍生物刺激支气管上皮细胞16HBE,并通过RNA干扰技术沉默NLRP3基因及使用ROS 清除剂N-乙酰半胱氨酸(N-acetyl cys-teine,NAC)预处理 16HBE 细胞等方法,观察 SO2衍生物对 NLRP3 炎症小体活化的影响,为 NLRP3 炎症小体作为呼吸系统抗炎治疗新靶点提供理论依据。
材 料 和 方 法
1 实验试剂和材料
1.1细胞株 16HBE 细胞株由暨南大学附属第一医院呼吸科蔡兴东博士馈赠。
1.2主要试剂 NaHSO3和Na2SO3(上海阿拉丁生化技术有限公司);MTT(Sigma);NAC和ROS试剂盒(碧云天生物技术有限公司);抗NLRP3、caspase-1 p20和GAPDH 抗体(Cell Signaling);IL-1β ELISA 试剂盒(R&D);化学合成NLRP3小干扰RNA(small interfering RNA, siRNA;广州锐博生物科技有限公司); Lipofectamine 2000(Invitrogen)。
2 实验方法
2.1细胞分组 将细胞分为对照(control)组和 SO2衍生物干预组,均使用含 10% FBS 的高糖 DMEM培养基,置于37 ℃、5% CO2培养箱进行培养。
2.2SO2衍生物的配制 参考Li等[9]的实验方法,将 Na2SO3和NaHSO3的混合溶液(二者物质的量比为 3∶1)稀释成不同浓度作用于16HBE细胞12 h。
2.3MTT 法检测不同浓度SO2衍生物对16HBE细胞的活力影响 收集对数期 16HBE 细胞,用含有 10% FBS 的高糖 DMEM 培养基调制成单细胞悬液,以2.5×107/L的细胞密度接种于 96 孔板上;37 ℃、5% CO2培养箱培养24 h,细胞贴壁换液。将配制好的 SO2衍生物混合溶液分别稀释为 0.5 mmol/L、1 mmol/L、2 mmol/L、3 mmol/L、4 mmol/L 和 5 mmol/L 6个浓度,每个浓度3个复孔。观察12 h,去培养基,加入新鲜培养基100 μL后加入 0.5 g/L MTT 10 μL,37 ℃ 培养箱孵育4 h;去上清,每孔加入100 μL DMSO,放置在微量振荡器上振荡 10 min;最后在酶标仪上使用 570 nm波长测吸光度(A)值。
2.4流式细胞仪检测细胞内ROS水平 将5×105个细胞接种至6孔板中,24 h后去培养基,PBS 洗2次,分别加入含有 0.5 mmol/L、 2 mmol/L 和 4 mmol/L SO2衍生物和 10% FBS的 DMEM,设定空白对照组和不同浓度 SO2衍生物组,观察12 h;消化细胞后用 PBS 洗 1 次,1 000 r/min 离心 5 min,去 PBS 无血清DMEM 重悬,对照组分出 200 μL不染色; PBS 清洗 2 次,1 000 r/min 离心 5 min,去上清;加入 DCFH-DA 染色剂 200 μL,混匀后避光,37 ℃ 孵育 20 min,间断混匀;上流式细胞仪检测。
2.5转染 取对数生长期的16HBE细胞接种于 6 孔板,干预组加入 2 mmol/L SO2衍生物刺激 24 h,待细胞融合至 30%~50%,去上清液,用 PBS 清洗 2 次;将含有NLRP3 siRNA 和 Lipofectamine 2000 混合的无血清 DMEM 滴入 6 孔板的待转染细胞中,放置 37 ℃、5% CO2培养箱中孵育 6 h;去上清,用 PBS 清洗 2 次;加入新鲜含 10% FBS DMEM 培养基 2 mL,转染 24 h 后再加入刺激物 2 mmol/L SO2衍生物,观察 12 h。
2.6NAC干预实验 参考Huang 等[11]的实验方法,使用5 mmol/L NAC 孵育1 h后,加入2 mmol/L SO2衍生物刺激 16HBE 细胞,置于37 ℃、5% CO2培养箱进行培养 12 h,收集细胞行相关指标检测。
2.7Western blot 检测 NLRP3 炎症小体蛋白表达 将对数生长期的 16HBE细胞接种至 6 孔板中,待细胞融合至 60% 时更换为无血清培养,24 h 后分别加入不同浓度的 SO2衍生物刺激,观察 12 h。去培养液,加入预冷 PBS 缓冲液,清洗 3 次,每孔加入 100 μL预冷含有 PMSF 的细胞裂解液(1∶100),冰上裂解;将裂解液用超声细胞粉碎机继续裂解细胞后放入低温高速离心机,4 ℃、12 000 r/min,30 min;收集上清液至 EP 管中,取少量用于 BCA 蛋白检测,余分装,-80 ℃ 保存。按照 BCA 试剂盒说明测定总蛋白浓度,将检测后的蛋白样品变性后用于 SDS-PAGE。变性后的蛋白样品通过 10% SDS-PAGE 分离并转移到 PVDF 膜,随后进行常规Western blot实验。
2.8ELISA检测细胞上清液中IL-1β浓度 同2.5和2.6细胞准备,上清液分别移入1.5 mL EP 管中,放置于 -80 ℃ 保存。使用前将所有试剂平衡至室温;根据 R&D ELISA 试剂盒说明书配置标准品及测试。每个样品设 3 个复孔。
3 统计学处理
本文所有数据使用均数±标准差(mean±SD)表示,方差齐的使用单因素方差分析(one-way ANOVA)。所有数据由 SPSS 16.0 软件进行分析。以P<0.05为差异有统计学意义。
结 果
1 不同浓度 SO2 衍生物对细胞活力的影响
本实验使用不同浓度的 SO2衍生物分别刺激 16HBE 细胞后,观察 12 h。通过MTT 检测方法测定细胞活力。结果显示,低浓度(0.5和1 mmol/L)的 SO2衍生物对 16HBE 细胞无细胞毒性,中、高浓度(2 mmol/L、3 mmol/L、4 mmol/L和5 mmol/L)的 SO2衍生物刺激 16HBE 细胞后,细胞活力显著降低(P<0.05),见图1。
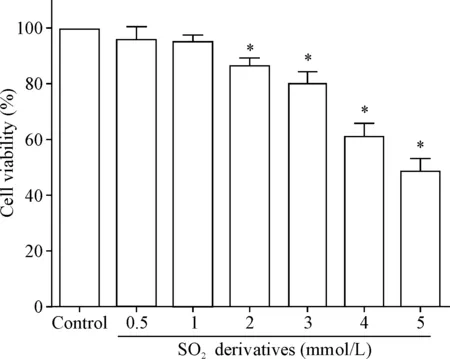
Figure 1.The viability of 16HBE cells stimulated with various concentrations of SO2derivatives for 12 h was determined by MTT assay. Mean±SD.n=3.*P<0.05vscontrol group.
图1不同浓度SO2衍生物对16HBE细胞活力的影响
2 SO2衍生物激活 16HBE 细胞的 ROS生成
我们根据 MTT 结果选定 0.5 mmol/L、2 mmol/L和4 mmol/L 的 SO2衍生物分别刺激 16HBE 细胞 12 h,结果显示,2和4 mmol/L 浓度组的 ROS 水平显著升高(P<0.05);与对照组比较,0.5 mmol/L浓度组ROS有升高,但是没有统计学意义,见图2。
3 不同浓度 SO2 衍生物对细胞 NLRP3 炎症小体表达的影响
与正常对照组比较,各浓度组的 SO2衍生物刺激 16HBE 细胞12 h,细胞内的 NLRP3蛋白水平均明显上调(P<0.05);2和4 mmol/L 浓度组细胞内的caspase-1 p20 蛋白和细胞上清液中 IL-1β 的浓度明显升高(P<0.05),0.5 mmol/L 浓度组 caspase-1 p20和IL-1β 的表达稍有升高,但差异无统计学意义,见图3。
4 SO2 衍生物通过NLRP3炎症小体诱导IL-1β生成
将2 mmol/L的 SO2衍生物作为 siRNA 实验刺激浓度。结果显示,与2 mmol/L 干预组比较,NLRP3 siRNA 组细胞内的 NLRP3和caspase-1 p20 蛋白水平明显降低(P<0.05),且细胞上清液中 IL-1β 的浓度明显下降(P<0.05),见图4。
5 SO2 衍生物作用于转染 NLRP3 siRNA 的16HBE 细胞后 ROS 的变化情况
与正常组比较,不论是否对 16HBE 细胞转染NLRP3 siRNA,经 2 mmol/L SO2衍生物刺激的细胞内ROS均明显升高(P<0.05);但是与 2 mmol/L SO2衍生物干预组相比,使用2 mmol/L SO2衍生物刺激后转染NLRP3 siRNA的 16HBE细胞内 ROS 水平的差异无统计学意义,见图5。

Figure 2.Treatment with different concentrations of SO2derivatives for 12 h induced reactive oxygen species (ROS) production. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vs0.5 mmol/L group.
图2不同浓度SO2衍生物刺激16HBE细胞12h细胞内ROS生成的变化

Figure 3.The protein expression of NLRP3 and caspase-1 p20 (A) and the level of IL-1β (B) in the 16HBE cells stimulated with different concentrations of SO2derivatives for 12 h. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vs0.5 mmol/L group.
图3不同浓度SO2衍生物对细胞NLRP3和caspase-1p20蛋白表达及上清液IL-1β浓度的影响

Figure 4.The protein expression of NLRP3 and caspase-1 p20 (A) and the level of IL-1β (B) in the 16HBE cells stimulated with 2 mmol/L SO2derivatives after transfected withNLRP3 siRNA. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsSO2derivatives group.
图416HBE细胞转染NLRP3siRNA后SO2衍生物对细胞NLRP3和caspase-1p20蛋白表达及上清液IL-1β浓度的影响
6 SO2 衍生物经过 ROS 作用于 NLRP3 炎症小体
与正常组比较, 2 mmol/L SO2衍生物干预组及 NAC 组中,细胞内的 NLRP3和caspase-1 p20 蛋白表达及细胞上清液中 IL-1β 的浓度均明显升高(P<0.05);与2 mmol/L SO2衍生物干预组比较, NAC 组细胞内的 NLRP3和caspase-1 p20 蛋白表达及细胞上清液中 IL-1β的浓度下调(P<0.05),见图6。
讨 论
气道炎症是多种肺部疾病的共同特点,常常与有毒颗粒或气体的显著暴露有关。SO2是一种全球性大气污染物,长时间暴露于 SO2中可引起多种气道炎症性疾病,高浓度吸入可引起肺损伤,甚至危及生命[5, 7, 10]。既往研究已经证实 4.3 mg/m3的SO2可引起呼吸道炎症,在体内研究中也观察到实验动物气道阻力的增加[8]; Tam等[7]研究发现慢性暴露在含有较高SO2的酸性火山空气污染源,与夏威夷学龄儿童咳嗽和小气道功能受损(肺功能FEV1/FVC<0.8)有直接关系;一项回顾性分析共同存在心血管疾病 COPD 患者病情加重住院原因的研究结果显示,入院前患者暴露在至少 30 d或更长时间的大气污染中,且大气中 SO2的含量与 COPD 急性加重的相对风险(relative risk,RR)呈显着相关性(RR 1.04~1.05;P<0.05)[6];Yun等[12]在观察小鼠心脏和肺部损害时发现,SO2可以引起氧化应激、 DNA 损伤和膜通道改变,炎症因子 TNF-α 和 IL-1β mRNA 等的表达水平明显增加,但具体机制仍不清楚。本研究也观察到 SO2刺激 16HBE 细胞后细胞内 ROS 明显升高,细胞外 IL-1β 分泌增加,说明有氧化应激和炎症反应发生。
越来越多研究证实了气道炎症与吸入污染物或过敏原后支气管上皮出现的免疫反应有关系[13-14]。NLRP3 炎症小体过度激活可导致组织损伤,使得慢性炎症持续[1]。因此,作为固有免疫反应和炎症之间重要桥梁的 NLRP3 炎症小体也备受人们关注。有研究使用可吸入性颗粒诱导野生型小鼠和NLRP3 基因敲除小鼠建立气道炎症模型,结果显示小鼠肺内 IL-1β 表达的升高依赖于 NLRP3,且小鼠胸内淋巴结数目明显增加[13]。我们前期研究观察到 COPD 患者支气管上皮细胞 NLRP3 和 caspase-1 蛋白表达较正常组增高;体外研究显示生物燃料烟雾提取物激活支气管上皮细胞内的 NLRP3 炎症小体,并促进炎症因子 IL-1β和CXCL-8 释放[15]。这些研究基本都是以含有颗粒性状物质为干预组,来说明 NLRP3 炎症小体参与了气道炎症的发生;但对于挥发性物质或者气体的相关研究甚少。
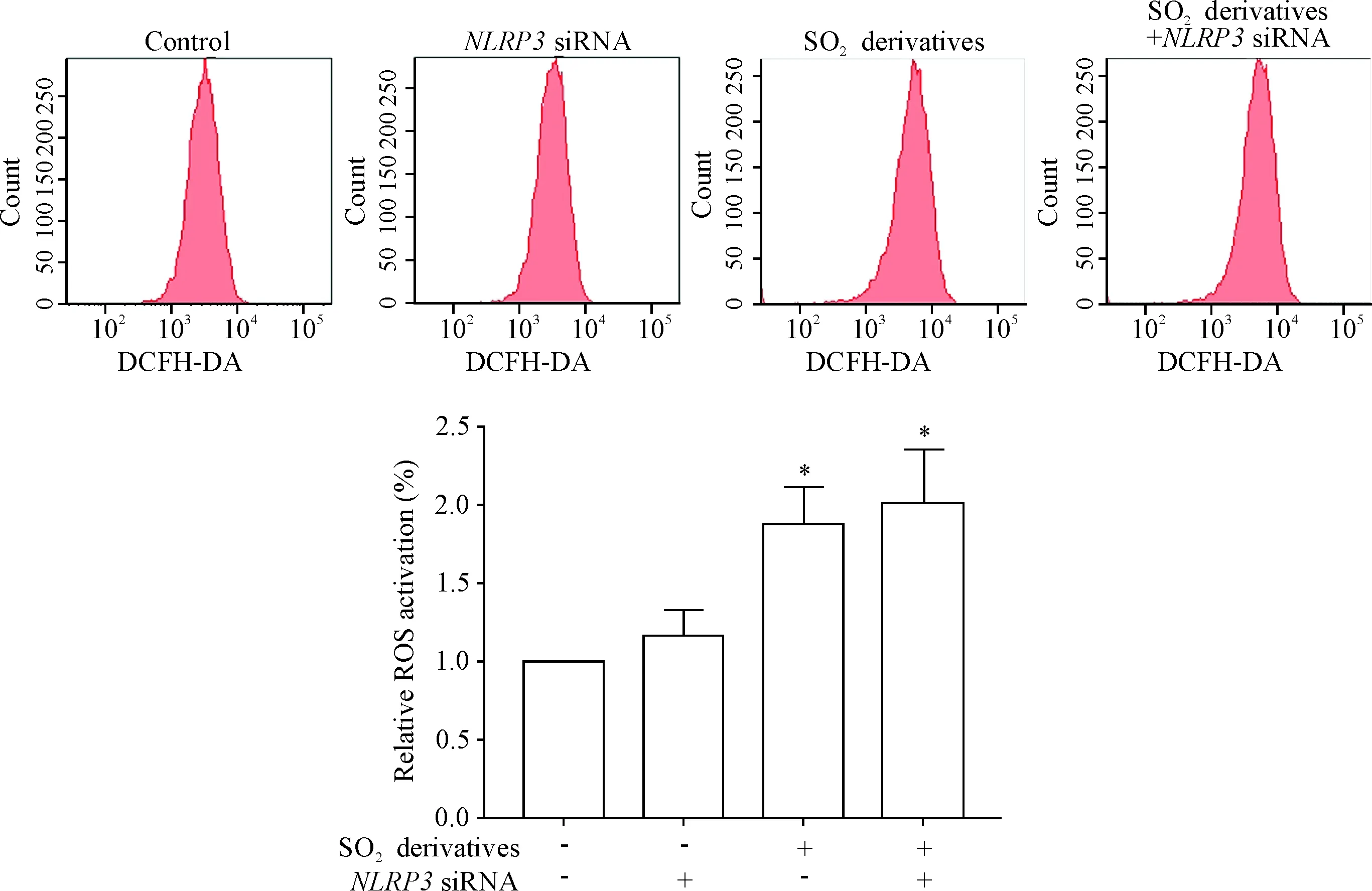
Figure 5.The producttion of intracellular ROS in the 16HBE cells stimulated with 2 mmol/L SO2derivatives after transfected withNLRP3 siRNA. Mean±SD.n=3.*P<0.05vscontrol group.
图516HBE细胞转染NLRP3siRNA后SO2衍生物对细胞内ROS的影响
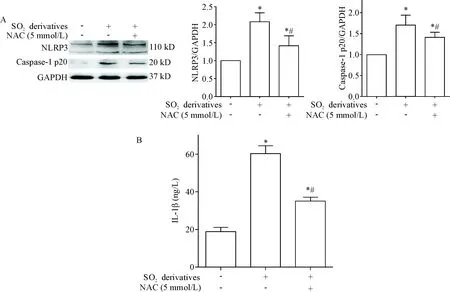
Figure 6.The protein expression of NLRP3 and caspase-1 p20 (A) and the level of IL-1β (B) in the 16HBE cells stimulated with 2 mmol/L SO2derivatives after blocked with NAC. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsSO2derivatives group.
图6使用NAC干预16HBE细胞后SO2衍生物对细胞NLRP3和caspase-1p20蛋白表达及IL-1β浓度的影响
为了观察挥发性物质或者气体是否激活 NLRP3 炎症小体?本研究使用不同浓度的 SO2衍生物为干预组观察支气管上皮细胞内 NLRP3 炎症小体的变化。结果显示,在中、高浓度组细胞内NLRP3和caspase-1 p20的蛋白表达量增加,上清液中IL-1β 分泌明显增加,说明SO2衍生物可以激活 NLRP3 炎症小体促进炎症因子释放。为了探讨 SO2衍生物对NLRP3 炎症小体及 IL-1β 表达的影响及可能性机制。我们使用 siRNA 沉默 16HBE 细胞NLRP3基因后,caspase-1 p20 和 IL-1β 表达均明显减少,但是细胞内 ROS 没有明显变化。为了进一步观察 SO2衍生物是否经 ROS 作用于 NLRP3炎症小体,我们使用NAC提前干预16HBE细胞, NLRP3和caspase-1 p20 蛋白和 IL-1β 表达明显下降,但是仍然高于对照组。以上结果说明 SO2衍生物激活 NLRP3 炎症小体并不完全经过 ROS,推测 SO2进入细胞后除了可以引起细胞内 ROS 增加外,自身可能与 ATP 等物质一样作为内源性危险信号损伤相关的分子模式(damage- associated molecular patterns, DAMPs)直接作用于细胞内 NLRP3 影响炎症小体活性,进而影响炎症因子释放。本研究为我们进一步探讨 SO2与 NLRP3 炎症小体的蛋白修饰之间的关系提供了基础数据,为 NLRP3 炎症小体作为新的气道炎症新靶点提供理论支撑。
