急性缺血性脑卒中大鼠脑组织中Th17/Treg的变化*
2019-04-22程建华黄一睿肖美娟
程建华, 黄一睿, 肖美娟, 韩 钊
(1温州医科大学附属第一医院神经内科, 2温州市中西医结合医院检验科, 3温州医科大学附属第二医院神经内科, 浙江 温州 325000)
脑卒中是严重危害人类健康的常见疾病,具有高发病率、高死亡率和高致残率等特点。急性缺血性脑卒中是最常见的脑卒中类型,占全部脑卒中的 60%~80%。缺血性脑卒中确切的病理生理机制仍不非常清楚。Louveau等[1]发现了硬脑膜窦内的功能性淋巴管,这些淋巴管与深部颈淋巴结相连,能表达淋巴管内皮细胞的所有分子标志物,并且能够从脑脊液中携带免疫细胞,这为我们研究缺血性脑卒中的免疫炎症机制提供了更丰富的解剖学基础。最近的研究表明免疫炎症反应在急性缺血性卒中的病理生理过程中发挥着重要的作用[2-3]。辅助性T细胞17 (T helper 17 cells,Th17)及调节性T细胞(re-gulatory T cells, Treg)是2类来源于CD4+T细胞的重要的免疫细胞。Th17细胞主要参与早期炎症反应,分泌促炎因子白细胞介素17(interleukir-17,IL-17)等;Treg 则分泌抗炎因子IL-10等,减轻外周和脑组织的促炎因子,发挥抑制炎症的作用[4]。Th17/Treg平衡在炎症反应中起着重要的作用[4],Th17/Treg失衡可能引起免疫应答异常,与多种疾病的发生和发展密切相关[5-7]。虽然较多文献报道了缺血性卒中患者的外周血液存在Th17/Treg功能失衡的表现,然而目前尚未检索到关于急性缺血性脑卒中后脑组织Th17/Treg变化的文献,本研究拟探讨急性缺血性脑卒中大鼠脑组织中Th17/Treg的变化及意义。
材 料 和 方 法
1 实验动物
16只雄性SD大鼠,体重250~300 g,购自上海斯莱克实验动物有限公司,许可证号为SCXK(沪)2012-0002。16只大鼠随机分为实验组及对照组,每组8只, SPF环境下饲养。
2 主要仪器与试剂
线栓(北京沙东生物技术有限公司,货号:2636-50);NovoCyte流式细胞仪(ACEABIO);全波长酶标仪(1681130-4B)和CFX Connect Real-Time PCR Detectiont System(Bio-Rad,配套使用的分析软件为Bio-Rad CFX Manager 3.1)。水合氯醛(国药集团化学试剂有限公司);TTC染色液(北京雷根生物技术有限公司);白细胞介素10(interleukin-10, IL-10) ELISA 试剂盒(货号:70-EK3172/2)和IL-17A ELISA 试剂盒(货号:70-EK3102/2,MultiSciences);抗FOXP3、CD4、IL-17A和IL-10抗体(eBioscience);高纯总RNA快速提取试剂盒(Generay);RevertAid First Strand cDNA Synthesis Kit(Thermo);SsoAdvance Universal SYBR Green Supermix(Bio-Rad)。RT-qPCR引物由自英潍捷基(上海)贸易有限公司合成。引物序列见表1。

表1 RT-qPCR引物序列
3 方法
3.1大鼠急性缺血性脑卒中模型制作 参照Zea Longa 线栓法再加以改进制作SD大鼠急性缺血性大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,以左侧大脑栓塞为例 。大鼠术前禁食12 h,自由饮水。实验前腹腔注射10%水合氯醛(350 mg/kg)麻醉,颈部正中切口,分离左侧颈总动脉、颈内动脉、颈外动脉和迷走神经。颈总动脉打一活结,在颈外动脉离心端1 cm处结扎颈外动脉,同时夹闭颈内动脉,然后在颈外动脉上做一小切口,将线栓插入后剪断颈外动脉,之后将线栓沿着颈内动脉入颅的方向插人,当插入约距颈总动脉分叉处18~20 mm左右时感到一轻微阻力时便立即停止插入,即表明已经阻塞大脑中动脉。阻断120 min后,线栓拔出,解除颈总动脉活结,贯通颈总动脉与颈内动脉通路。假手术(sham)组除将线栓插入深度不阻塞大脑中动脉外,其余均与上述手术步骤相同。假手术组作为对照。采用Longa评分法观察缺血性脑卒中大鼠神经功能缺损情况。评分标准如下:0分:无神经功能缺损症状;1分:轻度局灶性神经功能缺损(提尾时不能完全伸展右侧前肢);2分:中度局灶性神经功能缺损(行走时向右侧旋转);3分:重度局灶性神经功能缺损(自主运动时间向右侧倾斜);4分:不能自发行走,意识障碍。MCAO组需剔除MCAO术后神经症状评分0分及4分的动物。
3.2TTC染色 取上述2组大鼠大脑,每组4只,在MCAO术后3 d通过TTC染色观察各组大鼠脑梗死体积。在术后3 d对各组大鼠进行腹腔麻醉,取脑,每隔2 mm连续切6个冠状切片。立即将脑组织切片浸入盛有2%TTC溶液的玻璃皿中,脑组织表面覆盖盖玻片,避光、37℃恒温孵育15 min,使脑片着色。正常组织染为红色,梗死灶染成白色,取出脑切片,蒸馏水冲洗,置于4%多聚甲醛中固定24 h后,将所有脑切片按同侧顺序排列,拍照,采用IPP6.0进行图像处理分析,并校正每个脑片中的梗死面积及脑水肿引起的差异。计算梗死灶(苍白区)范围,将每一脑片的梗死面积乘以2 mm厚度,再将各脑片数值相加后得到梗死体积的近似值[8]。
3.3ELISA检测脑组织中IL-17A和IL-10的含量 大鼠MCAO术后3 d,腹腔麻醉,取脑,去除小脑及脑干,立即置于液氮中研磨,提取蛋白。运用ELISA法检测IL-10和IL-17A的含量。首先加入300 μL 1×洗液静置浸泡30 s,弃掉洗液。复孔加入100 μL 2倍倍比稀释的标准品。空白孔复孔加入100 μL标准品稀释液。样本孔加入80 μL 1×检测缓冲液和20 μL样本。每孔加入50 μL稀释的检测抗体。使用封板膜封板。300 r/min转振荡,室温孵育2 h。弃掉液体,每孔加入300 μL洗液洗板,洗涤6次。每次洗板,在吸水纸上拍干。每孔加入100 μL稀释的辣根过氧化物酶标记的链霉亲和素。使用新的封板膜封板。300 r/min振荡,室温孵育45 min。每孔加入100 μL TMB底物显色液,避光,室温孵育5~30 min。每孔加入100 μL终止液。颜色由蓝色变为黄色。使用酶标仪进行双波长检测,测定450 nm最大吸收波长和570 nm或630 nm参考波长下的吸光度(A)值。
3.4RT-qPCR检测脑组织中IL-17、IL-10、Foxp3和RORrt的mRNA水平 麻醉大鼠后直接断头取脑,立即置于液氮中,再转移到-80℃保存。采用TRIzol-离心柱法提取细胞总RNA,取2 μL RNA溶液于BioDrop检测RNA纯度和浓度。利用逆转录试剂盒进行逆转录,-70 ℃保存cDNA。利用SsoAdvance Universal SYBR Green Supermix在实时定量PCR仪上进行荧光定量PCR扩增实验。反应条件为:95.0 ℃ 3 min; 95.0 ℃ 15 s、 59.0 ℃ 30 s、 72.0 ℃ 30 s,运行40个循环。利用Bio-Rad CFX Manager 3.1分析软件进行分析。
3.5流式细胞术检测组织中Th17/Treg的变化 用生理盐水冲洗大鼠脑组织,迅速放入含PBS液的培养皿中;将脑组织剪碎转移到2 mL PE管,加0.25%的胰酶1 mL,37 ℃水浴消化10 min;加血清终止消化后300目尼龙网过滤,1 000 r/min离心5 min;加PBS液漂洗稀释细胞,制备成单细胞细胞悬液,用PBS定容细胞,计数后调整浓度为5×109/L。每管取100 μL单细胞悬液,1 000 r/min离心5 min, 后用4%多聚甲醛室温固定30 min,0.1%Triton X-100室温处理15 min,PBS漂洗,10%BSA-PBS重悬(100 μL)。细胞用anti-rat CD4-APC、anti-rat Foxp3-FITC和anti-rat IL-17A-FITC标记表面抗原及核内抗原。4 ℃孵育过夜,PBS漂洗2次,500 μL PBS重悬,上机做流式检测。
4 统计学处理
实验数据用均数±标准差(mean±SD)表示,应用SPSS 16.0软件对数据进行统计学分析, 2组大鼠的组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 急性脑缺血模型的制备
应用线栓法制作脑缺血模型,采用Longa评分法观察模型大鼠的神经功能缺损情况。实验过程中无大鼠死亡。大鼠脑缺血再灌注后0 h和72 h,假手术组大鼠评分都是0分,说明没有神经功能缺损症状;而模型组造模0 h和72 h后评分分别为1.67±0.21和1.50±0.22分,说明模型组大鼠有轻度至中度局灶性神经功能缺。TTC染色结果显示, 假手术组大鼠脑部均为红色,为正常部位;而MCAO组大鼠左侧脑缺血部位则呈现苍白色,为脑部梗死区,见图1A。对2组大鼠的脑梗死体积占同侧全部脑组织体积的百分比进行统计分析,与假手术组相比,MCAO组脑梗死体积显著增大(P<0.01),占整个同侧大脑的(20.48±5.02)%,见图1B。以上结果表明造模成功。
2 ELISA测定脑组织IL-17A和IL-10含量的变化
为了研究急性脑缺血后脑组织中Th17/Treg的功能变化,我们对脑组中的Th17的分化和效应相关细胞因子IL-17A(由Th17细胞分泌)的含量及Treg的分化和效应相关细胞因子IL-10(由Treg细胞分泌)的含量进行了测定。根据ELISA检测结果,MCAO组大鼠缺血侧脑组织中IL-17A的浓度为(12.72±3.45) ng/L,假手术组大鼠脑组织的IL-17A的浓度为(6.56±1.21) ng/L;MCAO组大鼠缺血侧脑组织中IL-10的浓度为(27.22±6.41)ng/L,假手术组大鼠脑组织的IL-10的浓度为(86.11±19.25)ng/L。和假手术组相比,MCAO组大鼠缺血侧脑组织中IL-17A的含量升高,IL-10的含量降低(P<0.05),见图2。
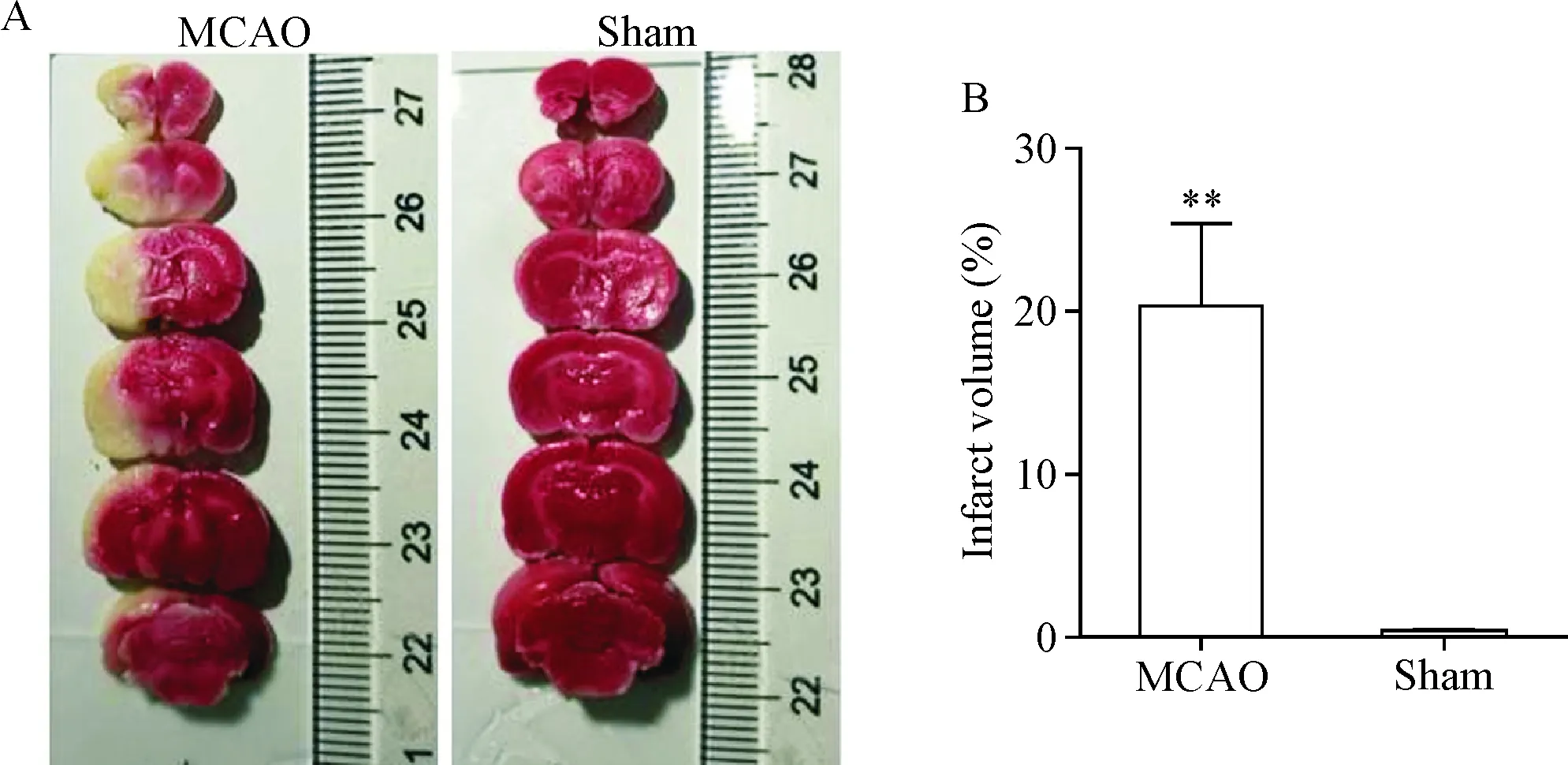
Figure 1.TTC staining was used to assess the cerebral infarct volume. A: TTC staining was performed on the brains of MCAO and sham-operated rats; B: the percentage of cerebral infarct volume in different treatment groups. Mean±SD.n=4.**P<0.01vssham group.
图1TTC染色评估脑梗死体积
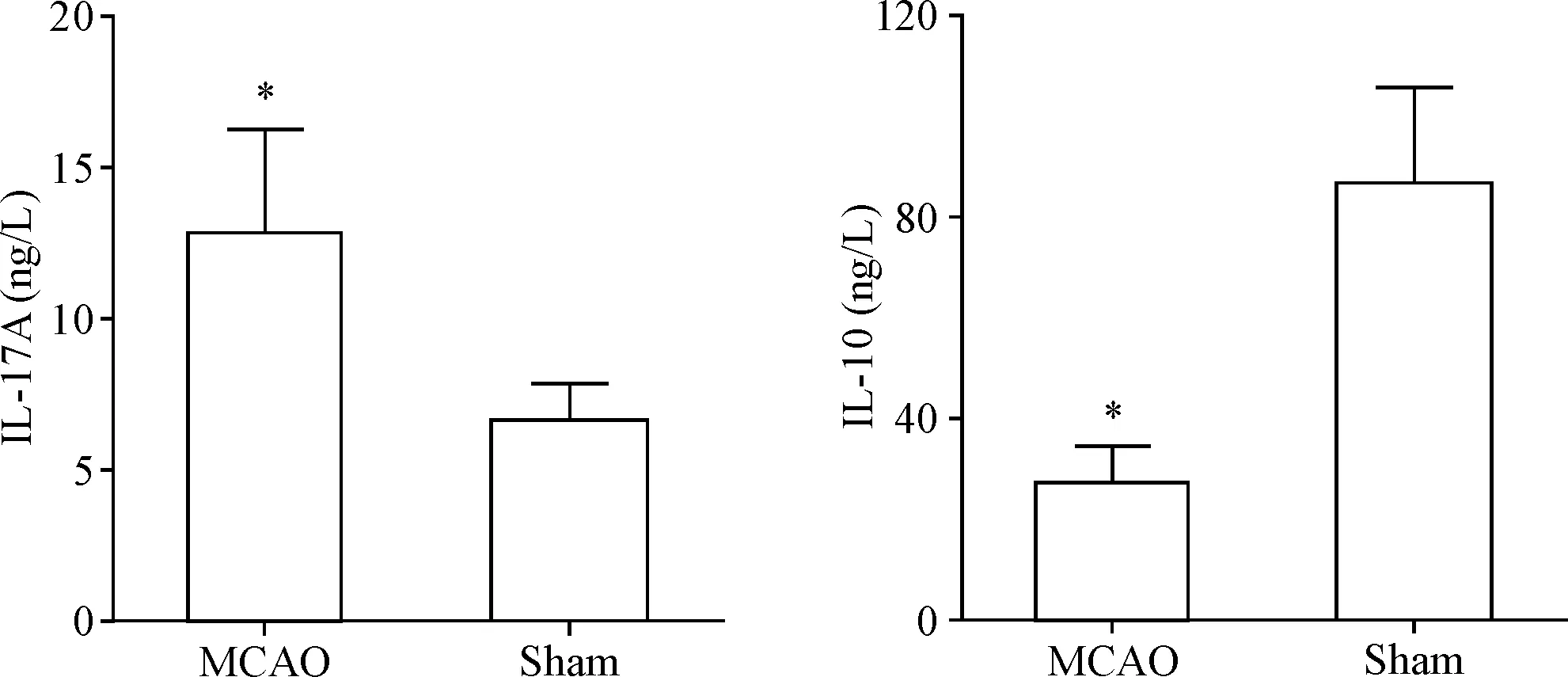
Figure 2.The levels of IL-17A and IL-10 in the brain tissues of rats were detected by ELISA. Mean±SD.n=4.*P<0.05vssham group.
图2ELISA检测脑组织中IL-17A和IL-10的含量
3 RT-qPCR检测脑组织中IL-17、IL-10及Foxp3和RORγt mRNA表达的变化
转录调节因子RORγt 在Th17 的分化中发挥重要作用,而Treg的分化与其特异性转录调节因子Foxp3有关。我们检测了2组大鼠脑组织中Foxp3、RORγt、IL-17和IL-10的mRNA表达水平。由结果可知,与假手术组相比,MCAO组大鼠脑组织中IL-17的mRNA表达明显升高(P<0.01),RORγt 的mRNA表达水平也明显升高(P<0.05);与假手术组相比,MCAO组大鼠脑组织中Foxp3和IL-10 mRNA的表达都显著降低(P<0.05),见图3。
4 流式细胞术分析脑组织Th17 (CD4+IL-17+) 和Treg(CD4+Foxp3+)的比例
为了进一步确认脑缺血模型中Th17/Treg的变化,我们又利用流式细胞术对模型组和假手术组大鼠脑组织的Th17及Treg进行了测定。结果显示, MCAO组的Th17 (CD4+IL-17+T) 占CD4+T细胞的比例为(51.44±10.30)%;而假手术组脑中Th17(CD4+IL-17+) 所占CD4+T细胞的比例仅为(18.42 ± 3.69)%(P<0.05)。而检测Treg(CD4+Foxp3+)占CD4+T细胞的比例,MCAO组为(5.11±0.90)%,假手术组为(29.92±6.31)%(P<0.05)。所以,MCAO组脑组织Th17/Treg比例为(24.44±5.68),假手术组为(0.76±0.17), 与假手术组相比, MCAO组脑组织Th17/Treg比例显著升高(P<0.05),见图4。
讨 论
脑卒中的病理生理机制已经成为全球卒中领域关注的焦点。而免疫炎症是缺血性脑卒中病理过程中的一个主要因素。本研究发现,在缺血性脑卒中大鼠模型中,Th17的分化和效应相关细胞因子IL-17A的含量显著增加;Treg的分化和效应相关细胞因子IL-10的含量显著减少。IL-17和转录因子RORγt的表达水平也比假手术组显著提高,IL-10和Foxp3的表达水平显著降低。流式结果显示模型组大鼠脑组织Th17增多;Treg明显减少。这些结果提示Th17/Treg的平衡可能在脑卒中的生理病理过程发挥了重要的作用,与临床研究的文献报道结果一致。
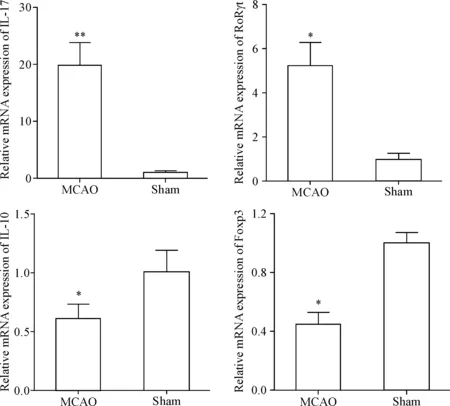
Figure 3.RT-qPCR was performed to determine the mRNA expression of Foxp3, RORγt, IL-17A and IL-10 in the rat brains. Mean±SD.n=4.*P<0.05,**P<0.01vssham group.
图3RT-qPCR检测大鼠脑组织中Foxp3、RORγt、IL-17和IL-10的mRNA表达
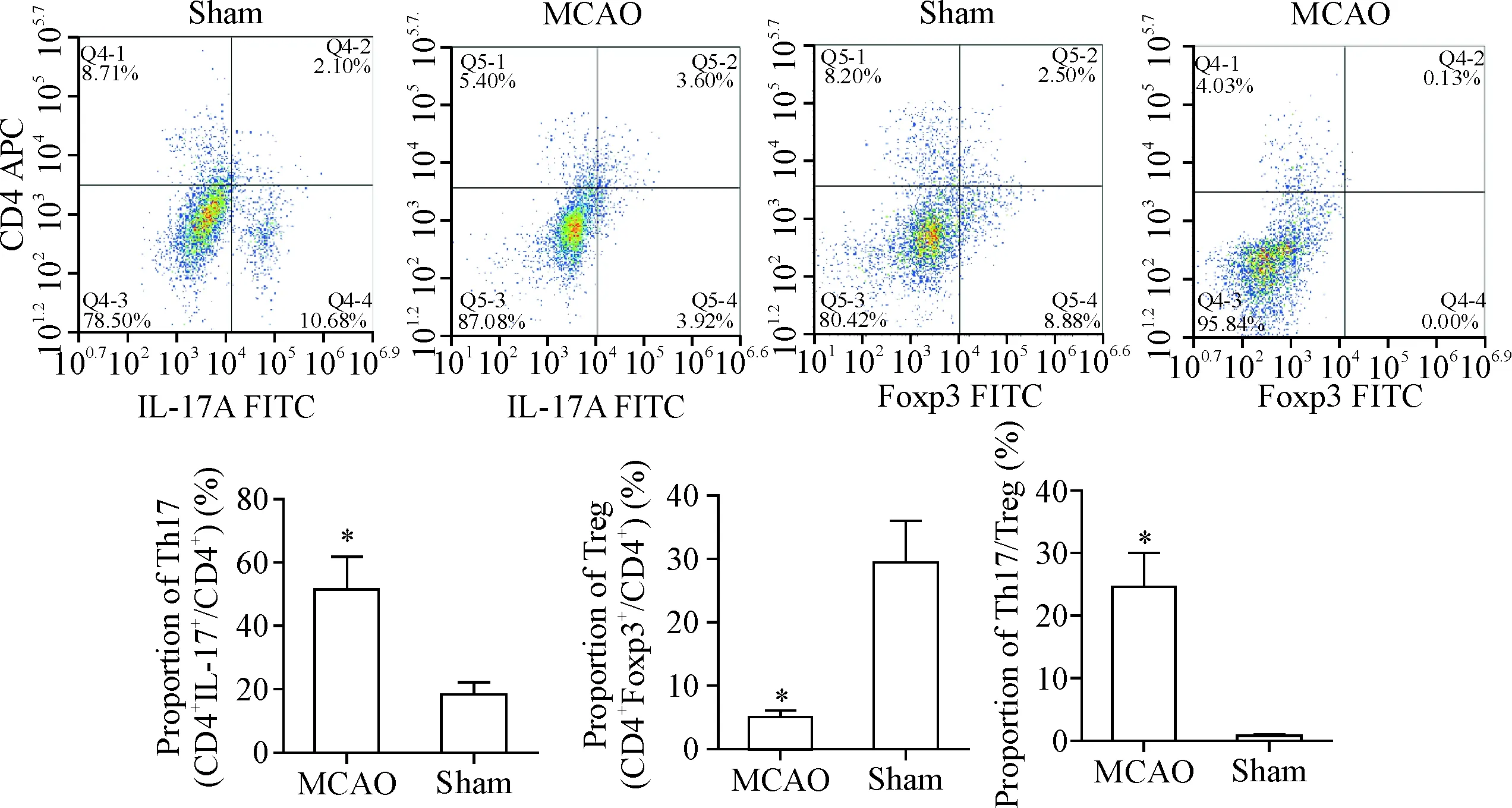
Figure 4.The ratio of Th17 (CD4+IL-17+) and Treg (CD4+Foxp3+) in the brain tissue was detected by flow cytometry. Mean±SD.n=4.*P<0.05vssham group.
图4流式细胞术检测脑组织Th17(CD4+IL-17+)和Treg(CD4+Foxp3+)的比例
Th17和Treg是2类不同于Th1和Th2的CD4+T淋巴细胞。Th17能够表达促炎细胞因子IL-17A、IL-17F和IL-22,主要存在于肠道黏膜等宿主屏障表面,抵抗入侵上皮细胞的微生物,起到保护宿主的作用[9]。维A酸相关孤独受体亚家族中RORα和RORγt是Th17形成的特异性转录因子。Treg细胞也主要存在于肠道黏膜中,对于可能损害宿主组织过度的效应T细胞应答起到抑制作用。Treg的典型特征是能够表达转录因子Foxp3。Treg对于维持宿主的自身免疫耐受性和体内平衡至关重要。Treg细胞数量的增加阻碍了对肿瘤的免疫反应,而Treg细胞的丧失则与自身免疫疾病有关[10]。Th17及Treg不仅在分化方向上有联系, 而且能互相转化,两者始终处于动态平衡, Th17/Treg的失衡促进了炎症和肿瘤等疾病的发展,目前Th17/Treg的平衡已经成为免疫炎症研究的一个靶点[5-7,11]。
多项针对缺血性脑卒中患者的临床研究都发现外周血液有Th17/Treg功能失衡的表现,包括分泌的细胞因子IL-17A 和IL-10水平的变化,以及转录因子RORγt和Foxp3的mRNA表达的变化。有报道显示缺血性脑卒中患者血浆中IL-17A水平和外周血单核细胞中RORγt mRNA的表达都显著增加,而外周血单核细胞中Foxp3 mRNA表达水平则显著降低[12-13]。针对急性脑梗塞患者的研究结果显示, 与短暂性脑缺血发作患者和健康对照相比,急性脑梗塞患者的外周血中细胞因子IL-17和IL-6的水平显著升高,转录因子RORγt mRNA表达也明显增加;而调节细胞因子IL-10和TGF-β1的水平及Foxp3 mRNA表达则下降[14]。在缺血/再灌注的脑梗死模型的动物实验发现,在脑梗死后1 d可以观察到IL-17 mRNA及其蛋白表达明显升高,且IL-17 mRNA的高峰在脑梗死后3 d出现,而蛋白的高水平则维持到第6天[15]。我们在缺血性脑卒中大鼠模型中也证明了细胞因子IL-17A的含量在脑部显著增加;IL-10的含量显著减少。转录因子RORγt的mRNA表达水平也比假手术组显著提高,Foxp3的mRNA表达水平显著降低。我们的结果也为Th17/Treg平衡参与脑卒中的病理生理过程提供了新的证据。
多项研究发现,缺血性脑卒中患者的外周血液有Th17/Treg细胞比例变化的表现。Li等[14]针对急性脑梗塞患者的研究结果显示, 与短暂性脑缺血发作患者和健康对照者相比,急性脑梗塞患者外周血的CD4+IL-17A+细胞(Th17)增加,CD4+CD25+Foxp3+细胞(Treg)减少。一项针对老年急性脑梗死患者的研究表明,在缺血性卒中患者中发现脑梗死后第1天及第5天外周血液中CD4+IL-17A+细胞 (Th17)明显高于正常对照组,而CD4+Foxp3+细胞(Treg)则明显低于对照组,提示Th17细胞与Treg细胞参与了缺血性卒中的病理生理过程[13]。本研究也发现缺血性卒中大鼠脑组织的Th17细胞比对照组显著增多;Treg细胞明显减少(P<0.05),表明Th17/Treg的平衡可能是脑卒中的发病机制之一。上述研究提示体内Th17/Treg的平衡有望成为缺血性卒中免疫治疗的一个新的靶点,但针对Th17/Treg的平衡开发的药物及干预措施来治疗缺血性卒中还需要更多的研究。
研究表明Th17分化的关键转录因子RORγt和促炎因子IL-17A 的表达水平可以通过缺氧诱导因子-1α、STAT1,STAT3和STAT5等转录因子进一步调节[16]。脑缺血状态下,活化的小神经胶质细胞/巨噬细胞中STAT3和 STAT1表达量急剧上升[17]。另外发现磷酸化JAK2和磷酸化STAT3蛋白在缺血再灌注损伤后表达明显增强,并参与促进神经细胞的死亡,表明JAK/STAT通路在脑卒中免疫炎症反应中发挥着重要作用[18]。结合本研究的结果,我们下一步计划针对脑缺血后JAK/STAT通路在调控Th17/Treg细胞平衡影响免疫炎症反应的机制方面开展深入的研究。
综上所述,本研究利用缺血性脑卒中大鼠模型,检测脑组织Th17/Treg变化,结果表明在缺血性脑卒中过程中免疫炎症反应被激活。这些结果为Th17/Treg的平衡参与脑卒中的生理病理过程提供了新的证据,并为脑卒中的免疫治疗提供了新的方向。
