短、中、长链氯化石蜡暴露对细胞代谢影响的比较研究
2019-04-17任晓倩张海军耿柠波王菲迪张保琴罗云陈吉平
任晓倩,张海军,耿柠波,王菲迪,张保琴,罗云,陈吉平,*
1. 中国科学院大连化学物理研究所,中国科学院分离分析化学重点实验室,大连 116023 2. 中国科学院大学,北京 100049 3. 浙江省农业科学院农产品质量标准研究所,省部共建国家重点实验室培育基地—浙江省植物有害生物防控重点实验室,杭州 310021
氯化石蜡(chlorinated paraffins, CPs)是一类人工合成的氯代正构烷烃,根据其碳链长度的不同,可分为短链(SCCPs, C10-13)、中链(MCCPs, C14-17)和长链(LCCPs, C18-30)氯化石蜡[1]。由于具有良好的化学稳定性,氯化石蜡被广泛用作塑料和橡胶的阻燃剂和增塑剂、皮革柔顺剂、纺织物整理剂和金属加工过程的切削液等,在生产和使用过程中不断向环境释放[2]。
在氯化石蜡产品中,SCCPs已被证实具有远距离环境迁移能力、环境持久性、生物累积性和较高毒性[3]。2017年5月,SCCPs被列入《关于持久性有机污染物的斯德哥尔摩公约》附录A的受控清单[4],单独的SCCPs产品生产被要求停止。联合国环境署的SCCPs风险管理评估报告中,推荐考虑MCCPs和LCCPs作为SCCPs的代替物,其可行性仍有待进一步评估[5]。中国是世界上最大的CPs生产国和使用国,生产企业高达150余家,产能超过100万t[6-7]。氯化石蜡普遍存在于环境介质和生物体中,并在人体内富集[8]。初步调查结果表明,SCCPs在中国人体血液和母乳中的含量分别为14~3 500 μg·L-1和5.24~644 μg·L-1;MCCPs在中国人体血液和母乳中的含量分别为6.3~320 μg·L-1和0.89~60 μg·L-1;LCCPs在中国人体血液中的含量为1.0~21 μg·L-1[9-10]。
已有的毒理学研究表明,SCCPs对啮齿类动物具有肝毒性[11]、肾毒性[12]和甲状腺毒性[13],长期暴露具有致癌性[14],并且具有内分泌干扰效应[11,15-17]。然而,关于MCCPs和LCCPs的毒性研究相对较少。由于MCCPs具有与SCCPs相似的结构特点,根据“化学品注册、评估、许可和限制”法规原则,二者均被欧盟列入内分泌干扰物候选清单[6]。研究单次饲喂MCCPs对Wistar大鼠的毒性效应时发现,MCCPs(C14-17, 51%~60% Cl)会导致大鼠产生竖毛、昏睡和尿失禁的行为现象[18]。研究发现,MCCPs(C14-17, 40% Cl)会引起大鼠和小鼠的肝细胞肿大、过氧化物酶体增殖以及肝细胞平滑内质网增殖[18]。此外,Bucher等[14]发现,LCCPs能够使小鼠产生肉芽肿性炎症效应。短、中和长链氯化石蜡可能具有显著的毒性效应差别,目前尚缺乏相应的比较研究。
代谢组位于基因组、转录组和蛋白质组下游,污染物在不同层面的毒性效应可以灵敏地反映在代谢组的变化上;同时,代谢组的变化能为毒性作用机制和生物表型状态之间的关系提供一个深入观察的视角[19]。本研究以人肝癌细胞HepG2为受试细胞,借助代谢组学研究方法,探讨了在同一剂量水平下短、中和长链氯化石蜡暴露对细胞小分子代谢物的干扰,从代谢组层面揭示三者毒性效应的异同。
1 材料与方法(Materials and methods)
1.1 试验材料
3种氯含量相近的氯化石蜡标准品,包括SCCPs(51.5% Cl)、MCCPs(52% Cl)和LCCPs(49% Cl)标准品购于德国Labor Dr. Ehrenstorfer-Schäfers公司,质量浓度均为100 mg·L-1,溶于环己烷。细胞培养基(DMEM)、胎牛血清(FBS)和胰蛋白酶(0.25% Trypsin-EDTA)购自美国Gibco公司,青霉素-链霉素、磷酸盐缓冲液(PBS)购于Hyclone公司(Logan, UT)。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、ACS级二甲基亚砜(DMSO)购自美国AMRESCO公司(Amresco, Solon, OH, USA),纯度>98%;质谱纯乙腈和甲醇购自德国Merck公司,色谱级甲酸购自日本TCI公司,色谱级碳酸氢铵购自中国百灵威公司。1-十二烷基溶血卵磷酯(LPC 12:0)和1-月桂酰-2-羟基-sn-甘油酸-3-卵磷脂1,2-二十七烷酰-sn-甘油酸-3-磷酸乙醇胺(PE 17:0)购自美国AVANTI公司,D5-L-苯丙氨酸和(D3-8,8,8)-L-辛酰基肉碱购自美国Sigma-Aldrich公司,十一烷酸(FFA C11:0)和十九烷酸(FFA C19:0)购自阿拉丁试剂公司。实验用水为Milli-Q超纯水(Millipore, Billerica, MA, USA)。
1.2 仪器设备
二氧化碳培养箱(BB16UV/BB5060UV,Heraeus,德国);全能台式高速冷冻离心机(Biofuge®Stratos,Heraeus,德国);超声细胞破碎仪(SCIENTZ JY 96-IIN,宁波新芝);超低温冰箱(NUAIRE NU-6382E,美国);倒置显微镜(XD-101型,南京江南光电股份有限公司);微板振荡器(LAB-LINE 4625-1,美国),冷冻干燥机(Genesis 25&35,美国);涡旋振荡仪(Scientific Industries G-560E,美国);酶标仪(Tecan Infinite F50,瑞士);液相色谱(Waters Acquity UPLC,美国)/串联四极杆线性离子阱质谱仪(AB SCIEX Q-Trap 5500,美国);液相色谱(Agilent 1290 UPLC,美国)/串联高分辨率飞行时间质谱仪(Agilent 6540,美国)。
1.3 试验方法
1.3.1 细胞培养与暴露
人肝癌细胞HepG2在37 ℃、5% CO2的条件下培养,培养基为含有10% FBS和1%青霉素-链霉素的DMEM完全培养基。将对数期生长的细胞接种在96孔板,用于细胞增殖活性测试,接种密度为4×104细胞/孔,待细胞铺满96孔板的80%后进行CPs暴露试验。将对数期生长的细胞接种在6孔板内,用于代谢干扰试验研究,接种密度为3×105细胞/孔,待细胞铺满6孔板的80%后进行暴露试验,暴露时间为24 h。3个氯化石蜡暴露组的暴露剂量均为100 μg·L-1,这一浓度与氯化石蜡在人体血液中的含量水平相当[9]。氯化石蜡分别溶解在DMSO中引入细胞培养液,DMSO在培养液中的终浓度为0.05%(V/V),空白对照组仅包含0.05%的DMSO。对照组和3个暴露组均设置6个平行。
1.3.2 细胞活力检测
细胞活力采用MTT法检测。暴露试验结束后,每孔加入20 μL MTT液(5 mg·mL-1,溶于PBS缓冲溶液),继续在37 ℃、5% CO2培养箱中培养4 h。然后吸出孔内培养液,每孔加入150 μL DMSO,溶解活细胞与MTT结合形成的紫色晶体。室温下,将96孔板置于微孔板振荡器上震荡10 min,使结晶物溶解,采用酶标仪在492 nm波长下检测各孔吸光度值。
1.3.3 小分子代谢物提取
采用细胞培养液分析代谢组的变化。细胞培养液中小分子代谢物与细胞内小分子代谢物具有平衡关系,因此,分析细胞培养液中代谢物的变化可反映细胞内的代谢变化。并且,细胞培养液中小分子代谢物的分析具有基质干扰小和灵敏度高的优点。细胞暴露24 h后,移取1 mL细胞培养液至离心管中,冷冻干燥。加入500 μL包含6个内标的提取液(80%甲醇/水,V/V),涡旋提取30 min,在13 000×g、8 ℃下,高速离心20 min,然后取上清液过0.22 μm有机滤膜,并转移到vail管中保存,待仪器分析。
1.3.4 小分子代谢物仪器分析
采用拟靶向代谢组学方法对胞外小分子代谢物进行分析,该方法具有较好的重现性与较宽的线性范围[20]。首先采用高分辨UPLC-Q-TOF MS的Auto MS/MS对分子量在50~1 000的代谢物进行全扫描和二级质谱扫描,以获得离子对信息。然后,采用高灵敏度的UPLC-Q-Trap MS对获得的离子对进行Schedule MRM分析,离子化方式为电喷雾电离(ESI),扫描模式为正负离子分别扫描。
正离子模式采用的色谱柱为Acquity UPLC BEH C8柱(2.1 mm×100 mm,1.7 μm,Waters,美国),柱温50 ℃,进样量10 μL,流速350 μL·min-1;流动相A为0.1%的甲酸水溶液(V/V),B为0.1%的甲酸乙腈(V/V)。流动相梯度为:初始流动相为10% B;3 min时上升到40% B;15 min时再上升到100% B,并保持5 min;20.1 min时回到10% B,平衡2.9 min。负离子模式采用的色谱柱为Acquity UPLC HSS T3柱(2.1 mm×100 mm,1.8 μm,Waters,美国),柱温50 ℃,进样量10 μL,流速350 μL·min-1;流动相A为5 mmol·L-1碳酸氢铵的水溶液,B为5 mmol·L-1碳酸氢铵的甲醇溶液。流动相梯度为:初始流动相为2% B,保持1 min;3 min时上升到42% B;12 min时再上升到100% B,并保持4 min;16.1 min时回到2% B,平衡3.9 min。
1.4 数据处理及统计分析
Q-TOF采集的数据用Agilent MassHunter Qualitative Analysis B.04.00软件进行处理。Q-Trap得到的数据用AB SCIEX的MultiQuant 3.0.1软件进行峰识别和匹配,去掉缺失值后,导出ESI+和ESI-模式下经内标校正过的峰面积数据,合并为一个数据表进行归一化处理,以校正培养液质量造成的差异。利用SIMCA-P 11.0软件(Umetrics, Sweden)对数据进行主成分分析(PCA)和偏最小二乘判别分析(PLS-DA),用以观察实验的稳定性和样品分型;使用SPSS PASW软件进行单因素方差分析(ANOVA)和t-test,用以判断代谢物在对照组和暴露组之间是否存在显著性差异。联合变量重要性因子值(variable importance in the projection, VIP)>1,且P<0.05被认为是显著差异代谢物。基于KEGG数据库,采用IncroMap软件(version 1.7.0)对差异代谢物进行通路富集分析。
1.5 质量控制与质量保证(QA/QC)
为确保代谢分析方法的稳定性与重现性,所有样本的混合样用作质量控制(QC)样品插入分析序列。首先分析2次QC样品,接着每隔6个待测样品后插入一个QC样品,共分析7次QC样品。正离子模式下共检测到313个色谱峰,其中61.0%色谱峰丰度的相对标准偏差(RSD)<10%,93.6%色谱峰丰度的RSD<20%。负离子模式下共检测到157个色谱峰,67.5%色谱峰丰度的RSD<10%,92.4%色谱峰丰度的RSD<20%。此外,PCA结果表明,所有QC样品的因子得分在第一主成分方向均落在2倍标准偏差的置信区间内。这些结果表明,代谢物拟靶向分析序列具有较好的稳定性和重现性,所得数据稳定可靠,满足定量分析的要求。
2 结果与讨论(Results and discussion)
2.1 CPs暴露对HepG2细胞增殖活性的影响
如图1所示,与对照组相比,短、中和长链氯化石蜡均显著降低了HepG2细胞的增殖活性,细胞平均活力分别降低了11.7%、8.8%和10.6%;但3个氯化石蜡暴露组的细胞活力没有显著差异。这一结果表明,氯含量相当的SCCPs、MCCPs和LCCPs诱导的细胞毒性相近。
2.2 多变量模式识别分析与差异代谢物鉴定
拟靶向分析共检测到470种代谢物,采用PLS-DA对短、中和长链氯化石蜡暴露组和对照组的代谢物丰度数据进行统计分析。结果表明,表示模型解释能力的参数R2=0.89,表示模型预测能力的参数Q2=0.74,证明PLS-DA结果可靠,不存在过度拟合现象。由PLS-DA得分图(图2(a))可见,在第一主成分方向上,3个氯化石蜡暴露组均能与对照组明显分开,表明氯化石蜡引起了细胞代谢活动的紊乱。其中,SCCPs与LCCPs在2个主成分方向都能明显分开,表明二者对细胞代谢的影响存在显著差别;而MCCPs与SCCPs和LCCPs在2个主成分方向均不能明显分开,表明MCCPs对细胞代谢的干扰效应与二者皆有相似之处。通过计算代谢扰乱水平指数(MELI),比较了不同碳链长度氯化石蜡暴露对细胞总体代谢的干扰强度。如图2(b)所示,3个氯化石蜡暴露组的MELI值与对照组相比都明显升高,但3个暴露组的MELI值没有显著差异。SCCPs的平均MELI值略高于MCCPs和LCCPs的平均MELI值,表明SCCPs对细胞总代谢的干扰程度略高。
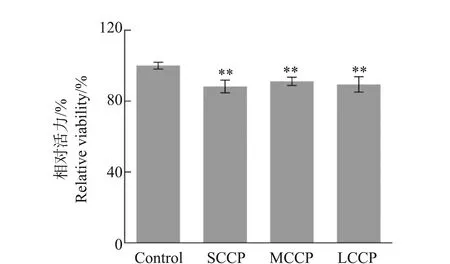
图1 短、中和长链氯化石蜡暴露对HepG2细胞增殖活性的影响注:Control表示对照组;SCCPs、MCCPs和LCCPs表示短、中和长链氯化石蜡,暴露浓度为100 μg·L-1,暴露时长为24 h;**表示与对照组相比显著性差别在0.01水平。Fig. 1 Effects of exposure to short-chain chlorinated paraffins (SCCPs), medium-chain chlorinated paraffins (MCCPs) and long-chain chlorinated paraffins (LCCPs) on the viability of HepG2 cellsNote: Exposure concentrations is 100 μg·L-1; exposure duration is 24 h; ** indicate the significant differences at 0.01 level in comparison to the control.
首先,利用Q-TOF高分辨率的优点,根据精确分子量及同位素分布在Agilent代谢物质谱数据库(Metlin)中对检测到的470种代谢物进行初步定性,结合化合物二级质谱图信息在数据库中对比确定代谢物化学结构。进一步通过搜索网络数据库Human Metabolome Database、KEGG和Metlin对定性结果进行验证[21]。经过上述步骤后,共定性鉴定出195种代谢物。通过ANOVA分析,共找出94种差异且定性的代谢物(P<0.05,FDR<0.05且VIP>1)。
差异代谢物包括:12种氨基酸(AAs)、10种脂肪酸(FFAs)、8种肉碱、14种磷脂酰胆碱(PCs)、10种溶血磷脂酰胆碱(LysoPCs)、1种磷脂酰乙醇胺(PE)、2种溶血磷脂酰乙醇胺(LysoPEs)、8种鞘磷脂(SMs)、1种溶血鞘磷脂(LysoSM)、6种三羧酸循环相关代谢物、3种嘌呤、2种嘧啶和17种其他代谢物。与对照组相比,PCs、LysoPCs、SMs、鸟氨酸、苏氨酸和谷氨酸在3个暴露组中均呈现显著下降趋势。FFAs、LysoPEs、肉碱、三羧酸循环相关代谢物和大部分AAs在3个暴露组中均呈现上升趋势。
2.3 代谢通路富集分析
采用IncroMap软件对94种差异代谢物进行通路富集分析。基于KEGG通路数据库找出受显著影响的代谢通路,从中选出P<0.05并且与肝代谢有关的通路。通路富集分析得到的Q值可反映代谢通路的受影响程度,根据Q值对这些通路进行了分类,结果如图3所示。3个暴露组中,共有14条代谢通路受到显著影响,3组之间既有相似性又有差异性。短、中和长链氯化石蜡对5条脂类代谢通路扰乱最为剧烈,且三者影响程度相近,包括甘油磷脂代谢、亚油酸代谢、α-亚麻酸代谢、花生四烯酸代谢和鞘磷脂代谢。3个暴露组均影响了3条氨基酸代谢通路,分别是甘氨酸、丝氨酸和苏氨酸代谢,缬氨酸、亮氨酸和异亮氨酸生物合成,牛磺酸和亚牛磺酸代谢;除此之外,LCCPs还扰乱了苯丙氨酸、酪氨酸和色氨酸生物合成通路。相比于SCCPs和MCCPs,LCCPs对氨基酸代谢表现出了更强的干扰效应。
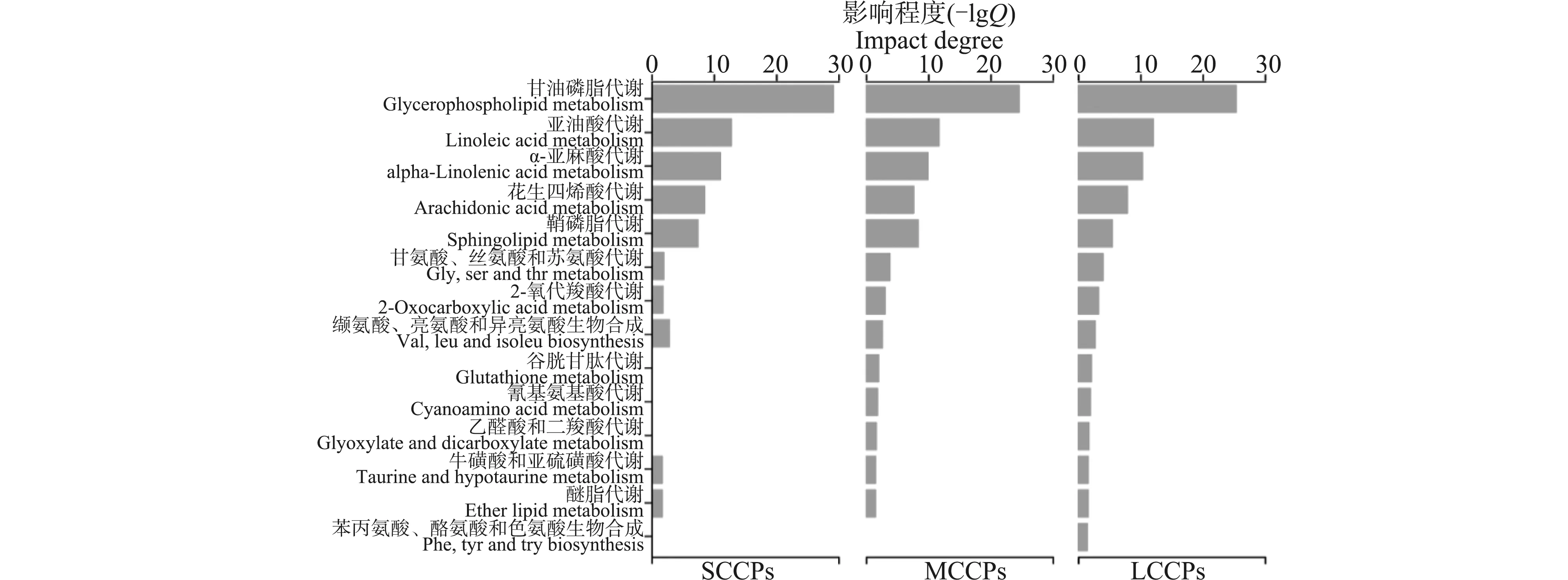
图3 基于代谢通路富集分析获得的短、中和长链氯化石蜡暴露显著干扰的代谢通路Fig. 3 The most relevant metabolic pathways perturbed by SCCPs, MCCPs and LCCPs exposure based on pathway enrichment analysis
2.4 对磷脂代谢的影响
磷脂不仅是细胞膜和各种细胞器(线粒体、内质网和细胞核等)膜的重要组成成分,还参与调节生物体内的许多重要功能,如神经传导、降血脂和降低胆固醇等[22]。由代谢通路富集分析结果可知,氯化石蜡暴露对磷脂代谢的影响最为显著。如图4所示,在甘油磷脂代谢通路中,3种氯化石蜡均引起了细胞内膜主要组成成分PCs及其水解产物LysoPCs的同步下调,LysoPCs的代谢物甘油磷脂胆碱(GP-C)和胆碱的含量也表现出显著下调趋势,表明PCs和LPCs的代谢降解被加强。此外,细胞外膜的主要组成成分SMs及其水解产物LysoSM的水平在3个氯化石蜡暴露组中均呈现显著降低趋势,表明SMs和LysoSMs的代谢降解也被加强。与对照组相比,PEs水平在SCCPs暴露组中显著降低,而在MCCPs和LCCPs暴露组中则没有明显变化;LysoPEs在SCCPs暴露组中无明显变化,在MCCPs和LCCPs暴露组中则显著升高。此结果表明,3种氯化石蜡暴露均引起了PEs水解生成LysoPEs的反应增强,并且MCCPs和LCCPs暴露可能抑制了PEs向PCs的转化。溶血磷脂含量的升高会导致细胞膜流动性增强,从而影响膜脂蛋白的有序性,破坏细胞膜结构,进而导致细胞死亡[23]。在本研究中,氯化石蜡暴露导致LysoPCs和LysoPEs含量的升高,可能是导致细胞增殖活性降低的原因之一。此外,笔者前期的研究也观察到SCCPs暴露显著提高了磷脂酶A2(PLA2)的活性,该酶用于调节磷脂转化为溶血磷脂,可引起HepG2细胞内磷脂代谢的加强[24]。
2.5 对脂肪酸代谢的影响
脂肪酸是细胞膜的重要组成成分,同时也是机体最大的储能物质。脂肪酸不能自由通过线粒体内膜和过氧化物酶体膜,需要肉碱作为载体[25]。脂肪酸首先在脂酰辅酶A合成酶的作用下生成脂酰辅酶A,脂酰辅酶A与游离肉碱在脂酰肉碱转移酶Ι的催化下生成脂酰肉碱,脂酰肉碱进入线粒体和过氧化物酶体后在脂酰肉碱转移酶Ⅱ的作用下,重新释放游离肉碱与脂酰辅酶A,从而进行后续的脂肪酸氧化反应。如图5所示,在本研究中,短、中和长链氯化石蜡暴露导致细胞培养液中总脂肪酸(∑FFAs)、长链脂肪酸(LC-FAs)、极长链脂肪酸(VLC-FAs)、饱和脂肪酸(SFAs)和不饱和脂肪酸(USFAs)的含量均显著升高,并且3个暴露组之间的脂肪酸水平没有显著差异。此结果说明,3种氯化石蜡对脂肪酸代谢具有相似的干扰效应。此外,研究还发现,3种氯化石蜡均显著降低了细胞培养液中游离肉碱的含量,提高了短、中和长链脂酰肉碱的含量(SC-ACs、MC-ACs和LC-ACs)。这些结果说明,氯化石蜡暴露抑制了细胞的脂肪酸代谢[26-27]。这可能是因为氯化石蜡暴露增强了脂酰肉碱转移酶Ι的活性,但是抑制了脂酰肉碱转移酶Ⅱ的活性,从而导致细胞游离肉碱含量降低,脂酰肉碱含量升高,总体上抑制了脂肪酸β氧化。
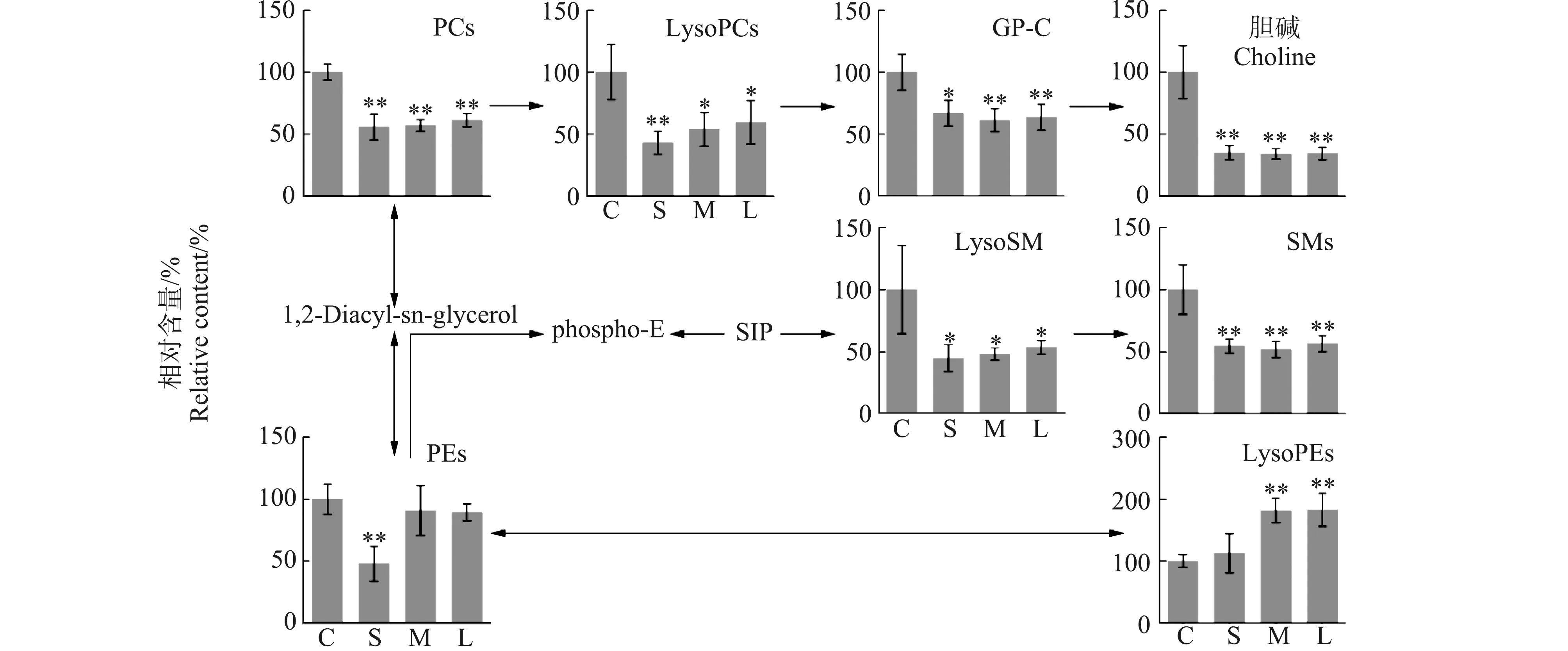
图4 短、中和长链氯化石蜡暴露对HepG2细胞磷脂代谢的影响注:C为对照组,S为SCCPs暴露组,M为MCCPs暴露组,L为LCCPs暴露组;PCs表示磷脂酰胆碱,LysoPCs表示溶血磷脂酰胆碱,GP-C表示甘油磷脂胆碱,PEs表示磷脂酰乙醇胺,SIP表示1-磷酸鞘氨醇,LysoSM表示溶血鞘磷脂,SMs表示鞘磷脂,LysoPEs表示溶血磷脂酰乙醇胺;*和**分别表示与对照组相比显著性差别在0.05和0.01水平。Fig. 4 Effects of exposure to SCCPs, MCCPs and LCCPs on phospholipid metabolism of HepG2 cellsNote: C. Control group; S. SCCP exposure group; M. MCCP exposure group; L. LCCP exposure group; PCs stands for phosphatidyl cholines; LysoPCs stands for lysophosphatidyl cholines; GP-C stands for glycerol-3-phosphocholine; PEs stands for phosphatidyl ethanolamines; SIP stands for sphingosine 1-phosphate; LysoSM stands for lysosphingomyelins; SMs stands for sphingomyelins; LysoPEs stands for lysophosphatidyl ethanolamines; * and ** indicate the significant differences at 0.05 and 0.01 levels in comparison to the control.
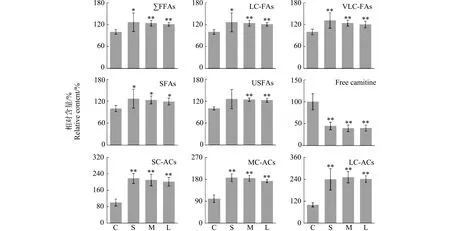
图5 短、中和长链氯化石蜡暴露对HepG2细胞脂肪酸代谢的影响注:C为对照组,S为SCCPs暴露组,M为MCCPs暴露组,L为LCCPs暴露组;∑FFAs表示总脂肪酸,LC-FAs表示长链脂肪酸,VLC-FAs表示极长链脂肪酸,SFAs表示饱和脂肪酸,USFAs表示不饱和脂肪酸,Free camitine表示游离肉碱,SC-ACs表示短链脂酰肉碱,MC-ACs表示中链脂酰肉碱;LC-ACs表示长链脂酰肉碱;*和**分别表示与对照组相比显著性差别在0.05和0.01水平。Fig. 5 Effects of exposure to SCCPs, MCCPs and LCCPs on fatty acid metabolism of HepG2 cellsNote: C. Control group; S. SCCP exposure group; M. MCCP exposure group; L. LCCP exposure group; ∑FFAs stands for total fatty acids; LC-FAs stands for long-chain fatty acids; VLC-FAs stands for very long-chain fatty acids; SFAs stands for saturated fatty acids; USFAs stands for unsaturated fatty acids; SC-ACs stands for short-chain acyl-carnitines; MC-ACs stands for medium-chain acyl-carnitines; LC-ACs stands for long-chain acyl-carnitines; * and ** indicate the significant differences at 0.05 and 0.01 levels in comparison to the control.
2.6 对氨基酸代谢的影响
氨基酸是蛋白质的基本组成单元,在生物体内发挥重要作用。在本研究中,代谢通路富集分析揭示了3种氯化石蜡暴露对HepG2细胞氨基酸代谢的显著影响。图6显示了12种差异氨基酸在胞外培养液中水平的变化情况。暴露24 h后,胞外培养液中总氨基酸含量显著升高,并且短、中和长链氯化石蜡暴露组中每一种差异氨基酸的含量变化趋势一致。精氨酸、甘氨酸、亮氨酸、异亮氨酸、酪氨酸、苯丙氨酸、色氨酸和苏氨酸为培养液中添加的营养物质,其中只有苏氨酸的含量是显著降低的,其余均显著升高。此结果表明,3种氯化石蜡暴露均抑制了细胞的氨基酸跨膜运输。LCCPs具有更强亲脂性,可能更易与细胞膜的磷脂双分子层结合,破坏细胞膜的流动性[28],因而对氨基酸的跨膜运输产生更强的抑制效应,并因此更强烈地干扰了氨基酸代谢(图3)。细胞培养液中没有添加谷氨酸、鸟氨酸和瓜氨酸,检测出的谷氨酸、鸟氨酸和瓜氨酸为细胞合成物质。如图6所示,3种氯化石蜡暴露均引起了谷氨酸和鸟氨酸含量的显著降低,瓜氨酸含量的变化不明显,表明细胞内的氨基酸合成代谢可能受到了抑制。
与人体内暴露水平接近(100 μg·L-1)的短、中和长链氯化石蜡暴露显著降低了HepG2细胞的增殖活性,并且显著干扰了细胞代谢。短、中和长链氯化石蜡均显著影响了细胞的磷脂代谢、脂肪酸代谢和氨基酸代谢。主要受干扰的代谢通路包括:甘油磷脂代谢、亚油酸代谢、α-亚麻酸代谢、花生四烯酸代谢和鞘磷脂。短、中和长链氯化石蜡对磷脂代谢和脂肪酸代谢的扰乱程度相近,均加强了细胞磷脂代谢,抑制了脂肪酸的代谢。与SCCPs和MCCPs相比,LCCPs对氨基酸代谢产生了更强的干扰效应。以上结果不支持MCCPs和LCCPs作为SCCPs的代替物使用。
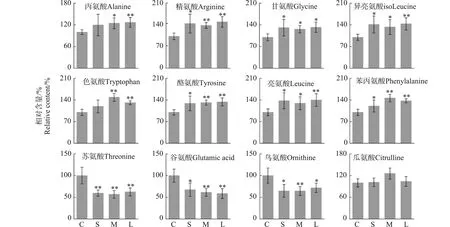
图6 短、中和长链氯化石蜡暴露对HepG2细胞氨基酸代谢的影响注:C为对照组,S为SCCPs暴露组,M为MCCPs暴露组,L为LCCPs暴露组;*和**分别表示与对照组相比显著性差别在0.05和0.01水平。Fig. 6 Effects of exposure to SCCPs, MCCPs and LCCPs on amino acid metabolism of HepG2 cellNote: C. Control group; S. SCCP exposure group; M. MCCP exposure group; L. LCCP exposure group; * and ** indicate the significant differences at 0.05 and 0.01 levels in comparison to the control.
