增塑剂DIDP对肝脏氧化应激损伤及VitE拮抗作用研究
2019-04-17李崇尧陈莹莹宋鹏雷璠武阳晏彪马萍
李崇尧,陈莹莹,宋鹏,雷璠,武阳,晏彪,马萍,*
1. 湖北科技学院药学院,咸宁 437100 2. 湖北科技学院基础医学院,环境-免疫与神经系统疾病实验室,咸宁 437100
邻苯二甲酸酯(phthalic acid esters, PAEs),也被称为酞酸酯,是一类结构类似的持久性有机污染物,具有特殊气味,且不溶于水,难挥发,凝固点低,易溶于有机溶剂,其主要作为增塑剂使用,增加塑料制品的柔韧性和拉伸性[1-2]。广泛的使用使其大量进入环境,已成为全球普遍存在的一种环境污染物。邻苯二甲酸酯有多种类型,以邻苯二甲酸二乙基己酯(di-2-ethylhexyl phthalate, DEHP)、邻苯二甲酸二丁酯(dibutyl phthalate, DBP)和邻苯二甲酸丁苄酯(benzylbutyl phthalate, BBP)最为常用,研究表明,DEHP、DBP和BBP有生殖发育毒性[3]。欧盟成员国已经严格限制这3种增塑剂在有关制品中的含量(欧盟2005/84/EC指令),颁布指令规定“DEHP、DBP和BBP含量超过0.1%的玩具及儿童护理用品,不得在欧盟市场出售”[2],并且这3种增塑剂也被欧洲化学品管理局(European Chemical Agency, ECHA)列入高度关注物质(substance of very high concern, SVHC)[4]。与此同时,一批高分子量、低毒性的新型增塑剂开始得到广泛的应用,邻苯二甲酸二异癸酯(diisodecyl phthalate, DIDP)就是其中的一种[5-6]。
DIDP可以通过多种途径进入人体[7],因其暴露途径较为简单,被污染的人群数目众多,在人体尿液中已检测出DIDP的一些代谢物[8],故其潜在的健康威胁已经受到众多学者的关注。动物实验研究表明,DIDP虽只具有低毒性,但较高剂量DIDP能使大鼠的存活率和体重下降,肝脏发生肿胀、重量增加,过氧化物酶体的增生受到促进[9]。Thomas等[10]研究发现,DIDP和DEHP一样,可以使过氧化物酶体发生大量增殖,造成肝脏肿大。
笔者课题组前期研究发现,DIDP的同系物邻苯二甲酸二异壬酯(diisononyl phthalate, DINP)可引起小鼠肝肾的氧化损伤,而抗氧化剂褪黑素有拮抗作用[11]。DINP也可造成小鼠肺细胞氧化损伤[12],维生素E(vitamin E, VitE)在小鼠肺组织氧化损伤中具有拮抗作用[13]。DIDP能否造成机体的肝组织损伤还有待研究,因而,以雄性BALB/c小鼠为受试动物,VitE为拮抗剂,测定肝组织匀浆中氧化应激水平的生物标志物,包括活性氧族(ROS)、还原型谷胱甘肽(GSH)和丙二醛(MDA)的含量以及细胞凋亡因子半胱氨酸天冬氨酸蛋白酶3(Caspase-3)的含量,检测血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和白蛋白(ALB)水平来评价肝功能,同时观察肝组织切片的病理变化和荧光染色结果,探究增塑剂DIDP是否通过氧化应激作用导致雄性小鼠肝脏损伤和细胞凋亡,以期为全面评估DIDP的毒性效应及分子机制提供参考。
1 材料与方法(Materials and methods)
1.1 实验动物
从湖北省实验动物研究中心购买6~8周龄雄性BALB/c小鼠70只(合格证号:No. 42000600025582),饲养在SPF级动物房中。饲养过程中,小鼠养于无菌无病原专用鼠笼内,每日定时定量给予商业用鼠粮,并及时补充饮用水。动物饲养室内温度控制在20~25 ℃,室内相对湿度为50%~70%,保持室内安静,避免强光照对小鼠的影响。
1.2 主要仪器与试剂
主要仪器:酶标仪(ELx800,美国Bio-Tek),多功能荧光酶标仪(Hide Chameleon V,芬兰Hidex),低温冷冻离心机(5424R,德国Eppendorf),三用电热温水箱(HH-42,北京长源),显微镜(DP73,日本Olympus),动物自动生化分析仪(iMagic-V7,深圳库贝尔生物)。
主要试剂:邻苯二甲酸二异癸酯(DIDP),纯度≥99.6%,购自Sigma;Hoechst 33258荧光染料,纯度>99.9%,购自Sigma;生育酚(ocopherol或vitamin E),纯度≥99%,购自Sigma;二氯二氢荧光素-乙酰乙酸酯(DCFH-DA),纯度>99.9%,购自Sigma;蛋白酶K购自Sigma;硫代巴比妥酸(TBA),购自国药集团;Folin-酚试剂盒购自北京鼎国昌盛;还原型谷胱甘肽(GSH)试剂盒购自南京建成;8-OHdG ELISA试剂盒购自济南朋远;ALT Assay Kit、AST Assay Kit和ALB Assay Kit均购自深圳库贝尔。
1.3 动物分组与染毒
70只雄性BALB/c小鼠,应用随机数字表分为7组。包括1个空白对照组,4个DIDP染毒组,1个VitE对照组,1个VitE+DIDP组,每组10只。根据欧洲食品安全局规定,成年人每天DIDP的最高摄入量为0.15 mg·kg-1[14]。故设置0.15、1.5、15和150 mg·kg-1为染毒梯度,以生理盐水稀释成0.015、0.15、1.5和15 mg·mL-14种浓度的使用液,以生理盐水为阴性对照组;VitE组的剂量为100 mg·kg-1,稀释液现用现配。对于VitE+DIDP处理组,给予小鼠150 mg·kg-1DIDP 3 h后,再给药100 mg·kg-1VitE。每组给药方式均为灌胃,其剂量为每天10 mL·kg-1,连续染毒14 d。根据Ma等[15]的研究,给予DIDP 3 h后,再用维生素拮抗,目的是为了改善和修复DIDP诱导的氧化损伤。
1.4 血清和肝组织匀浆的制备
染毒结束后,根据小鼠体重按比例腹腔注射1%戊巴比妥钠,等到小鼠麻醉后,用酒精棉球擦拭,并用手术剪剪开小鼠胸腔处的皮肤,暴露出心脏所在位置的肌肉,然后用1 mL医用注射器斜插入其心脏,缓慢抽取0.8~1 mL左右的血液,注射入离心管(1.5 mL)中,在室温条件下静置30 min后,在25 ℃下以3 000 r·min-1离心10 min,取上清分装置于-80 ℃冰箱。
对小鼠进行颈椎脱臼后,取出完整的肝组织,在冷的磷酸缓冲液(PBS)(pH 7.5)中洗净,用吸水纸吸干水分,然后放至玻璃匀浆器中,加入冷的PBS制成10%的组织匀浆,然后在4 ℃下以10 000 r·min-1离心10 min,取上清分装置于-80 ℃冰箱。
1.5 肝组织切片的制备
取完血清后,用颈椎脱臼法处死小鼠,然后立即取出肝组织用PBS冲洗表面的血液,并加入4%的多聚甲醛将其固定,进行H&E染色。
1.6 肝组织荧光染色
称取Hoechst 33258试剂1 mg,用20 mL蒸馏水溶解后,滤过,4 ℃避光保存。使用时,用10倍的蒸馏水稀释成染色液,工作浓度为5 mg·L-1。常规包埋切片后,脱蜡,透明;用PBS或0.9%生理盐水洗2遍,每次3 min,吸尽液体,手动晃动数次;加入0.5 mL Hoechst 33258染色液,染色5 min;用PBS或0.9%生理盐水洗2遍,每次3 min;将切片置于载玻片上,滴一滴抗淬灭封片液,盖上一洁净的盖玻片,尽量避免产生气泡,然后用Olympus荧光显微镜观察。
1.7 ROS含量的测定
用PBS将肝组织匀浆稀释100倍,并将荧光染料DCFA-DA按1∶1 000稀释。然后再加入100 μL的稀释匀浆液与100 μL的稀释荧光染料DCFA-DA于酶标板中,轻微摇匀,37 ℃避光5 min,用荧光酶标仪检测激发波长485 nm和528 nm处的荧光强度。
1.8 GSH含量和蛋白质含量的测定
严格按照GSH试剂盒说明书来测定其含量,按照Folin-酚法来测定蛋白含量。其含量计算方法为:GSH含量(μmol·g prot-1)=[(测定OD值-空白OD值)/(标准OD值-空白OD值)]×标准管浓度×样本稀释倍数÷待测匀浆蛋白浓度。
1.9 MDA含量测定
取0.5 mL肝组织匀浆,再加入2 mL 0.6% TBA溶液,放入水浴锅中沸水浴15 min后,用冷水冷却后,10 000 r·min-1离心10 min,取上清液200 μL于酶标板中测其在450、532和600 nm的吸光值(A450、A532和A600)。MDA含量(cMDA,μmol·mg-1,以prot计)计算公式为cMDA=6.45(A532-A600)-0.56A450。
1.10 Caspase-3含量的测定
严格按照试剂盒操作说明进行测定,标准曲线按照说明书来绘制,并以此为依据来确定样品中Caspase-3的含量。
1.11 肝功能指标的测定
取小鼠血清200 μL于样杯中,加入双蒸水600 μL作3倍稀释,用于ALT、AST和ALB的检测来评价肝功能。
1.12 统计分析
采用SPSS 12.0统计分析软件进行统计分析,多组间均数比较使用单因素方差分析法(ANOVA),然后使用最小显著性差异法(LSD)检测两组间均数的差异性,P<0.05、P<0.01表示差异有统计学意义。
2 结果(Results)
2.1 小鼠肝组织形态的光镜观察结果
如图1所示,对照组肝组织结构正常。0.15 mg·kg-1DIDP组肝细胞轻度水肿,肝索清晰,肝索肝窦比例尚可。1.5 mg·kg-1DIDP组肝细胞有中度水肿,肝索可见增宽,索窦受压。15 mg·kg-1DIDP组肝细胞有重度水肿,肝索很乱,肝索肝窦比例失常,肝细胞坏死。150 mg·kg-1DIDP组中央静脉扩张、淤血;肝细胞水肿,胞浆疏松化,体积增大;肝索结构尚清晰,肝窦变窄。与空白对照组相比,VitE对照组肝组织结构和细胞形态正常,而150 mg·kg-1DIDP+100 mg·kg-1VitE组肝索增宽,索窦受压变窄,肝细胞水肿轻于150 mg·kg-1DIDP组。结果表明,小鼠肝细胞的病理损伤随着DIDP剂量逐渐增高而不断加重。给予VitE后,肝细胞损伤得到减轻。
2.2 小鼠血清ALT与AST含量的变化
ALT与AST均是肝细胞损伤的敏感性指标。如图2所示,随着DIDP染毒剂量的升高,血清中ALT与AST含量也逐渐上升。与生理盐水组相比,高剂量组(150 mg·kg-1)血清ALT含量显著升高(P<0.05)。与150 mg·kg-1DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的血清ALT含量显著减少。与生理盐水组比较,中高剂量组(15 mg·kg-1)与高剂量组(150 mg·kg-1)血清AST含量显著升高(P<0.05)。与150 mg·kg-1DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的血清AST含量显著减少(P<0.05)。
2.3 小鼠血清ALB含量的变化
ALB反映肝脏慢性损害情况。如图3所示,随着DIDP染毒剂量的升高,血清ALB含量逐渐下降。与生理盐水组比较,高剂量组(150 mg·kg-1DIDP)血清ALB含量显著减少(P<0.01)。与150 mg·kg-1DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的血清ALB含量显著升高(P<0.05)。
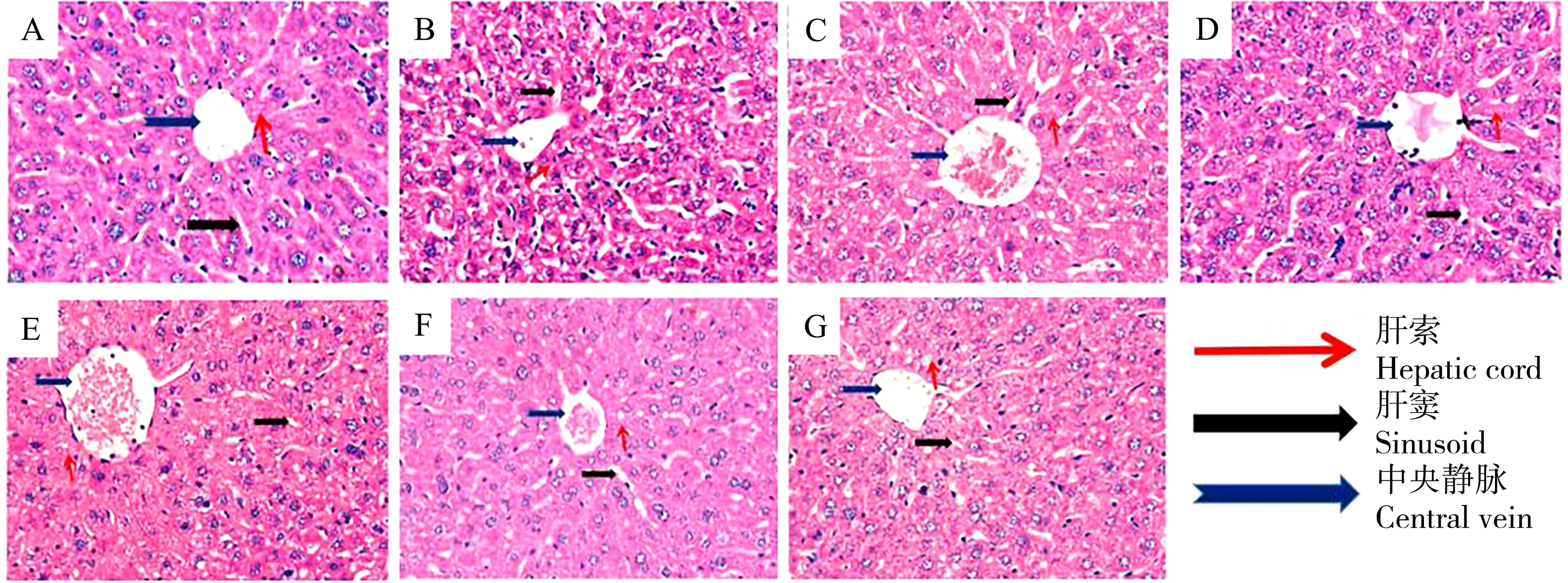
图1 不同处理组小鼠肝切片图(10×40,H&E染色)注:A. 生理盐水组;B. 0.15 mg·kg-1 DIDP组;C. 1.5 mg·kg-1 DIDP组;D. 15 mg·kg-1 DIDP组;E. 150 mg·kg-1 DIDP组;F. 100 mg·kg-1 VitE组;G. 150 mg·kg-1 DIDP+100 mg·kg-1 VitE组;DIDP为邻苯二甲酸二异壬酯,VitE为维生素E。Fig. 1 Liver slices of different groups (10×40, H&E stains)Note: A. Saline group; B. 0.15 mg·kg-1 DIDP group; C. 1.5 mg·kg-1 DIDP group; D. 15 mg·kg-1 DIDP group; E. 150 mg·kg-1 DIDP group; F. 100 mg·kg-1 VitE group; G. 150 mg·kg-1 DIDP+100 mg·kg-1 VitE group; DIDP is didecyl phthalate and VitE is vitamin E.
2.4 小鼠肝组织ROS含量的变化
各组小鼠肝组织的ROS测定结果如图4所示。与生理盐水组比较,0.15、1.5和15 mg·kg-1DIDP组均无统计学意义,150 mg·kg-1DIDP组有统计学意义(P<0.01)。高剂量的DIDP能造成ROS含量的上升。与150 mg·kg-1DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的ROS含量显著下降。
2.5 小鼠肝组织GSH含量的变化
各组小鼠肝组织的GSH含量测定结果如图5所示。与生理盐水组比较,中低剂量组(0.15、1.5和15 mg·kg-1)无统计学差异,高剂量组(150 mg·kg-1)有统计学差异(P<0.01)。高剂量的DIDP可使小鼠肝GSH含量下降。与单独DIDP组(150 mg·kg-1)比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组中的GSH含量显著上升。
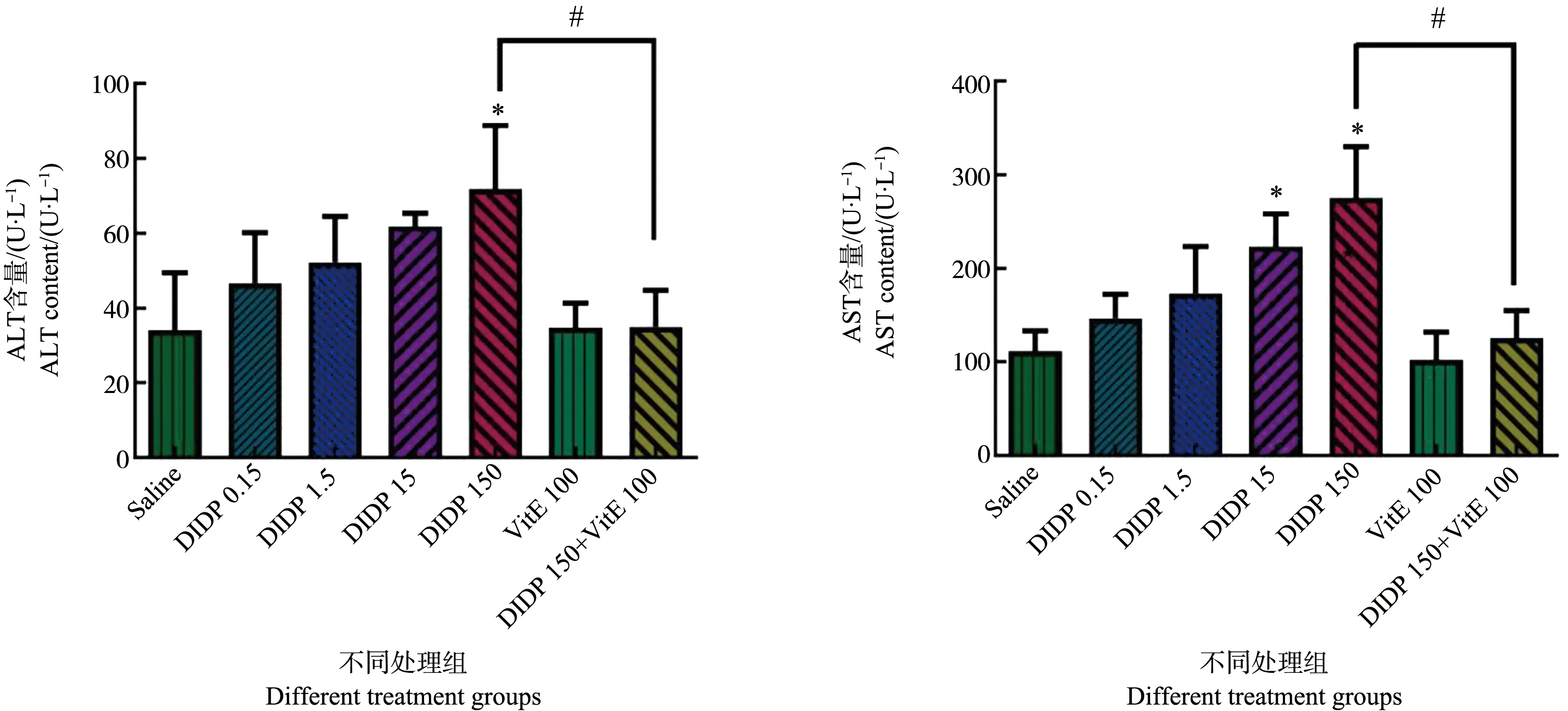
图2 不同处理组小鼠血清丙氨酸氨基转移酶(ALT)与天门冬氨酸氨基转移酶(AST)含量(n=6)注:* P<0.05,与生理盐水组比较;# P<0.05,与150 mg·kg-1 DIDP+100 mg·kg-1 VitE组比较。Fig. 2 Alanine aminotransferase (ALT) and aspartate aminotransferase (AST) content in mouse serum of different groups (n=6)Note: * P<0.05, compared with the saline group; # P<0.05, compared with the 150 mg·kg-1 DIDP+100 mg·kg-1 VitE group.
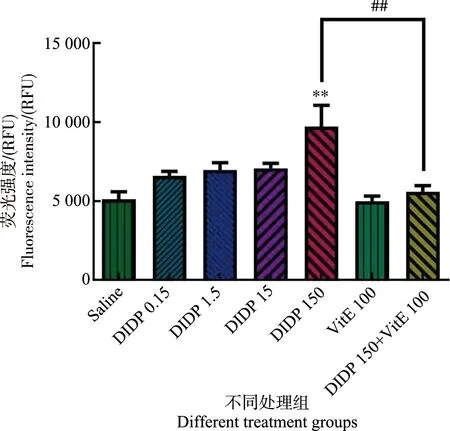
图4 不同处理组小鼠肝活性氧(ROS)含量(n=6)注:** P<0.01,与生理盐水组相比较;## P<0.01,与150 mg·kg-1 DIDP+100 mg·kg-1 VitE组比较。Fig. 4 Reactive oxygen species (ROS) content in mouse liver of different groups (n=6)Note: ** P<0.01, compared with the saline group; ## P<0.01, compared with the 150 mg·kg-1 DIDP+100 mg·kg-1 VitE group.
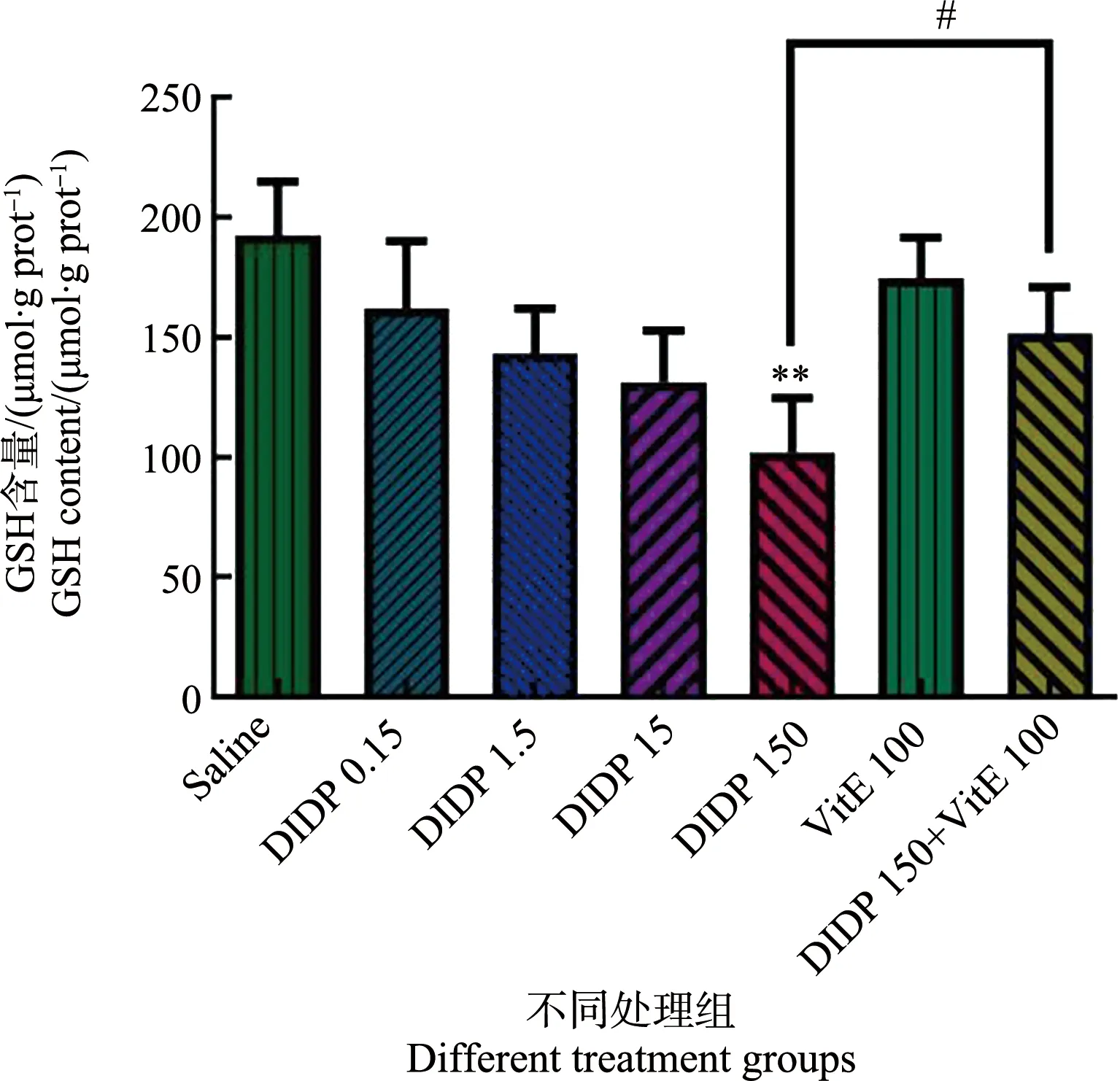
图5 不同处理组小鼠肝还原型谷胱甘肽(GSH)含量(n=6)注:** P<0.01,与生理盐水组比较;# P<0.05,与150 mg·kg-1 DIDP+100 mg·kg-1 VitE组比较。Fig. 5 Glutathione (GSH) content in mouse liver of different groups (n=6)Note: ** P<0.01, compared with the saline group; # P<0.05, compared with the 150 mg·kg-1 DIDP+100 mg·kg-1 VitE group.
2.6 小鼠肝组织MDA含量的变化
不同处理组肝组织的MDA含量变化如图6所示。与生理盐水组比较,中低剂量组(0.15、1.5和15 mg·kg-1)无统计学差异,高剂量组(150 mg·kg-1)的MDA含量显著升高(P<0.01)。与150 mg·kg-1的DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的MDA含量显著下降。
2.7 小鼠肝组织Caspase-3含量的变化
各组小鼠肝组织的Caspase-3含量测定结果如图7所示。随着DIDP染毒剂量的升高,Caspase-3含量逐渐上升。与生理盐水组比较,高剂量组(150 mg·kg-1)Caspase-3含量显著升高(P<0.01)。与150 mg·kg-1DIDP组比较,150 mg·kg-1DIDP+100 mg·kg-1VitE组的Caspase-3含量显著减少。
2.8 小鼠肝组织的荧光染色观察结果
通过Hoechst 33258荧光染料对小鼠肝组织进行荧光染色,染色后的细胞核呈蓝色,细胞质及其他组织呈绿色。如图8所示,生理盐水组中细胞核大多数呈圆形或椭圆形、淡蓝色,视野内细胞核分布密集。但随着DIDP染毒剂量的上升,细胞核大多数不
规则,开始变形并且缩小,呈亮蓝色,细胞核内凋亡小体明显增多。在最高剂量150 mg·kg-1DIDP组中,细胞核内凋亡小体数目最多。
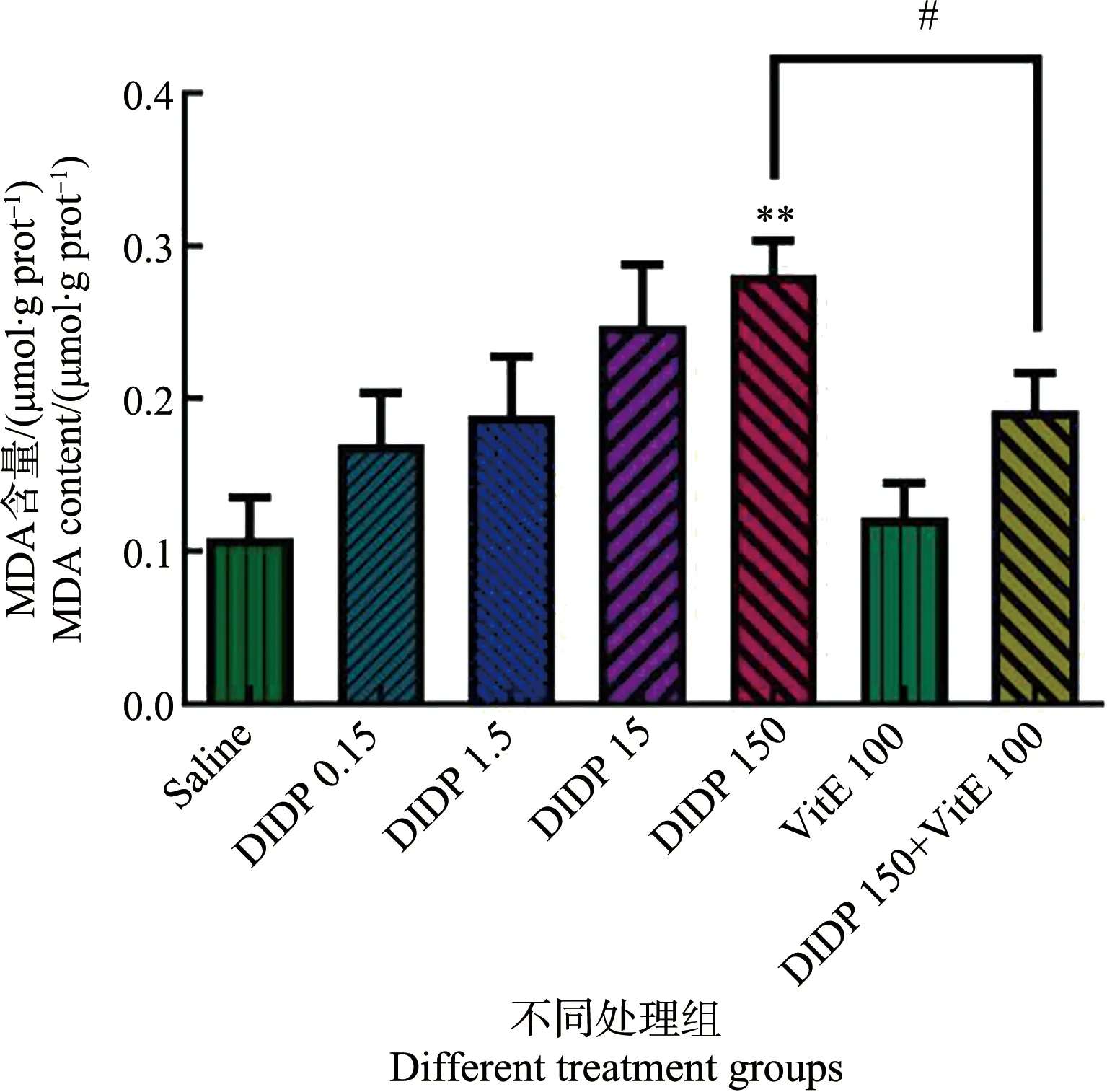
图6 不同处理组小鼠肝丙二醛(MDA)含量(n=6)注:** P<0.01,与生理盐水组比较;# P<0.05,与150 mg·kg-1 DIDP+100 mg·kg-1 VitE组比较。Fig. 6 Malondialdehyde (MDA) content in mouse liver of different groups (n=6)Note: ** P<0.01, compared with the saline group; # P<0.05, compared with the 150 mg·kg-1 DIDP+100 mg·kg-1 VitE group.
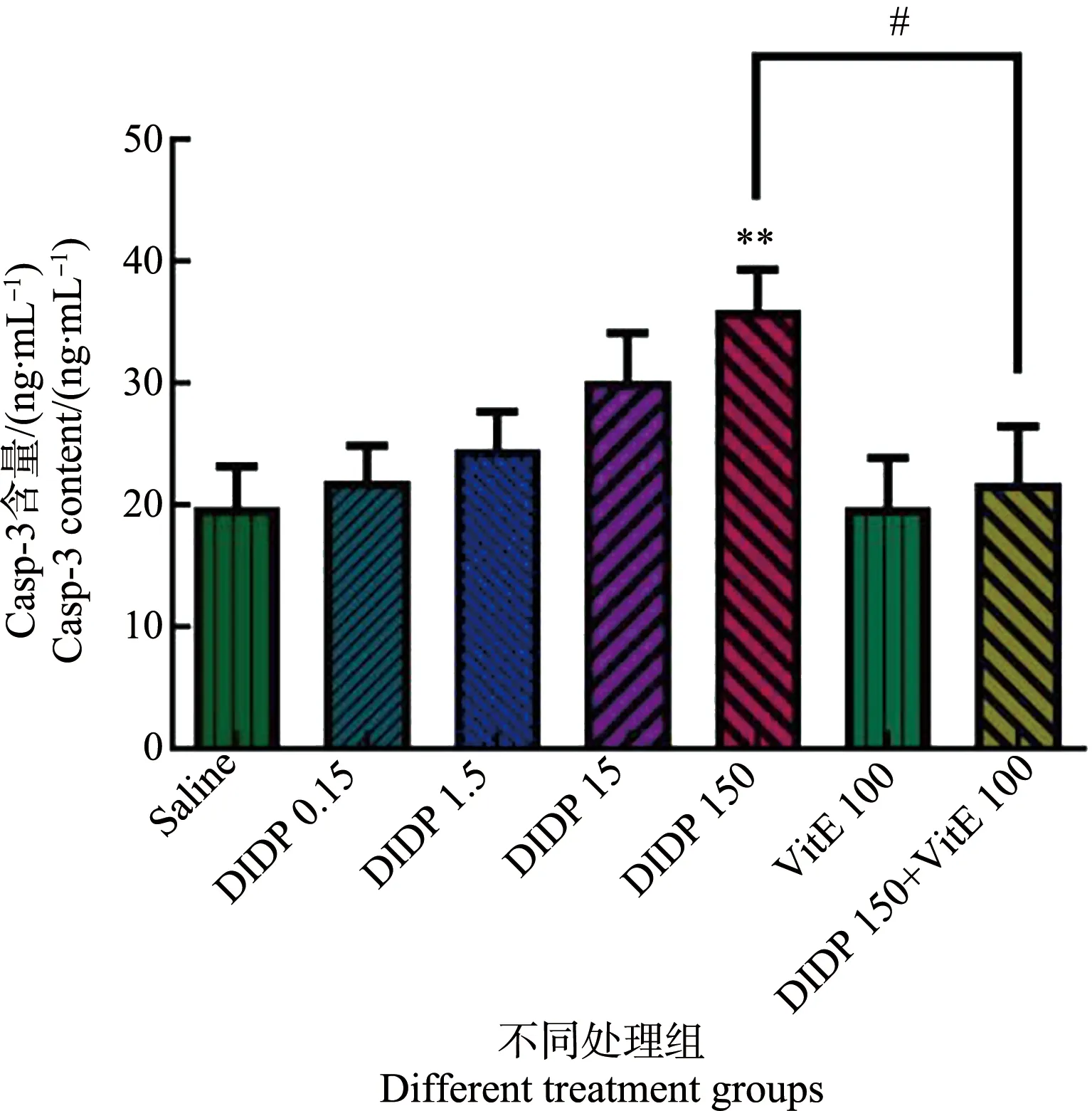
图7 不同处理组小鼠肝Caspase-3含量(n=6)注:* P<0.05、** P<0.01,与生理盐水组比较;# P<0.05,与150 mg·kg-1 DIDP+100 mg·kg-1 VitE组比较。Fig. 7 Caspase-3 content in mouse liver of different groups (n=6)Note: * P<0.05, ** P<0.01, compared with the saline group; # P<0.05, compared with the 150 mg·kg-1 DIDP+100 mg·kg-1 VitE group.
3 讨论(Discussion)
生物体内的新陈代谢都会伴随着有氧氧化,而肝脏作为人体内的重要器官,其代谢功能十分活跃,因而,需要大量的氧和营养物质来维持,并且会在有氧代谢过程中产生大量的ROS,发生氧化应激。氧化应激能够造成机体内物质的损伤,引起肝组织损伤,进而造成肝组织细胞凋亡和肝组织炎症的发生。Ma等[11]的研究表明,氧化应激的积累可能是邻苯二甲酸酯致肝脏损伤和毒理作用的重要分子机理。ROS是分子氧在还原过程中的一系列中间产物[16]。ROS在机体正常代谢状态下含量很低,受到刺激后大量增多,氧化应激的产生是因为ROS的累积,其可使组织出现不同程度的损伤[17]。GSH是ROS的主要清除剂,GSH的消耗可以反映机体的氧化损伤程度[18]。在本研究中,150 mg·kg-1DIDP组肝组织中的ROS水平显著增加,并且GSH含量显著降低,表明高剂量DIDP产生过量的活性氧物质;同时,机体的氧化平衡因为GSH的大量减少而遭到破坏。
脂质过氧化可以由过量的ROS直接或间接地攻击脂质分子所造成,导致细胞膜流动性和脆性的改变。膜组分之间的交联增加细胞膜和膜细胞器的通透性,导致细胞稳态功能障碍,如离子转运和能量代谢[18]。脂质过氧化的主要代谢产物是MDA,其水平代表脂质过氧化的强弱与快慢。在本研究中,150 mg·kg-1DIDP组的MDA含量显著增加,表明高剂量DIDP诱导小鼠肝细胞中的脂质过氧化,损伤了细胞膜结构。
病理学观察结果显示,小鼠的肝组织会随着DIDP染毒剂量的不断升高而出现不同程度的病理损伤。15 mg·kg-1DIDP组肝细胞有严重水肿,肝索排列无序,肝索肝窦比例失常,肝细胞坏死。150 mg·kg-1DIDP组中央静脉扩张、淤血;肝细胞水肿,胞浆疏松化,体积增大;肝索结构尚清晰,肝窦变窄。这表明,较高剂量DIDP可对肝细胞内部造成实质性的损伤,从而影响到肝功能。
正常情况下,AST主要存在于组织细胞中,其中心肌细胞含量最高,其次为肝脏,但其在血清中含量较低[19]。当肝细胞变性时,细胞膜通透性明显增加,从细胞内分泌出来的主要是ALT,而当肝细胞坏死严重时,线粒体内的AST便释放出来。AST含量高可以反映肝细胞损伤严重,更能反映肝细胞受损伤的严重程度。极少数的肝细胞损伤,就可引起ALT含量的成倍增高。因此,ALT被推荐为肝功能损害最敏感的检测指标[20]。本研究中,150 mg·kg-1DIDP组ALT含量显著上升,15 mg·kg-1和150 mg·kg-1DIDP组AST含量显著上升,表明中高剂量的DIDP能使小鼠肝细胞严重受损。
ALB是血清中蛋白质的一种,并且其在血清中含量最高,约占总体含量的57%~68%[21]。血清中ALB主要是由肝脏合成[22],ALB也是反映肝功能的重要指标,多种情况均可引起血清中ALB变化[23]。本研究中,150 mg·kg-1DIDP组ALB含量显著下降,说明高剂量的DIDP能导致小鼠肝功能异常。

图8 DIDP不同处理组小鼠肝组织荧光染色结果(10×40)Fig. 8 Fluorescence staining of mouse liver tissue in different treatment groups of DIDP (10×40)
由上述结果可知,随着DIDP染毒剂量的增加,肝组织病理损伤程度逐渐严重,肝细胞坏死情况也愈加严重,进而导致血清中肝功能标志物AST在DIDP中、高剂量组水平异常,同时,ALB水平在DIDP中、高剂量组水平也有异常。本研究中肝功能指标印证了肝脏组织切片观察结果。
细胞凋亡下游的关键酶是Caspase蛋白酶,而Caspase-3是其家族中最重要的成员之一。大多数细胞凋亡均需要通过Caspase-3来实现介导[24]。可以说,Caspase-3是细胞凋亡的执行因子。研究表明,氧化损伤可以诱导线粒体开放通透转换孔[25],而其开放可激活Caspase-3的表达[26]。研究广泛证实,ROS和氧化应激可通过触发细胞内Caspase级联效应介导细胞凋亡的发生[27-28]。在本研究中,150 mg·kg-1DIDP组Caspase-3含量显著上升,说明高剂量的DIDP能使小鼠肝细胞凋亡因子Caspase-3的形成增多。通过Hoechst 33258荧光染色分析结果表明,当DIDP的染毒浓度达到15 mg·kg-1以上时,细胞核开始变形,核由于浓集由淡蓝色逐渐变为亮蓝色,细胞核内凋亡小体明显增多,说明较高剂量的DIDP可造成小鼠肝组织细胞凋亡。
VitE是一种具有代表性的脂溶性天然抗氧化剂。它是维持身体正常新陈代谢的必需元素,因其多种生理功能而被广泛使用[29]。而VitE能在体内发挥强大的抗氧化作用,清除自由基,具有保护细胞膜的功能[30-31]。对150 mg·kg-1DIDP组添加保护剂VitE后,其肝组织的ROS和Caspase-3含量均显著下降,GSH含量显著上升,肝功能损伤与肝组织的病理损伤减轻,说明VitE可以降低由肝组织氧化应激所引起的肝脏损伤和细胞凋亡,对其有一定的拮抗作用。
综上所述,较高剂量的DIDP(≥15 mg·kg-1)诱导下,小鼠肝组织产生过量的ROS,破坏自身的氧化与抗氧化平衡,造成机体氧化应激。而氧化应激能够造成机体内物质的损伤,引起各种病理学损伤,进而造成肝功能损伤与细胞凋亡。抗氧化剂VitE可通过拮抗氧化应激,对机体形成保护作用。本研究结果证明了DIDP通过氧化应激作用导致雄性小鼠肝脏损伤和细胞凋亡,为进一步研究DIDP的毒性及分子机制提供了科学依据。
