冷冻胁迫对芦荟叶肉细胞原生质体中Ca2+、Na+分布的影响
2019-04-17张海娇徐长山邵海玲乔金何惠敏郑博文
张海娇,徐长山,邵海玲,乔金,何惠敏,郑博文
东北师范大学紫外光发射材料与技术教育部重点实验室,长春130024
冻害是造成巨大农业损失和植物死亡的主要因素,研究冷冻胁迫对植物的影响,对于揭示冻害机理,寻找抗冻害途径,减少因低温和冻害造成的农作物损失具有重要意义。目前,有关冷冻胁迫的研究主要集中在抗寒基因和基因表达产物、抗氧化防御系统、离子浓度变化和离子流、渗透调节物质等方面[1-3]。Zhu等[4]的研究表明,冷害会影响水稻细胞中抗氧化活性酶的活性,生成活性氧。Kazemishahandashti等[5]对鹰嘴豆苗进行冷冻处理,发现不饱和脂肪酸比率有所增加,CaCAT和CaSOD基因的转录水平升高,并生成大量的防御酶。Ma等[6]对水稻进行低温处理后检测其根部细胞的钙离子(Ca2+)流,发现胞外的Ca2+会快速流入细胞内,COLD1基因超表达,水稻细胞对Ca2+的吸收极其强烈,表明COLD1可通过调控Ca2+来激活水稻的抗寒响应。
植物细胞中的Ca2+在抗逆境信号转导中一直备受人们关注。当细胞受低温、高温和盐碱等外部刺激时,早期的细胞信号事件几乎都是Ca2+的变化[7],影响了细胞内Ca2+水平平衡,形成钙信号被相应细胞器识别[8-10]。现已有大量冷冻胁迫的研究数据证明,植物细胞内的Ca2+在感应、传导抗寒信号和诱导生理响应过程中起着重要的作用。当植物受冷冻胁迫时,Ca2+会流进植物细胞内,引起细胞内部Ca2+浓度升高,诱导植物细胞内抗寒基因的表达[11-12]。Zheng等[13]使用化学定位法研究了冷冻胁迫下枇杷叶肉细胞Ca2+分布的变化,发现冷冻胁迫首先会诱导Ca2+进入细胞内,并在叶绿体膜上聚集,最终进入叶绿体。van der Luit等[14]对低温胁迫下的烟草幼苗进行了研究,发现低温会使细胞质和细胞核中Ca2+浓度快速升高,诱导NpCaM-1的表达。Mori等[15]在拟南芥中发现低温会触发细胞内游离Ca2+浓度的迅速升高。目前的这些研究大多是检测组织、细胞或细胞器中Ca2+的分布、浓度变化和离子流来研究植物在受冷冻胁迫时的抗逆反应。但通过检测冷冻胁迫下原生质体破裂产生的Ca2+浓度信号来分析其细胞液中Ca2+分布的研究仍比较少。
在众多离子中,钠离子(Na+)的主要生理作用是增加细胞的渗透势。当植物吸收大量的Na+后,其胞内的电解质浓度增加,组成原生质体的胶体会发生膨胀,从而提高了原生质的亲水性,增加了细胞的保水力[16]。低浓度的Na+对小麦、玉米、大豆、棉花和藻类等植物的生长都有促进作用[17]。在1979年,Brownell和Crossland[18]就已经证实,Na是C4植物的必需营养物质,如盐生植物滨藜和白刺,Na元素的缺失会导致叶片枯黄,生长延缓。而高浓度的Na+很容易对植物造成毒害,破坏细胞膜和使一些蛋白质不稳定,影响细胞的生理活动,如细胞分裂和生长、代谢及矿质营养元素的动态平衡等方面,抑制植物生长发育[19-20]。目前对Na+的研究主要集中在植物盐害和抗盐性方面[21],但对冷冻胁迫下植物细胞中Na+分布的相关研究比较少。
近几年来,由于纳米技术的发展,纳米材料逐渐以各种方式渗透到人们的生产生活中。氧化锌纳米粒子(ZnO NPs)由于其独特的物理、化学特性被应用到陶瓷、纺织、医药、防晒化妆品和太阳能电池等方面[22]。ZnO NPs可以通过水、土壤和空气等方式对人类、动物和植物造成影响[23]。当前,有关ZnO NPs对动植物产生负面影响的报道比较多。如陈泽林等[24]发现ZnO NPs对处于吸胀阶段、萌动阶段和发芽阶段的小麦都有毒性作用。Boonyanitipong等[25]的研究表明,ZnO NPs可以阻碍水稻根生长,并减少根的数量。但还有研究表明,ZnO NPs在一定条件下,对植物的生长发育具有积极作用。Prasad等[26]使用粒径为25 nm、浓度为1 000 mg·L-1的ZnO NPs处理花生种子,发现花生幼苗的萌芽和生存能力都得到了显著的提升。Pavani等[27]报道称,ZnO NPs增加了鹰嘴豆新鲜和干燥的重量,促进了其芽、根的伸长。Abdel Latef等[28]研究发现,ZnO NPs还可以减轻其他类型的非生物胁迫对植物所造成的影响。使用粒径为21.3 nm的不同浓度ZnO NPs(20、40和60 mg·L-1)浇灌盐渍土栽培(150 mmol·L-1NaCl)的羽扇豆,发现ZnO NPs不但促进了光合色素、酚类化合物和抗坏血酸的形成,还增强了超氧化物歧化酶、氧化氢酶和氧化物酶的活性。与未经ZnO NPs处理盐渍土栽培的羽扇豆相比,盐渍土抑制可其生长,减少叶绿素的色素沉淀,削弱过氧化氢酶的活性。但对于植物冷冻胁迫的研究,目前尚未有研究涉及ZnO NPs在植物受冷冻胁迫中的作用。
使用离子选择性微电极检测芦荟(Aloevera)原生质体破裂时形成的Ca2+浓度脉冲,同时检测Na+浓度作为对比,研究了冷冻胁迫对原生质体中Ca2+的分布的影响。并研究了冷冻温度、解冻时间和ZnO NPs处理等因素对冷冻胁迫下芦荟原生质体中离子的分布的影响。
1 材料与方法(Materials and methods)
1.1 芦荟(Aloe vera)细胞原生质体的制备
使用分析天平(XS205DU,精度十万分之一,Switzerland)称取2.186 g甘露醇(≥80.5%,中国惠世生化试剂有限公司)、0.222 g二水合氯化钙(≥98%,西陇化工有限公司)、0.040 g磷酸二氢钾(≥99.5%,北京化工厂)、0.400 g纤维素酶(U·g-1>15 000,国药集团化学试剂有限公司)和0.280 g果胶酶(1.18 U·mg-1,Sigma Aldrich)放入烧杯中,加入20 mL去离子水,用磁力搅拌器(CL-2,巩义市予华仪器有限公司)搅拌。再将得到的溶液进行离心(DT5-6,北京现代北利离心机有限公司),转速2 000 r·min-1,时间8 min。取其上清液倒入烧杯中,酶解液制备完成。取长势优良的芦荟叶片,用去离子水洗净,把表面水分吸干,切成3 cm的小段,去除叶片表面透明表皮和中间透明胶质层后,切成4 mm宽的小条。取4 g左右的叶片,放入盛有20 mL酶解液的烧杯中,用封口膜将烧杯口封住。放入恒温培养振荡器(ZWYR-240,上海智诚分析仪器制造有限公司)中,黑暗条件下进行酶解,温度为20 ℃,转速为60 r·min-1,时间4 h左右。为促进酶解,每隔1 h摇瓶一次。
酶解后得到含有原生质体、维管成分和未酶解完全的叶子残片等的混合液,用200目的网筛过滤,得到初步纯化的芦荟原生质体,静止放置。为减少酶解液中含有的离子对后续测量的干扰,在测量前需用无钙、无钠培养基(浓度为109.3 mg·L-1的甘露醇溶液)清洗原生质体。用胶头滴管吸除原生质体上层的酶解液,向其加入20 mL无钙、无钠培养基,静置20 min。如此反复清洗4次,加入20 mL无钙、无钠培养基,室温下静止放置,备用。
1.2 离子选择微电极的制备及表征
1.2.1 离子微电极的制备
使用微电极拉制仪(WD-2,成都仪器厂)拉制玻璃微电极,设置加热指数为300,硼硅酸盐玻璃管(B150-110-10,外径1.5 mm,内径1.10 mm,长度10 cm,Sutter Instrument)经电阻圈加热软化,重锤下拉,得到微电极管。先将微电极管放置在温度为200 ℃的干燥箱中(DHG-9140A,巩义市予华仪器有限公司),进行预干燥处理1 h。再采取尾端注入法对微电极管进行硅烷化。然后在微电极管中灌充浓度为10-1mg·L-1的CaCl2或NaCl电解液,并在微电极尖端吸入液体离子交换剂。最后插入Ag/AgCl丝作为内参比电极,钙或钠离子选择性微电极制备完成[29-30]。
1.2.2 离子选择性微电极的表征
离子选择性微电极在使用之前需对其进行性能检测,从线性范围、检测下限、响应时间和稳定性4个方面对所制备的Ca2+、Na+选择性微电极进行了表征,如图1所示。
由图1(a)、(b)中可知,Ca2+、Na+选择性微电极在标定液浓度10-1~10-5mol·L-1范围内都有良好的响应,回归系数分别为0.9991、0.9996,检测下限均可达10-5mol·L-1。图1(c)为微电极在10-3mol·L-1的标定液中,连续检测3 h内的电位值,平均电位值分别为-(14.46±0.24)、-(52.44±0.59) mV,稳定性都良好。图1(d)为Ca2+、Na+选择性微电极在不同浓度标定液中的响应时间,分别为(0.550±0.016)、(0.646±0.014) s,都小于1 s,响应性能良好。以上情况说明,制得的Ca2+、Na+选择性微电极具有良好的性能,满足实验的要求。
1.3 ZnO NPs的表征及悬浮液的配制
1.3.1 ZnO NPs的表征
图2(a)、(b)分别为ZnO NPs(Sigma Aldrich)的XRD谱和TEM图。在图2(a)中,经与PDF#36-1415卡片对照后,发现测试谱中的所有衍射峰与标准谱完全一致,说明该物质为六角纤锌矿型ZnO,未见其他杂相存在。由图2(b)可以看出ZnO NPs形状呈球形,形貌均匀,平均直径约为20 nm。
1.3.2 ZnO NPs悬浮液的配制
用分析天平称取0.60、1.00、1.40和1.80 mg的ZnO NP放入烧杯中,分别加入20 mL无钙、无钠培养基。水浴超声(KQ-250DB,350 W,昆山市超声仪器有限公司)10 min,配制成浓度分别为30、50、70和90 mg·L-1的ZnO NP悬浮液。
1.4 芦荟原生质体的冷冻处理
用胶头滴管吸除原生质体层上的培养基,摇晃烧杯,用移液枪吸取原生质体向6只培养管中各滴入1 000 μL,注入5 mL的无钙、无钠培养基。其中1只室温下保存,5只放入冰箱冷冻处理,使其温度分别降至10 ℃、0 ℃、-5 ℃、-7 ℃和-10 ℃,取出后室温下静止放置,使已结冰的培养基完全解冻,温度恢复到室温待用。
1.5 用ZnO NPs进行预处理和后处理
预处理:将芦荟原生质体随机分成约等量的4组,每组4份。取其中一组,分别注入5 mL不同浓度的ZnO NPs悬浮液(30、50、70和90 mg·L-1),放入冰箱冷冻处理,待温度降至-7 ℃后取出解冻,使其温度恢复到室温。
后处理:再取一组,分别滴入装有5 mL的无钙、无钠培基的培养管中,放入冰箱中冷冻结冰后取出。静止放置,待其温度恢复到室温时,去除上层培养基,注入不同浓度的ZnO NPs悬浮液(30、50、70和90 mg·L-1)各5 mL,处理20 min。
最后取剩余2组,分别加入5 mL的不同浓度ZnO NPs悬浮液,静止室温下分别处理3和18 h。
1.6 离子脉冲信号的检测
为降低实验环境中可能存在的震动和电磁辐射对测量信号的干扰,实验需在金属屏蔽网中的防震台上进行。先将Ca2+、Na+选择性微电极和作为参比的甘汞电极分别固定在三维微操纵仪上,并与微电极放大器(SWF-1D,成都仪器厂)的前级相连(Ca2+、Na+选择性微电极分别接到不同的输入通道)。将样品池(10 mL无菌培养皿)放在倒置显微镜(CPX41,Olympus)的操作台上,将甘汞电极移到距样品池底部约0.5 cm处,缓慢将Ca2+、Na+选择性微电极靠近样品池底部并固定。将倒置显微镜调至4倍物镜,调节三维操纵仪使得2支选择性微电极在视野中央。再将物镜切换到10倍,细调三维微操纵仪使Ca2+、Na+选择性微下降至样品池底部,需保持2只微电极的尖端同时在视野中。最后用移液枪吸取50 μL的待测原生质体,滴入装有10 mL低渗液(浓度为0.0273 mg·L-1的甘露醇溶液)的培养管中,轻轻摇晃均匀后缓慢倒入样品池中。保证甘汞电极和Ca2+、Na+选择性微电极同时浸没在溶液中。通过显微镜在视野中找到一个原生质体作为待测目标,并且视野中应没有其他原生质体存在。将Ca2+、Na+选择性微电极分别移动到目标原生质体附近,使2支选择性微电极的尖端尽量靠近该原生质体的同一位置。关闭屏蔽网,生理信号采集系统(RM6240B,成都仪器厂)开始记录并将信号显示在显示器上。观测到原生质体破裂的脉冲信号后,再等待电位恢复平稳停止记录,保存数据。
1.7 统计学方法
每组实验重复3次,每次实验中从每组原生质体中随机选取3个原生质体(合计每组9个原生质体)进行离子浓度脉冲测试,用SPSS 22.0软件(SSPS Inc.)对实验数据进行方差分析。采用ANOVA方法对实验数据进行差异显著性分析(检验标准为P<0.05)。*表示P<0.05,**表示P<0.01。实验数据表述为平均值±标准偏差。
2 结果与分析(Results and analysis)
2.1 冷冻对原生质体中Ca2+、Na+分布的影响
未经冷冻和经冷冻处理的芦荟原生质体破裂时的Ca2+、Na+脉冲信号(以电极电位表示,下同)如图3所示。由图3(a)可知,未经冷冻处理的Ca2+、Na+信号在原生质体破裂前电位相对平稳,对应背景离子浓度。当原生质体开始破裂时,其周围的Ca2+浓度明显上升,直至离子浓度达到一个峰值,这段时间为T1,计算得到T1=(11.5±2.2) s。之后随着Ca2+慢慢向周围扩散,Ca2+浓度慢慢开始下降,直至趋于平稳,回复到背景浓度。整个过程结束后形成了一个向上的脉冲信号。这个脉冲信号为一个单一的脉冲,没有叠加其他细节,表明原生质体内Ca2+浓度分布比较均匀。Na+浓度脉冲信号与此类似,原生质体开始破裂到达到峰值所用时间为t1,计算得到t1=(4.0±0.98) s。图3(b)为经冷冻处理的原生质体破裂时产生的Ca2+、Na+浓度脉冲信号。与图3(a)对比发现,经冷冻处理后,Ca2+的脉冲信号发生了明显变化。虽然在破裂前Ca2+的浓度仍保持在背景浓度上,但当原生质体开始破裂时,经冷冻处理后的原生质体周围的Ca2+浓度并未像未经冷冻处理的原生质体那样快速上升,反而先显著地下降达到一个最低点,紧接着才迅速上升,在Ca2+浓度脉冲的前沿处形成一个明显的“凹陷”,从原生质体破裂到凹陷恢复所用时间为T2,经计算得到T2=(11.3±1.5) s,形成凹陷的深度为H,计算得H=(16.9±2.4) mV,从原生质体破裂到脉冲最高点所用时间T1’=(19.8±3.0) s。而经冷冻处理的原生质体的Na+的浓度脉冲信号则与未经处理的原生质体破裂时的离子信号情况基本相同,没有出现前沿凹陷的现象,t1’=(3.9±1.0) s。经对比发现,经冷冻处理后的Ca2+浓度脉冲从原生质体破裂开始至到达峰值所有的时间T1大于未经冷冻处理的Ca2+浓度脉冲的相应值,两者间存在显著差异(P<0.01),相差约8 s;而Na+浓度脉冲在冷冻前后t1几乎没有变化(二者无统计学差异,P>0.05)。
经冷冻处理后的芦荟原生质体,其破裂时形成Ca2+浓度脉冲信号前沿出现显著的凹陷现象,说明原生质体中的Ca2+分布不再均匀,靠近细胞中心浓度较高,而细胞膜附近浓度较低,产生了分层现象。
原生质体在低渗液吸水而膨胀破裂的。由于在这一过程中有水渗透进原生质体,如果原生质体内的Ca2+不能很快扩散进这些新渗入的水中,则在原生质体中靠近细胞膜处便会形成一个Ca2+的低浓度区,这自然会使脉冲信号的前沿处出现一个与低浓度区相对应的凹陷。
但从图3(a)中可知,未经冷冻处理芦荟原生质体在破裂时,其Ca2+浓度脉冲的前沿处并未出现这种凹陷。这说明,未经冷冻处理的芦荟原生质体内的Ca2+能够很快地扩散到渗入原生质体内的水中,维持了Ca2+浓度的均匀分布。这也表明,未经冷冻处理的原生质体对其内部的Ca2+浓度分布具有很好的调控能力。
经过冷冻后的芦荟原生质体在破裂时其Ca2+浓度脉冲信号前沿处出现了凹陷,表明其中的Ca2+流动性变差,或者说原生质体调控Ca2+浓度分布的能力遭到了破坏,使得Ca2+不能很快扩散到渗入的水中去,造成Ca2+浓度分布不均匀,出现了分层现象。
以往人们在研究低温胁迫或细胞的冷冻保存与复苏时,大多集中于研究胞外空间的离子流变化或水结冰时形成的冰晶对细胞的机械损伤,而没有注意到细胞调控Ca2+分布的能力的变化[31-32]。赵明明等[33]研究了低温处理后冬青叶片细胞内Ca2+水平变化,结果表明,细胞内Ca2+沉淀随温度的降低而有所增加。杨蕊等[34]报道了在4 ℃下黄杨叶肉细胞中Ca2+和Ca2+-ATPase的变化,处理3~12 h后细胞间隙和液泡中的Ca2+沉淀颗粒较少,而细胞质和细胞核内的Ca2+增多,Ca2+-ATPase分布几乎未受影响,处理24 h后,细胞质和细胞核内Ca2+开始转移到细胞间隙和液泡中,Ca2+-ATPase的活性增强。在2018年,虽然Mori等[15]在文章中提到低温会引起拟南芥细胞内Ca2+浓度的迅速升高。但这些研究均未提及Ca2+的浓度分布是否出现分层现象。因此,笔者的研究结果对于今后这方面的研究具有一定的借鉴意义。与Ca2+不同,Na+在冷冻处理后其浓度分布没有发生分层的现象,这可能与细胞对Ca2+和Na+分布的调控机制不同,及Ca2+和Na+在细胞抗冷冻反应中的作用有关,需要作进一步的深入研究。
2.2 冷冻温度对芦荟原生质体中Ca2+、Na+分布的影响
为了进一步研究冷冻温度对芦荟原生质体中Ca2+、Na+浓度分布的影响,将芦荟原生质体冷冻至不同温度后,研究了其中的Ca2+、Na+浓度分布。
图4为冷冻至不同温度的芦荟原生质体,在低渗液中破裂时的产生的Ca2+、Na+浓度脉冲信号。(a)~(f)的温度分别为18 ℃、10 ℃、0 ℃、-5 ℃、-7 ℃和-10 ℃。从图中可以看出,当温度为18 ℃、10 ℃、0 ℃和-5 ℃时Ca2+、Na+的信号脉冲与未经冷冻处理的原生质体破裂时的离子信号基本相同,其信号前沿处均未出现凹陷。而当冷冻至-7 ℃时,Ca2+脉冲的前沿部分开始出现明显的“凹陷”,原生质体中Ca2+分布发生了改变。温度降低到-10 ℃时,凹陷依然存在。
王红等[35]使用焦锑酸钙沉淀的电镜细胞化学方法研究水稻幼苗细胞经1 ℃处理24、48 h后细胞中Ca2+定位分布的变化。研究发现,处理24 h胞质膜内侧形成了一圈Ca2+沉淀颗粒,当处理时间增加到48 h后,液泡中的Ca2+许多也分布在液泡膜的内侧,一部分颗粒趋向靠近液泡膜,而液泡中心部分的Ca2+分布似乎有减少的趋势。谢潮添等[36]同样使用焦锑酸钙沉淀的电镜细胞化学方法,研究了2 ℃下的董棕幼苗叶肉细胞中Ca2+水平及其细胞超微结构的变化,研究表明,未经低温处理的董棕幼苗叶肉细胞,焦锑酸钙沉淀颗粒大量出现在液泡和细胞间隙中。48 h低温处理后,细胞基质和细胞膜上焦锑酸钙沉淀增加,叶绿体外膜受损。处理120 h后,焦锑酸钙沉淀大多分布在胞基质和细胞膜上,较少分布在液泡和核基质中。叶绿体、核膜和液泡膜严重破损,内部结构模糊。上述研究表明,低温处理有使Ca2+向细胞膜附近聚集的趋势,这与笔者的发现似乎刚好相反。不过,上述研究均使用了焦锑酸钙沉淀的电镜细胞化学方法,测量过程中细胞中的Ca2+以沉淀方式被析出,而且透射电镜观察需要对细胞进行固定,这些都影响了的Ca2+的流动性。而笔者所采用的方法则不需要对Ca2+进行沉淀析出,也不用对细胞进行固定处理,所得的结果应当更接近细胞内Ca2+的真实分布。
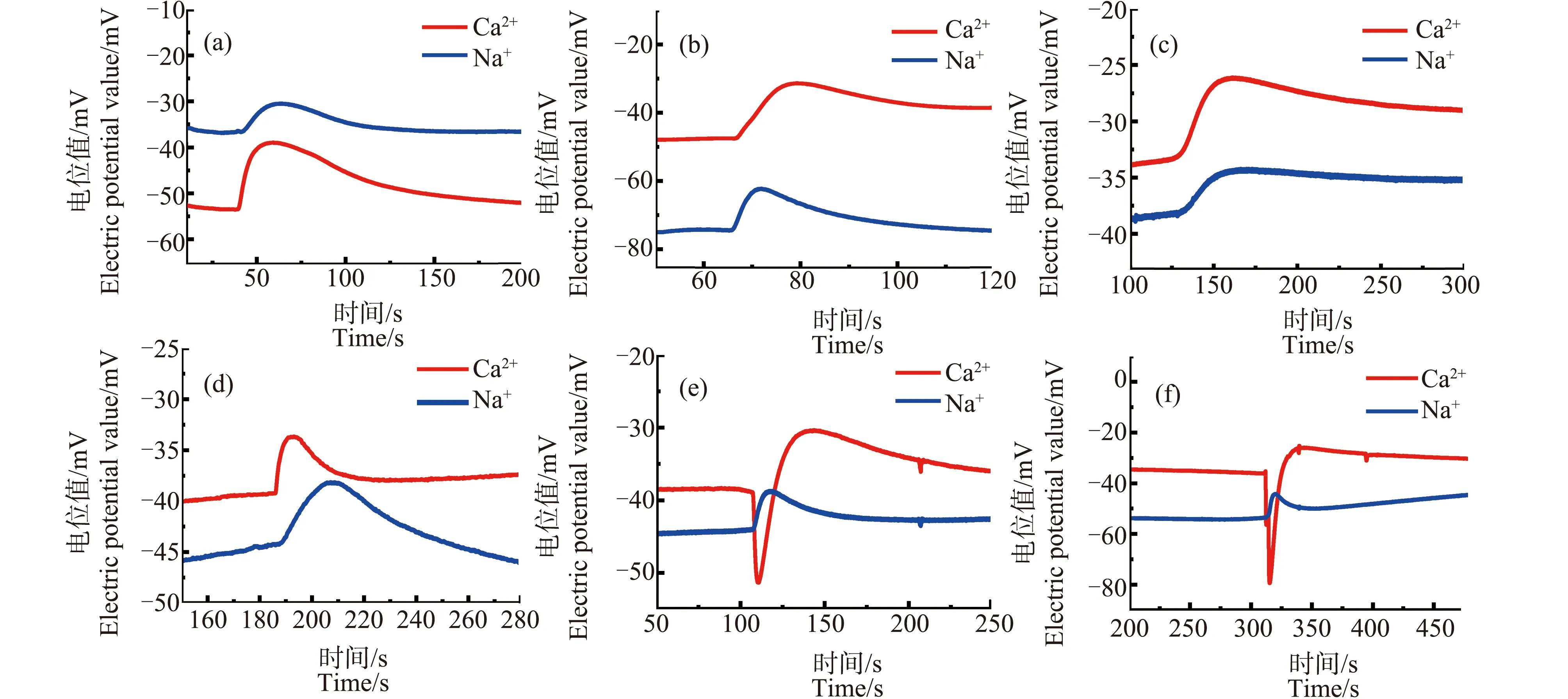
图4 不同冷冻温度下原生质体破裂时的Ca2+、Na+浓度脉冲图注:(a)~(f)温度分别为18 ℃、10 ℃、0 ℃、-5 ℃、-7 ℃和-10 ℃。Fig. 4 Pulse of Ca2+ and Na+ concentration of protoplasts cooled to different temperatures Note: (a)~(f), the temperatures are 18 ℃, 10 ℃, 0 ℃, -5 ℃, -7 ℃ and -10 ℃.
有趣的是,在各种不同的温度下,Na+脉冲信号的前沿始终没有出现凹陷。这说明,冷冻胁迫会对芦荟原生质体中的Ca2+分布造成影响,但对Na+分布几乎没有影响。
2.3 解冻时间对冷冻处理后Ca2+分布的影响
为了研究解冻时间对冷冻处理后Ca2+分布的影响,笔者选择冷冻至-7 ℃的芦荟原生质体为研究对象。将其解冻不同时间后,对其Ca2+浓度分布进行测量。图5为芦荟原生质体解冻后1、3和5 h后,其破裂时产生的Ca2+脉冲信号的情况。可以观察到经冷冻处理后的原生质体的Ca2+浓度脉冲前沿处的“凹陷”现象在解冻5 h后依然没有消失,原生质体中的Ca2+浓度分层的现象依然存在。这说明,冷冻造成的原生质体内Ca2+流动的降低,或者说原生质体对Ca2+浓度的调控能力的下降,并不会在原生质体解冻后马上恢复,而是会持续相当长的时间。
2.4 ZnO NPs预处理对冷冻原生质体中Ca2+、Na+分布的影响
图6为经不同浓度ZnO NPs预处理后再进行冷冻(温度降至-7 ℃)的芦荟原生质体,在低渗液中破裂时产生的Ca2+、Na+浓度脉冲信号。图中(a)~(d)的ZnO NPs浓度分别为30、50、70和90 mg·L-1。
由图6可知,不同浓度ZnO NPs预处理后原生质体破裂时的Ca2+浓度脉冲曲线在前沿处也都出现了“凹陷”现象。但与未经ZnO NPs预处理的情况相比,经处ZnO NPs理后Ca2+浓度脉冲前沿处的凹陷程度都明显减小,凹陷深度H为(1.5±0.78) mV。明显小于冷冻胁迫下未加ZnO NPs的凹陷深度(16.9±2.4) mV,相差约为15.4 mV,统计分析表明二者存在显著差异(P<0.01)。这说明,二者中的Ca2+浓度分布情况有明显差异,Ca2+浓度分布发生变化。虽然大量研究都已表明,ZnO NPs对植物细胞具毒性[37-39],如破坏膜的完整性,DNA链断裂[40],抑制叶绿素的形成[41]等。但至少从笔者的研究结果来看,ZnO NPs预处理对抵抗冷冻所造成的Ca2+流动性下降,维持细胞对Ca2+浓度分布的调控能力方面具有一定的积极作用。与前面的情形一样,Na+浓度脉冲的形状仍没有明显的变化,没有出现前沿凹陷在现象。
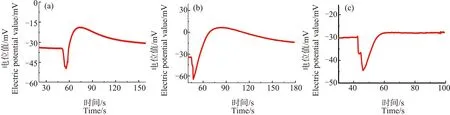
图5 解冻后1 h(a)、3 h(b)和5 h(c)后芦荟原生质体破裂时产生的Ca2+脉冲信号Fig. 5 The Ca2+ pulse signal produced when the protoplasts of Aloe vera are breaking down after 1 h (a), 3 h (b) and 5 h (c) of thawing
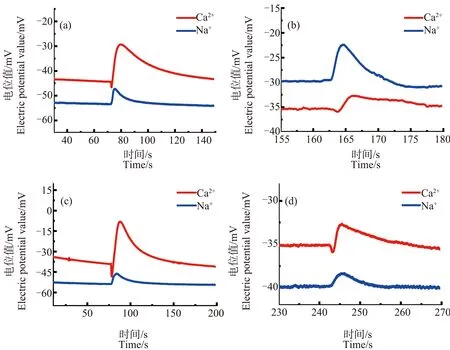
图6 不同浓度ZnO NPs预处理后冷冻胁迫下原生质体破裂时的Ca2+、Na+浓度脉冲图注:(a)~(d)中ZnO NPs浓度分别为30、50、70和90 mg·L-1。Fig. 6 Pulses of Ca2+ and Na+ concentrations of breaking Aloe vera protoplasts treated with different concentrations of ZnO NPsNote: (a)~(d), the concentrations of ZnO NPs were 30, 50, 70, and 90 mg·L-1.
2.5 ZnO NPs对冷冻后原生质体中Ca2+、Na+分布的影响
图7为芦荟原生质体先经冷冻处理(温度降至-7 ℃)后,再用不同浓度的ZnO NPs进行后处理,最后将其放入低渗液中所测得的Ca2+、Na+浓度脉冲信号。
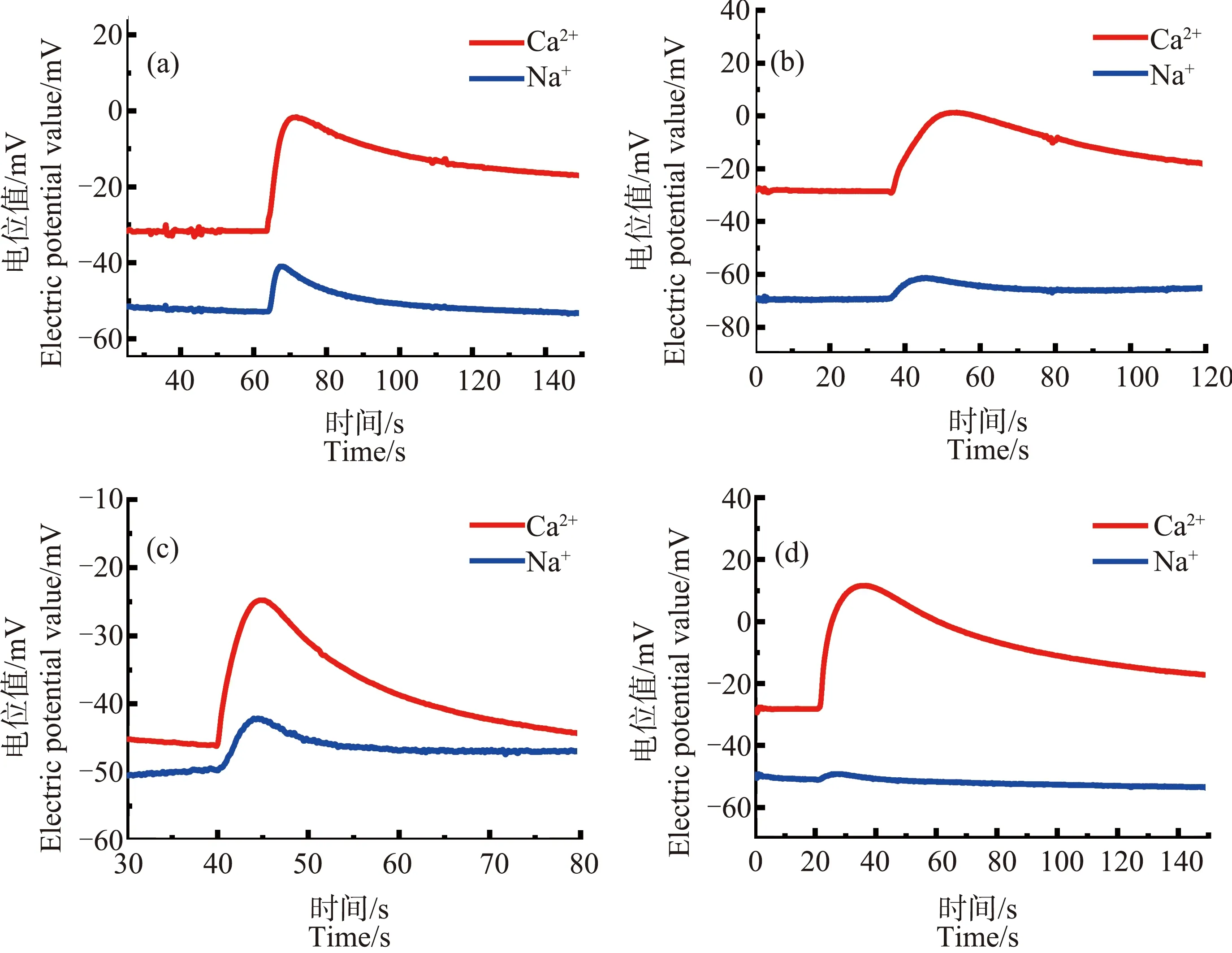
图7 ZnO NPs处理解冻后原生质体破裂后Ca2+、Na+信号脉冲图注:(a)~(d)中ZnO NPs浓度分别为30、50、70和90 mg·L-1。Fig. 7 Ca2+ and Na+ pulse signal of Aloe vera protoplasts treated with ZnO NPs after thawingNote: (a)~(d), ZnO NPs concentrations are 30, 50, 70, and 90 mg·L-1.
由图中可以看出一个十分有趣的现象。解冻后再经不同浓度ZnO NPs处理的原生质体在低渗液中破裂时,不但Na+浓度脉冲的前沿处没有出现凹陷,Ca2+浓度脉冲前沿处的“凹陷”也消失了。这说明,ZnO NPs处理使得芦荟原生质体中由于冷冻造成的Ca2+浓度分层消失了,ZnO NPs的加入使得Ca2+浓度分布又发生了新的变化,造成这一现象的具体原因目前还不是十分清楚。
2.6 ZnO NPs对未经冷冻的芦荟原生质体中Ca2+、Na+分布的影响
为了进一步探究冷冻前后ZnO NPs处理可使浓度脉冲前沿凹陷深度减小甚至消失这一问题,了解原生质体内部Ca2+、Na+浓度分布的变化情况。笔者检测了不同浓度ZnO NPs处理3和18 h的未经冷冻的芦荟原生质体破裂过程中产生的Ca2+、Na+浓度脉冲情况,检测结果如图8和图9所示。
由图8可知,当ZnO NPs浓度为30、50和70 mg·L-1时,经3 h处理后,芦荟原生质体破裂时产生的Ca2+、Na+信号中均未出现前沿凹陷的现象。而当ZnO NPs浓度为90 mg·L-1时,发现Ca2+浓度脉冲的前沿有轻微的凹陷。另一个值得注意的现象是,图8(b)~(d)中,在脉冲上升段的开始处,其上升趋势更加陡峭。而且,随着处理时间的增加,这种趋势更加明显,如图9所示。
从图9中可以明显看出,(a)~(d)中4组脉冲信号的上升段的开始处,脉冲上升速度极快,与其后部分的上升速度有明显区别。笔者统计了未经ZnO NPs处理、经ZnO NPs分别处理3和18 h的Ca2+浓度脉冲上升部分时间T1和该部分前1/3处时间T1/3,如图10所示。
经过比较发现,未经ZnO NPs处理与ZnO NPs处理的Ca2+浓度脉冲其从原生质体破裂到达到最大值所用的时间T1基本一致,而在上升的前1/3处所用的时间T1/3相差明显。
这一明显区别表明,与冷冻造成的原生质体内靠近细胞膜处Ca2+浓度下降不同。经ZnO NPs处理后的芦荟原生质体中,靠近细胞膜处的很小范围内,Ca2+浓度有较为明显的上升趋势。这说明,Ca2+浓度分布与未经ZnO NPs处理时相比发生了变化,猜想可能是ZnO NPs使得芦荟原生质体中Ca2+在细胞膜附近分布较集中,从而导致细胞膜破裂后,在脉冲前沿形成较明显的浓度变化。可能正是这一现象,使得经ZnO NPs预处理的芦荟原生质体,在冷冻后其Ca2+浓度脉冲前沿处的凹陷变浅;也会使先冷冻再用ZnO NPs进行后处理的芦荟原生质体的Ca2+浓度脉冲前沿凹陷消失。这当中的具体机制值得深入研究。经过不同时间的ZnO NPs处理,Na+浓度脉冲的形状依然没有明显变化,没有出现前沿凹陷在现象。
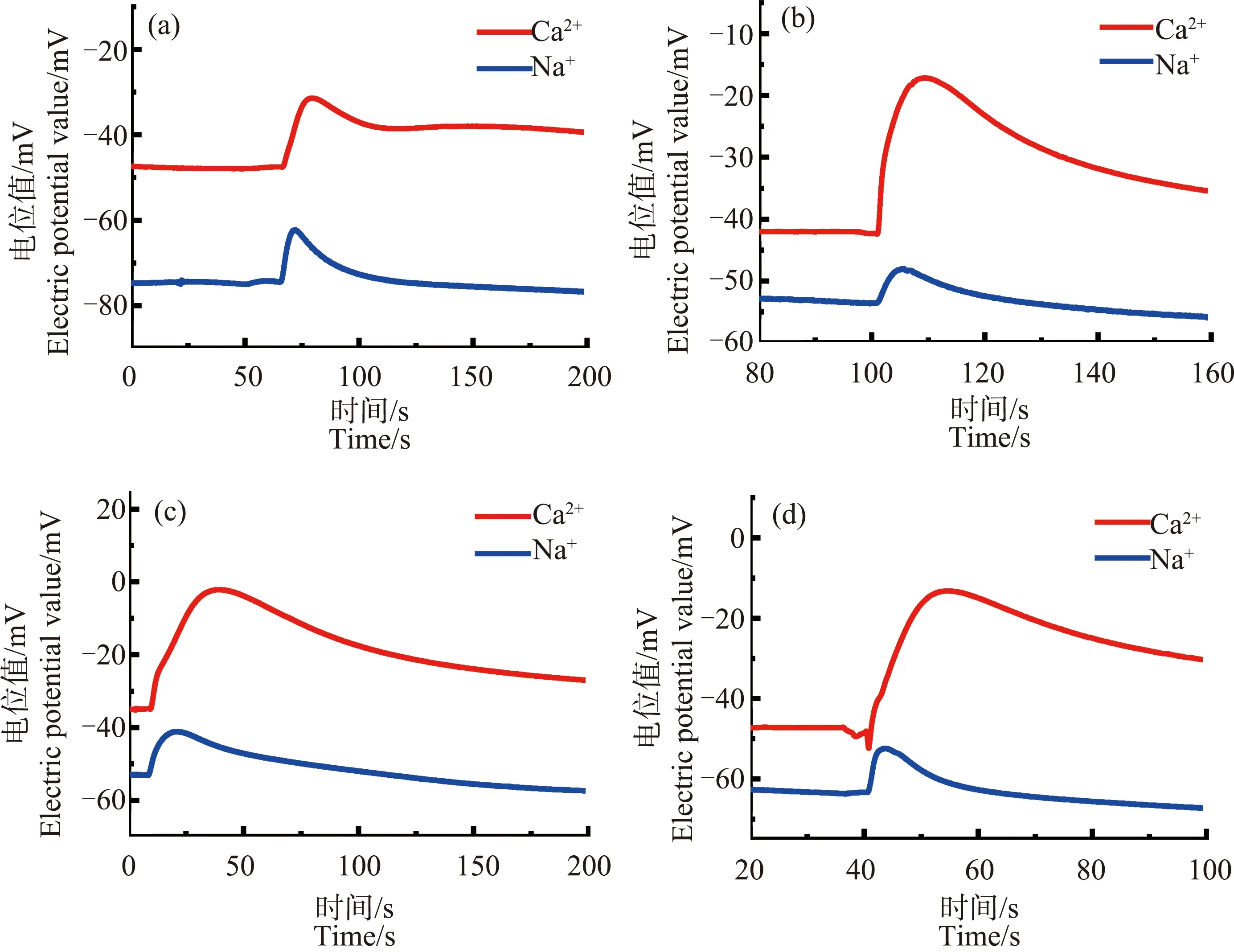
图8 不同浓度的ZnO NPs处理3 h后的芦荟原生质体破裂时的Ca2+、Na+浓度脉冲注:(a)~(d)中ZnO NPs浓度分别为30、50、70和90 mg·L-1。Fig. 8 Ca2+ and Na+ concentration pulses of breaking Aloe vera protoplasts after treatment with different concentrations of ZnO NPs for 3 hNote: (a)~(d), ZnO NPs concentrations are 30, 50, 70, and 90 mg·L-1.
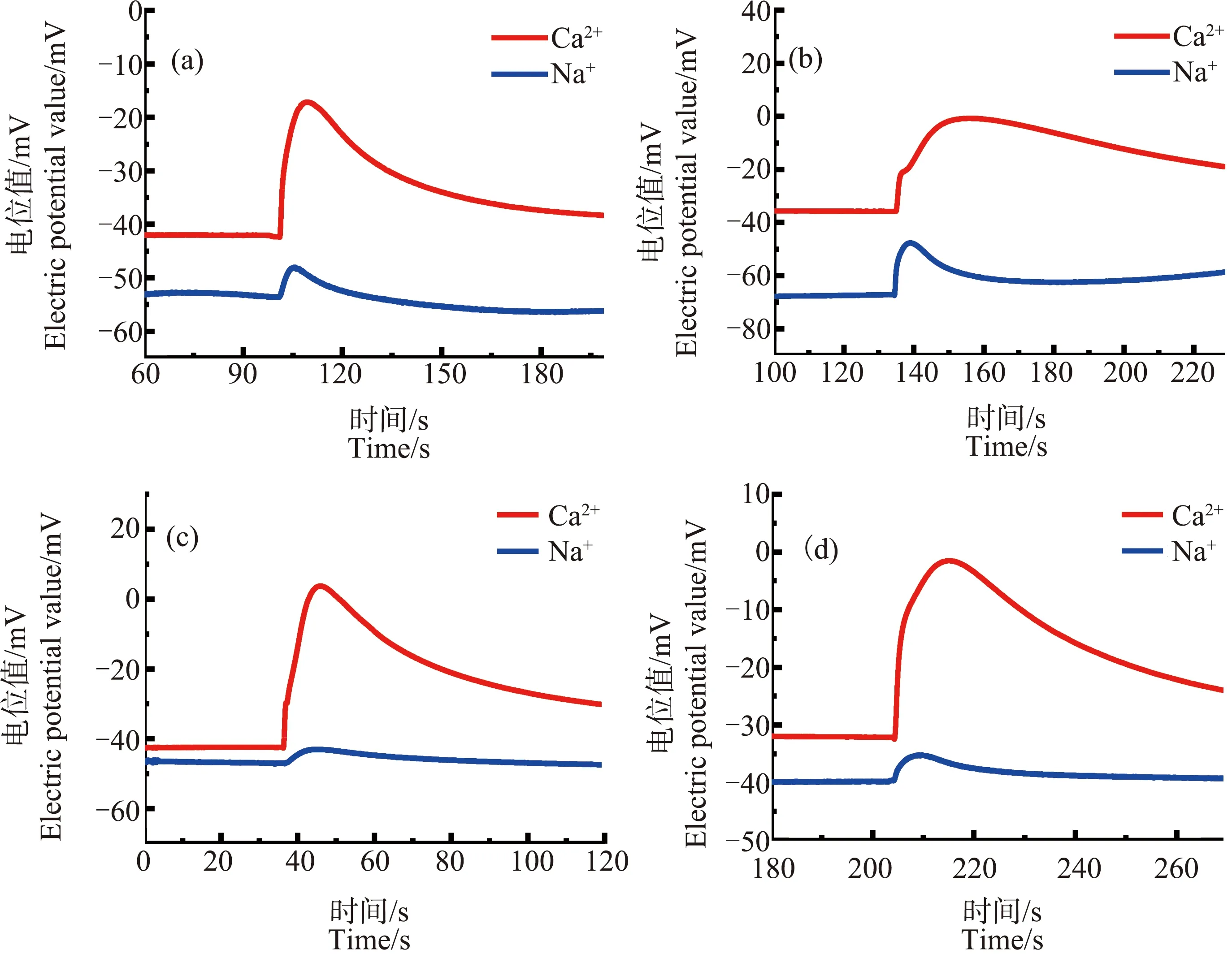
图9 不同浓度ZnO NPs处理18 h后的原生质体破裂时的Ca2+、Na+浓度脉冲图注:(a)~(d)中ZnO NPs浓度分别为30、50、70和90 mg·L-1。Fig. 9 Pulse of Ca2+ and Na+ concentration of Aloe vera protoplasts after 18 h treatment with different concentrations of ZnO NPsNote: (a)~(d), ZnO NPs concentrations were 30, 50, 70, and 90 mg·L-1.
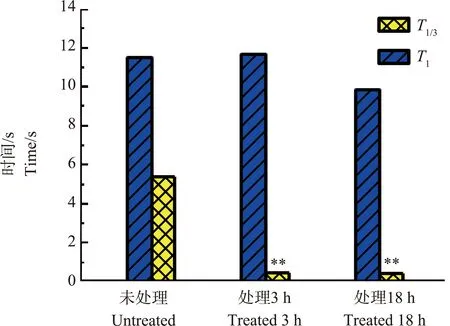
图10 未处理、ZnO NPs处理3和18 h的Ca2+浓度脉冲上升部分时间T1和T1/3Fig. 10 Ca2+ concentration pulse rise time T1 and T1/3 in untreated, treated by ZnO NPs for 3 h and 18 h
综上,使用Ca2+离子选择性微电极检测了经冷冻处理后的芦荟原生质体在低渗液中破裂时产生的Ca2+浓度脉冲信号。研究了冷冻温度、解冻时间和ZnO NPs处理等因素对芦荟原生质体中Ca2+分布的影响。发现芦荟原生质体被冷冻至-7 ℃以下时,其Ca2+脉冲信号前沿处发生明显的“凹陷”,Ca2+分布出现分层现象。靠近细胞中心浓度较高而细胞膜附近浓度较低。这说明,冷冻造成芦荟原生质体中Ca2+的流动性下降,原生质体对Ca2+浓度分布的调控能力降低。这一现象在原生质体解冻5 h后仍未消失。
经过ZnO NPs预处理后再进行冷冻的原生质体,其脉冲凹陷深度明显减小;而当用ZnO NPs对解冻后的原生质体进行后处理时,Ca2+分层现象消失。这可能是由于ZnO NPs处理使得芦荟原生质体中Ca2+分布趋近于细胞膜附近导致的。这表明,尽管ZnO NPs对植物细胞具有一定的毒性,但其在防止冷冻造成的Ca2+流动性下降,维持细胞Ca2+分布的调控能力方面,仍然具有一定的积极作用。
