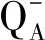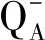四环素对微囊藻生长及光合作用的毒性效应机制
2019-04-17董聪聪张红波杨燕君付君珂刘黎贺新宇施军琼吴忠兴
董聪聪,张红波,杨燕君,付君珂,刘黎,贺新宇,施军琼,吴忠兴
西南大学三峡库区生态环境教育部重点实验室,重庆 400715
四环素类抗生素(TCs)是由放线菌金色链丛菌产生的或半合成的一类广谱抗生素,主要包括四环素(TC)、土霉素(OTC)和金霉素(CTC)等[1-2],它可以与细菌核糖体30s亚基结合,阻止酰胺-tRNA进入A位点,抑制蛋白质合成,影响细菌生长繁殖[3-4]。从20世纪50年代起,四环素类抗生素作为人类常用抗生素用于医疗行业,因其具有广谱抗菌性、价格低廉和使用方便等特点,常作为兽药、饲料添加剂广泛应用于畜牧业和养殖业[5]。四环素类抗生素作为全球第二大生产和使用的抗生素,每年有数千吨在全球范围内生产[6-7]。研究已表明,抗生素在人畜体内不能被完全吸收,有30%~90%以尿液、粪便的形式排出体外;同时,四环素具有良好的水溶性,容易通过地表水进入到湖泊、河流等水环境中[8-9]。Hamscher等[10]检测到在液体粪肥中四环素的含量可达4.0 mg·kg-1;Miao等[11]在对加拿大污水处理情况的长期监测中发现,处理后的污水中仍残留0.15~0.97 μg·L-1的四环素;在中国北方地区13个陆源入海排污口/河流的水样检测中,四环素最高浓度为1.114 μg·L-1 [12];在广州鱼塘水中四环素含量可达5.16 μg·L-1,检出率为28.6%[13];然而,姜蕾等[14]在对长江三角洲地区典型废水的检测中发现,养猪场废水中四环素类抗生素残留浓度为31.02~100.75 μg·L-1。已有研究表明,四环素能够降低水生苦草的叶绿素含量,削弱光合作用,抑制苦草的生长[15]。同样,四环素通过抑制水生动物体内多种酶的活性,对鱼类等造成DNA损伤[16]。因此,四环素类抗生素对水生态系统和人体健康的潜在威胁值得关注。而中国目前对于这一问题的研究尚显不足[17]。
藻类作为初级生产者在水体生态系统的结构和功能中发挥着重要的作用[18]。外源污染物对藻类的毒性作用将直接影响水生食物链的能量传递,进而对高营养级生物和整个水生态系统产生影响[5]。四环素类抗生素对藻类的毒性试验表明,四环素类抗生素能够抑制斜生栅藻和蛋白核小球藻的生长,但由于四环素种类及浓度的差异性,导致其对藻细胞的膜通透性的影响也不尽相同[5]。四环素还能够抑制铜绿微囊藻的光合作用,破坏抗氧化酶系统,抑制藻类生物量增长[19-20]。光合作用可为植物的生命活动提供物质与能量,是植物生长发育的重要保障[21]。然而,以往的研究多集中于四环素类抗生素对藻类的敏感性、生长情况和抗氧化酶系统的影响等方面,而对光合响应及作用机制等方面的研究较少。因此,以水体常见的水华蓝藻——微囊藻(Microcystisaeruginosa)为研究材料,探究不同浓度下四环素对蓝藻的生长、光合系统Ⅱ的影响,旨在探究四环素对微囊藻的毒性效应,为揭示四环素对浮游植物的急性毒性作用和致毒机理提供一定的理论依据;同时,对于全面认识四环素类抗生素对淡水蓝藻的毒性作用、评价该类物质的生态风险具有现实意义。
1 材料与方法(Materials and methods)
1.1 实验材料及培养条件
微囊藻(MicrocystisaeruginosaFACHB-905)由中国科学院水生生物研究所淡水藻种库提供。纯化后的藻种扩大培养至对数期,接种于含四环素(购自aladdin©,分析纯)的MA培养基[22]中,初始接种密度约为1.744×109cells·L-1。结合已有对绿藻和微囊藻的研究[3,5,18]以及预实验结果,设置各处理组中的四环素浓度分别为0.1、0.2、0.5、1.0、2.0和5.0 mg·L-1,以0 mg·L-1作为对照组。每个浓度设置3个重复,培养条件为光强50 μmol photons·m-2·s-1、光照周期12 h L:12 h D、培养温度(25±1) ℃,每天按时摇动3次,并调换各个培养瓶位置,以保证藻细胞和培养液充分接触和受光均匀。
1.2 叶绿素a含量和细胞密度的测定
每天取藻液5 mL用于叶绿素a的测定。叶绿素a的提取参照Nush[23]的方法,用90%的丙酮进行抽提,采用紫外分光光度计(UV-1206,Shimadzu)测定微囊藻在663、645、630和750 nm处的吸光值,Chla(mg·L-1) = [11.64×(D663-D750)-2.16×(D645-D750)+0.10×(D630-D750)]×Vt/(V×δ×1000),Vt为丙酮定容的体积(L),V为提取所用的藻液体积(mL),δ为比色皿光程[24]。已有研究表明,微囊藻不同藻细胞密度与680 nm波长的吸光值呈良好的线性关系[25],由显微镜下计数所得的微囊藻细胞数和微囊藻在680 nm处测得的吸光值计算出微囊藻细胞密度(y,107cells·L-1)与680 nm处吸光值(x)的线性方程为y= 1186.1x-42.236,回归系数R2= 0.9929。每天测定各处理组的OD680值,并根据线性公式计算各处理组的藻细胞密度。比生长速率(μ)根据公式μ= (lnN0-lnN1)/(t1-t0)计算,N0、N1分别表示t1、t0时刻的细胞数。
四环素对微囊藻的半致死浓度(4 d-LC50和7 d-LC50)则采用概率单位法计算[26],由SPSS22.0(IBM, USA)中的“probit”模型计算得出。由第4天和第7天的细胞数分别计算出0.1、0.2、0.5、1、2和5 mg·L-1浓度下的生长抑制率。以“抑制率”作为“响应频率”,“观测值汇总”为“100%”,“对数转换后的四环素浓度”作为“协变量”,然后,通过SPSS22.0中probit模型进行计算,概率为0.5的对应浓度值即为LC50值。
1.3 微囊藻光合系统Ⅱ(PSⅡ)快速光响应曲线(RLCs)和快速叶绿素荧光诱导动力学曲线(OJIP)的测定
RLCs的测定采用PHYTO-PAM浮游植物分析仪(PHYTO-PAM Phytoplankton Analyzer, Walz, Effeltrich, Germany)。测定前,将各处理组藻液暗适应20 min,测定时共设置0、32、64、128、256、384、512、704、960、1216、1 600和1 984 μmol·m-2·s-1共12个水平的光合有效辐射强度,每个光照水平间隔20 s[27]。RLCs曲线的拟合参照Platt等[28]的公式:
rETR = ETRmax·(1-e-aPAR/ETRmax)·e-βPAR/ETRmax
式中:rETR为相对电子传递速率;ETRmax为最大相对电子传递速率;PAR为光合有效辐射强度;α为RLCs曲线的斜率;β为抑制参数。OJIP曲线的测定是通过植物效率分析仪(Handy-Plant Efficiency Analyzer, Hansatech, UK)进行测定。所有样品进行测定前暗适应20 min[29],测定结果以瞬时曲线形式绘制荧光信号,仪器中的JIP-测试(JIP-test)用于对叶绿素a荧光瞬变现象的多相增长进行分析[30],参数以吸收光能为基础的性能指数(PIABS)、用于电子传递的量子产额(φEo)、最大光化学效率(φPo)、用于热耗散的量子比率(φDo)、反应中心捕获的激子中用来推动电子传递链中超过QA的其他电子传递的量子产额(ψo)、单位反应中心捕获的用于电子传递的能量(ETo/RC)、单位反应中心捕获的用于还原QA的能量(TRo/RC)、单位反应中心耗散掉的能量(DIo/RC)、单位受光面积的反应活性中心数量(RC/CSo)、单位反应中心吸收的光能(ABS/RC)和从开始照光至到达FM的时间段内QA被还原的次数(N)从JIP测定中计算获得。
1.4 统计分析
实验中每组处理设置3个平行,实验数据统计分析使用SPSS 22.0(IBM, USA)进行One-way ANOVA及LSD多重比较,拟合曲线用软件Origin 9.0(https://www.originlab.com)进行拟合。“*”表示P<0.05、“**”表示P<0.01,具显著差异。
2 结果(Results)
2.1 叶绿素a含量和比生长速率(μ)
不同浓度四环素处理下,微囊藻叶绿素a含量变化如图1(a)所示,结果表明,1.0、2.0和5.0 mg·L-1四环素处理,微囊藻叶绿素a含量显著低于对照组(P<0.01),而0.1、0.2和0.5 mg·L-1四环素处理下,微囊藻叶绿素a含量与对照组相比无显著差异(P>0.05)。随着四环素浓度的升高,微囊藻的比生长速率显著下降(图1(b)),2.0和5.0 mg·L-1四环素处理7 d后,微囊藻的生长被显著抑制(P<0.01),其比生长速率数值分别为-(0.186±0.057) d-1和-(0.516±0.080) d-1,而0.1、0.2和0.5 mg·L-1处理组与对照相比无显著差异(P>0.05)。四环素处理4 d后,微囊藻半致死浓度4 d-LC50为(0.698±0.037) mg·L-1。第7天时,7 d-LC50为(0.571±0.036) mg·L-1。
2.2 快速光响应曲线(RLCs)
PSⅡ快速光响应曲线结果如图2和表1所示,结果表明,在1.0、2.0和5.0 mg·L-1四环素处理7 d后,微囊藻rETRmax相比于对照组分别降低了44.04%、46.05%和57.52%(P<0.01);光饱和点(IK)与对照组相比分别下降了17.04%、32.18%和33.55%(P<0.01)。光响应曲线的斜率(α)在四环素浓度为5.0 mg·L-1时表现出明显差异(P<0.01,表1)。然而,在0.1、0.2和0.5 mg·L-1四环素处理下,rETRmax、IK和α与对照组相比没有显著差异(P>0.05)。
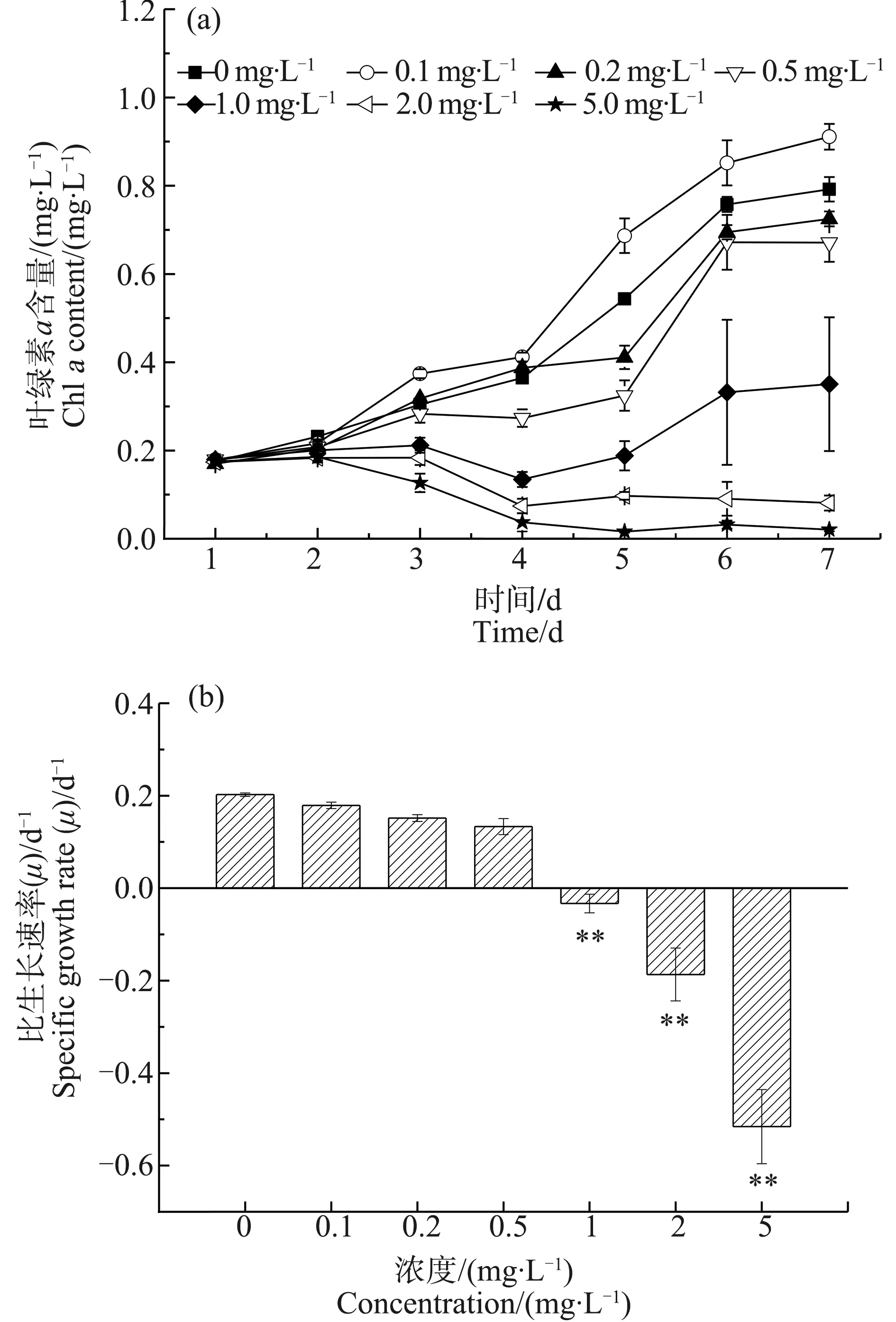
图1 不同浓度四环素处理下微囊藻的叶绿素a含量和比生长速率(μ)Fig. 1 Effect of different concentrations of tetracycline on chlorophyll a content and specific growth rate (μ) in Microcystis aeruginosa
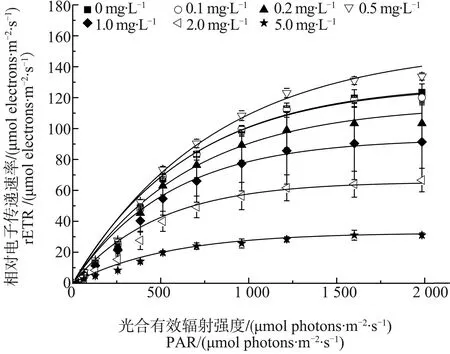
图2 不同浓度四环素处理7 d后微囊藻的快速光响应曲线(RLCs)Fig. 2 Rapid light curves (RLCs) of Microcystis aeruginosa after 7 d-culture at different concentrations of tetracyclineNote: rETR stands for relative electron transfer rate; PAR stands for photosynthetic active radiation.
2.3 PSⅡ快速叶绿素荧光诱导动力学曲线(OJIP)及相关参数
不同四环素浓度对微囊藻OJIP曲线如图3所示,结果表明,在1.0、2.0和5.0 mg·L-1四环素浓度处理下,微囊藻OJIP曲线的J点显著升高,而低浓度处理组的OJIP曲线与对照相比无显著变化。
进一步对JIP测定的叶绿素荧光参数进行分析,结果表明,受四环素的影响,微囊藻RC/CSo显著下降,且随四环素浓度增加逐渐下降(P<0.01,图4(c))。在低浓度处理组(<0.5 mg·L-1),PIABS、φEo和φPo随着处理浓度的增加而升高(图4(a)和图4(c)),然而,高浓度处理组(>1.0 mg·L-1)中,PIABS、φEo和φPo则随着处理浓度的增加显著降低(P<0.05,图4(b)和图4(c))。在1.0、2.0和5.0 mg·L-1处理组中,ABS/RC、DIo/RC、TRo/RC、N和φDo随四环素浓度的增加而显著增大(P<0.01,图4(b)和图4(c)),然而,ETo/RC、ψo却随着四环素的增加显著降低(P<0.01,图4(a)和图4(b))。

表1 不同浓度四环素处理7 d后微囊藻的快速光响应曲线参数Table 1 Parameters of RLCs for responses in Microcystis aeruginosa after 7 d-culture at different concentrations of tetracycline
注: rETRmax表示最大相对电子传递速率,IK表示饱和光强,α表示光合效率。
Note: rETRmaxstands for the maximum relative electron transfer rate;IKstands for the saturation light intensity;αstands for photosynthetic efficiency.
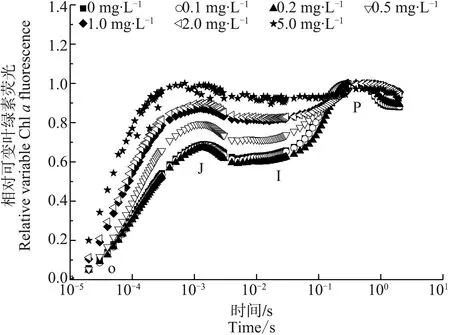
图3 不同浓度四环素处理7 d后微囊藻的快速叶绿素荧光诱导动力学(OJIP)曲线Fig. 3 Fast fluoresence transient curves of Microcystis aeruginosa after 7 d-culture at different concentrations of tetracycline
3 讨论(Discussion)
四环素类药物具有较好的水溶性,容易随雨水冲刷和养殖废水中进入到水环境中。郭晓等[31]在对梅江流域四环素类抗生素空间分布及其迁移转化研究中发现,四环素类抗生素从该流域养猪场逐渐迁移到小溪流,并最终汇入干流,使得四环素类抗生素对河流生态系统构成了一定威胁。研究表明,四环素类抗生素对微藻的毒性主要表现在通过抑制蛋白质合成和叶绿体的生成进而抑制微藻的生长[16]。本研究发现,随着四环素浓度的增大,微囊藻的叶绿素含量和生长受到一定程度的影响。与对照组相比,在1.0、2.0和5.0 mg·L-1高浓度处理组,微囊藻的生长和叶绿素合成均受到抑制(图1)。这与四环素类抗生素土霉素对鞭金藻光合色素含量影响的研究结果一致[32],表明高浓度四环素能抑制微囊藻的生长。然而,周旭东[33]对铜绿微囊藻的研究表明,低浓度(0.1~2 mg·L-1)四环素类抗生素对铜绿微囊藻的生长影响较小,当四环素浓度为0.1 mg·L-1时表现出促进作用。本研究中,0.1 mg·L-1的四环素虽然也促进了微囊藻的生长,但促进作用并不显著。低浓度(<1 mg·L-1)的四环素处理组中,微囊藻的生长和叶绿素含量与对照相比无显著差异(图1),表明微囊藻能够耐受低浓度的四环素。Kühne等[34]在模拟四环素在水中降解实验中发现,在室温、自然光照且通风的情况下,四环素浓度在8 d后下降了约17.9%。因此,推测四环素的降解可能部分稀释了其对微囊藻的毒性,导致微囊藻的生长未受到显著影响。
在徐冬梅等[5]的研究中,四环素对蛋白核小球藻和斜生栅藻培养4 d时的LC50分别为17.780和12.870 mg·L-1,而本研究中微囊藻的4 d-LC50值为0.698 mg·L-1,这表明实验所用的微囊藻对四环素的敏感性要明显高蛋白核小球藻和斜生栅藻。不同藻种对抗生素的敏感性存在一定的差异[35],且微囊藻细胞要小于栅藻、小球藻的细胞,细胞表面积大于栅藻、小球藻等藻类[36],因此,其接触到四环素的面积也较多,可能是导致其敏感性较高的一个原因。
植物体在一定条件胁迫下,其叶绿体的膜结构受到破坏,叶绿素含量将随叶绿体膜结构的解体而降低,进而降低植物的光合能力[37]。rETRmax表示光合效率的大小,被用来描述PSⅡ的最大光化学效率和开放氧化反应中心的所占比例[38]。本次研究得到,在四环素浓度>1.0 mg·L-1时,微囊藻的rETRmax随浓度增加而减小(表1),表明微囊藻的光合作用受到了抑制,开放反应中心的比例降低,这与OJIP参数中RC/CSo的结果相一致。IK的大小表示植物耐受强光的能力[39],本研究发现,当浓度高于0.5 mg·L-1时,微囊藻的IK随浓度增加而减少(表1),表明在高浓度四环素的胁迫下,微囊藻的耐受强光能力减弱。α是快速光曲线的初始斜率,表示藻的捕光能力[40],本研究发现,当浓度为5.0 mg·L-1时,微囊藻的α值显著低于对照(表1),表明微囊藻在高浓度四环素的胁迫下捕光能力减弱。
藻类光合作用的原初反应与叶绿素荧光紧密相关,叶绿素荧光可以反映光合作用中反应中心、供体侧和受体侧所处的氧化还原状态[41-42]。当外界环境条件发生改变时,叶绿素荧光发生相应变化,这可以在一定程度上反映环境因子对植物的影响[43]。在对四环素的研究中发现,对烟草生长发育及光合作用的生态毒性效应呈明显的剂量-效应关系,并且四环素可以促进烟草生育后期光合参数的提高[44]。性能指数PIABS可以衡量PSⅡ的整体性能,能够灵敏地反映光合系统的变化[43]。本研究发现,四环素处理后,微囊藻RC/CSo显著减少(图4(c)),表明四环素使微囊藻部分反应中心(RCs)失活。有研究表明,RCs数量的减少会推动对光能吸收的调节,以保持光合系统中能量的平衡,并且过多的能量会通过热能或荧光的形式耗散掉[45-46],且ABS/RC的升高也与RCs的失活有关[47-48]。在高浓度四环素处理下(>1.0 mg·L-1),微囊藻的ABS/RC、DIo/RC和ψDo显著升高(P<0.05,图4(a)和图4(b)),表明微囊藻反应中心失活程度升高,使得单位反应中心吸收的光能增大,同时耗散掉的能量也增多。然而,PIABS、φPo、φEo和ETo/RC显著低于对照组(图4(a)、图4(b)和图4(c)),表明微囊藻用于电子传递链的量子产额和能量减少,光合作用整体受到抑制[49],这与光响应曲线中高浓度处理组rETRmax和IK显著低于对照组的结果相一致,表明较高浓度四环素对微囊藻造成胁迫,超出了其自身调节限度,显著抑制了微囊藻的光合作用。而在低浓度四环素处理下,微囊藻荧光参数中PIABS和φPo显著升高,ψDo和DIo/RC随四环素浓度增加逐渐降低(图4(a)、图4(b)和图4(c))。以上参数变化表明,在低浓度四环素处理下,微囊藻通过降低反应中的热耗散,增加了用于光合作用的能量配额,提高光合效率以应对四环素胁迫[50]。
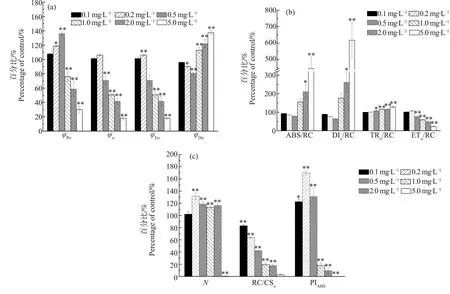
图4 不同浓度四环素处理7 d后微囊藻的快速光响应曲线参数注:φPo表示最大光化学效率,ψo表示反应中心捕获的激子中用来推动电子传递链中超过QA的其他电子传递的量子产额,φEo表示用于电子传递的量子产额,φDo表示用于热耗散的量子比率,ABS/RC表示单位反应中心吸收的光能,DIo/RC表示单位反应中心耗散掉的能量,TRo/RC表示单位反应中心捕获的用于还原QA的能量,ETo/RC表示单位反应中心捕获的用于电子传递的能量,N表示从开始照光至到达FM的时间段内QA被还原的次数,RC/CSo表示单位受光面积的反应活性中心数量,PIABS表示以吸收光能为基础的性能指数。 Fig. 4 Parameters of fast fluoresence transient curves for responses in Microcystis aeruginosa after 7 d-culture at different concentrations of tetracyclineNote: φPo stands for the maximum photochemical efficiency; ψo stands for the quantum yield of the exciton captured by the reaction center to promote other electron transfer in the electron transfer chain that exceeds QA; φEo stands for the quantum yield for electron transfer; φDo stands for the quantum ratio for heat dissipation; ABS/RC stands for the light energy absorbed by the single reaction center; DIo/RC stands for the energy dissipated by the unit reaction center; TRo/RC stands for the energy captured by unit reaction center for reducing QA; ETo/RC stands for the energy captured by unit reaction center for electron transfer; N indicates the number of times that QA is reduced during the period from the beginning of illumination to FM; RC/CSo stands for the number of reaction active centers per unit light receiving area; PIABS stands for the performance index based on absorbed light energy.