SnO2负载TiO2纳米管的制备与光催化活性
2019-04-17王竹梅李月明沈宗洋左建林廖润华
王竹梅,李月明,沈宗洋,左建林,廖润华
(景德镇陶瓷大学材料科学与工程学院,中国轻工业功能陶瓷材料重点实验室,景德镇 333403)
1 引 言
TiO2具有物理化学性质稳定、无毒、光催化活性高、成本低廉等特点,粉末状TiO2在光催化条件下易团聚且不好回收,而采用电化学阳极氧化法在金属钛箔上制得的TiO2纳米管易于回收再利用,且比表面积大、电荷传递快,所以利用TiO2纳米管光催化降解有毒有机污染物被广泛重视[1-2]。TiO2在光的作用下产生光生电子和空穴,此时存在两个竞争反应,一是光生电子和空穴的复合,二是光生电子和空穴转移到催化剂表面,光生空穴可直接氧化有机污染物,光生电子和O2作用,生成O2-·后参与后续的氧化反应[3]。TiO2的光生电子和空穴极容易复合,其复合时间小于10-9s[3],这使得TiO2的光催化活性不高。为了减少光生电子和空穴复合机率,科研人员进行了大量的研究,已见文献报道的方法有非金属离子掺杂[4]、金属离子掺杂[5]、贵金属沉积[6]、半导体或复合氧化物修饰[7-9]等。其中,半导体或复合氧化物由于能带结构与二氧化钛不同,它们与二氧化钛在接触界面形成异质结结构就会产生能带电势差,从而促进光生电子-空穴对的有效分离。其中,SnO2/TiO2异质结光催化剂的开发,成为近年来的研究热点,研究围绕贵金属(Pd、Ag)修饰[10-11]和离子掺杂[12]展开,均在一定程度上增强了光催化性能。
近年来,脉冲电沉积技术常用于金属化合物纳米材料的制备[13],由于脉冲间隔的存在,可改变晶体的生长趋势,从而得到细小的纳米晶粒。本文采用阳极氧化法在钛箔上制得TiO2纳米管阵列,通过脉冲电沉积技术在TiO2纳米管表面沉积SnO2纳米晶粒,系统研究了其微观结构、光吸收特性与紫外光下光催化性能的联系。
2 实 验
2.1 TiO2纳米管的制备
将钛箔(纯度99.5%)裁剪(40 mm×10 mm×0.1 mm)后在超声下分别用丙酮除油和蒸馏水清洗,再化学抛光60 s,抛光液组成为V(HNO3)∶V(HF)∶V(H2O)=4∶ 1∶ 2,蒸馏水冲洗后备用。在磁力搅拌下将钛箔作为阳极插入由乙二醇、H2O和NH4F(摩尔比为190∶ 31∶ 1)组成的电解液中60 V下阳极氧化2 h,插入长度为10 mm,石墨为对电极,两极间距40 mm。得到样品超声下用乙二醇清洗、蒸馏水冲洗、烘干后于500 ℃煅烧3 h,得到未负载TiO2纳米管,记为S-0。
2.2 阴极脉冲沉积法制备SnO2负载TiO2纳米管
以乙醇为溶剂,SnCl2、柠檬酸和硫粉为溶质配制沉积液,其混合沉积液中各溶质的浓度分别为0.05 mol/L、0.15 mol/L、0.05 mol/L。在磁力搅拌下将未煅烧的纯TiO2纳米管作为阴极插入沉积液中、石墨棒为阳极,在两极间施加间歇性电压,“开”电压为2 V,“关”电压为0 V,“开”和“关”的时间均为2.0 s,持续时间为2 min。将沉积后的样品用去离子水冲洗、烘干后在空气中500 ℃煅烧3 h,升温速率为2 ℃/min,得到SnO2负载TiO2纳米管,样品记为S-C-1。其它制备条件相同,仅电解液中不加入硫粉制得样品记为S-C-2,仅SnCl2替换为SnCl4制得样品记为S-C-3。将S-C-1在600 ℃、650 ℃、700 ℃、750 ℃和800 ℃下煅烧3 h升温速率2 ℃/min。
2.3 样品表征与性能测试
分别采用X-ray衍射仪(德国Bruker公司D8-Advance型)和场发射扫描电子显微镜(FE-SEM,日本JEOL公司JSM-6700F型)对样品的晶体结构和形貌进行表征;采用能谱仪(EDS,OXFORD公司INCAX-sight型)测定样品元素及其比例;采用紫外-可见光光度计(美国PerkinLmer公司Lambda850型)对样品进行紫外-可见光相对反射率测试。
光催化活性测试:以甲基橙作为模拟污染物,将pH值为2,含甲基橙(10 mg/L)和Na2SO4(1 mol/L)的混合水溶液作为降解液,取10 mL降解液装入透光性好的约20 mL的小器皿中,暗吸附30 min后,在波长为460 nm处测试降解液的吸光度(A0)。将上述所得SnO2负载TiO2纳米管部分垂直插入降解液中,然后用紫外灯(254 nm)在垂直于样品方向照射1 h后测试降解液的吸光度(At)。计算其降解比例D:D=(1-At/A0)×100%。
3 结果与讨论
3.1 SnO2负载TiO2纳米管的表面形貌及元素分析
图1为未负载TiO2纳米管(S-0)和SnO2负载TiO2纳米管(S-C-1、S-C-2和S-C-3)的SEM图。对比未负载TiO2纳米管,可明显看出SnO2负载TiO2纳米管上有物质沉积;对比S-C-1和S-C-2样品可见,添加硫粉的样品(S-C-1)中沉积物更均匀地、紧密地负载于TiO2纳米管上,由插图可看出沉积物只有少部分覆盖在TiO2纳米管管口,而不添加硫粉的S-C-2样品,一部分纳米管表面没有负载沉积物,一部分纳米管表面被沉积物覆盖且堵塞了纳米管管口,且沉积物与纳米管结合松散;当锡源由SnCl4(S-C-3)代替SnCl2(S-C-1)后,沉积物的形貌变为片状,不均匀地散布于纳米管表面,且从插图可看出,有部分沉积物堵塞纳米管管口,且堵塞面积比锡源为SnCl2时的S-C-2样品大。

图1 样品的SEM图(a)S-0;(b)S-C-1;(c)S-C-2;(d)S-C-3Fig.1 SEM images of the samples(a)S-0;(b)S-C-1;(c)S-C-2;(d)S-C-3
图2为未负载TiO2纳米管和SnO2负载TiO2纳米管的EDS谱线表面元素谱图,检测位置为图1中方框部分,图中插表列出了各样品中各元素的原子数百分含量。由表中数据可见,各SnO2负载TiO2纳米管均检测出Sn元素,其中S-C-2样品含量最高,S-C-3样品含量最低,S-C-1含量为0.45at%,可见,负载量很小。
3.2 SnO2负载TiO2纳米管的XRD分析
图3为各样品(S-0、S-C-1、S-C-2、S-C-3)的XRD图。由图可见,未负载样品可观察到锐钛矿相TiO2(PDF 89-4921)和金属Ti(PDF 88-2321),金属Ti衍射峰来源于钛基底;各SnO2负载TiO2纳米管样品还在2θ为26.58°、33.87°和51.77°处观察到衍射峰,此为四方晶体SnO2的特征衍射峰(PDF 71-0652);对比各负载样品中SnO2晶体在2θ为26.58°衍射峰强度可见,S-C-2样品的SnO2衍射峰最强,说明负载量最多,其次是S-C-1样品,这与EDS检测结果一致;由图3b可以看出,S-C-1和S-C-3样品的锐钛矿相主晶相衍射峰稍稍往左偏移了,且S-C-1样品偏移更大,说明有少量Sn4+进入了TiO2晶格代替了Ti4+,且因Sn4+的离子半径(0.055 nm)比Ti4+(0.042 nm)大,从而使晶格变大造成衍射峰偏移,而S-C-2样品的衍射峰并没有偏移,说明该样品仅负载了SnO2,Sn4+没有掺杂进入晶格;对比锐钛矿相TiO2在25.4°的(101)晶面峰强可见,S-C-1样品该峰增强了很多,S-C-3样品也稍有增强,说明Sn4+掺杂能促进TiO2锐钛矿相的发育,而没有Sn4+掺杂的S-C-2样品该峰反而减弱,这可能是SnO2大量负载在样品表面引起的。
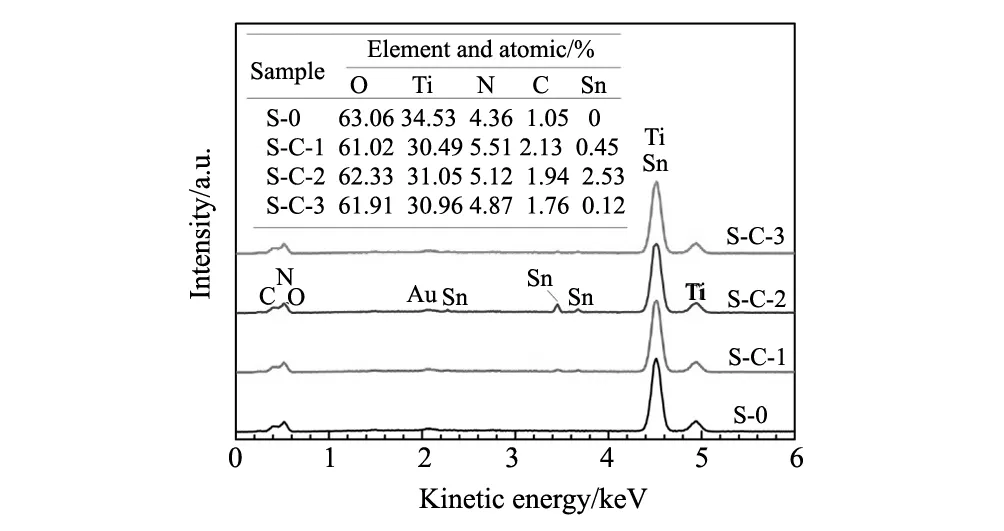
图2 样品的EDS谱线Fig.2 EDS spectra of the samples

图3 样品的XRD图谱Fig.3 XRD patterns of the samples
图4为S-C-1经不同温度煅烧后的XRD图。由图可见,在700 ℃前,随着煅烧温度的升高,锐钛矿相 (101)晶面(25.4°)衍射峰强逐渐升高,说明煅烧温度越高,锐钛矿相结晶度越好;当煅烧温度升至750 ℃时,出现了金红石相衍射峰,锐钛矿相衍射峰变弱,说明有部分锐钛矿相TiO2转化为金红石相TiO2;当煅烧温度升至800 ℃时,金红石相衍射峰更强,锐钛矿相衍射峰更弱。

图4 S-C-1样品在不同温度煅烧后的XRD图谱Fig.4 XRD patterns of S-C-1 samples calcined at different temperatures

图5 S-0、S-C-1样品的Kubelka-Munk转换谱线及UV-vis漫反射图谱Fig.5 Plots of the (F(R)hv)1/2 vs. the energy of absorbed light and UV-vis diffuse reflectance spectra of S-0 and S-C-1 samples
3.3 SnO2负载TiO2纳米管的UV-vis漫反射分析
图5中左上角的插图为未负载纳米管S-0和、SnO2负载纳米管S-C-1的紫外可见漫反射图谱,图5为两样品的反射光谱经由Kubelka-Munk方程转换得到的谱线,图5中右下角的插表给出了由谱线作切线得出的各样品光学带隙值与光吸收阈值。未负载的参比TiO2(S-0)光学带隙值为3.24 eV,SnO2负载后光学带隙值稍有减小,光响应阈值稍有红移,由383 nm红移至388 nm。
3.4 光催化性能及光催化机理分析
图6为紫外光下各样品对甲基橙降解1 h的分解比例。由图可见,S-C-1样品经750 ℃煅烧后光催化活性提高最多,降解率由纯TiO2的32.4%提高至96.5%。这是因为该样品表面SnO2负载均匀,且有少量Sn4+掺杂进入TiO2晶格,同时TiO2主晶相为锐钛矿相,含少量金红石相,从而形成了三元异质结构[9]:锐钛矿相TiO2/金红石相TiO2(A-TiO2/R-TiO2)、锐钛矿相TiO2/SnO2(A-TiO2/SnO2)、金红石相TiO2/SnO2(R-TiO2/SnO2),其光催化机理如图7所示[13]:在A-TiO2和R-TiO2的界面接触处,由于禁带宽度(A-TiO2:3.29 eV,R-TiO2:3.22 eV)存在差别,且导带(CB)位置也不同,A-TiO2为-0.72 eV,R-TiO2为-0.52 eV[14],导致光生电子优先从A-TiO2的 CB转移到R-TiO2的CB,而空穴则从R-TiO2的VB转移到A-TiO2的VB[15],使得更多的光生电子-空穴对分离;另外,SnO2的导带(CB为0.07)位置比A-TiO2和R-TiO2的导带位置均低,在SnO2与A-TiO2或R-TiO2的界面接触处,SnO2的CB捕获来自A-TiO2和R-TiO2的光生电子,光生空穴则由SnO2的VB转移到A-TiO2或经R-TiO2的VB再转移至A-TiO2,亦可使光生电子-空穴对分离。A-TiO2、A-TiO2和SnO2之间两两构成异质结,降低了电子-空穴对复合机率,延长了载流子的寿命,从而使光催化活性大幅提高。
由图6中还可以看出,500 ℃煅烧后各样品对甲基橙的降解率顺序为S-C-1>S-C-3>S-C-2>S-0,可见,A-TiO2/SnO2异质结的形成,大幅提高了TiO2纳米管在紫外光下的光催化活性,虽然S-C-3样品表面的SnO2和S-C-1相较也负载均匀,但负载量太少,而S-C-2样品表面的SnO2负载不均匀,且一部分纳米管管口被堵塞,因而光催化活性均不如S-C-1样品;S-C-1样品在500~650 ℃煅烧温度区间,TiO2为锐钛矿相结构,与SnO2形成了异质结构(A-TiO2/R-TiO2),样品的光催化活性随煅烧温度的升高而增大,这是由于锐钛矿相结晶度随温度的升高越来越好的缘故;S-C-1样品经800 ℃煅烧后,TiO2金红石相增多,锐钛矿相减少,此时为混晶结构,虽然三种异质结构和750 ℃一样也存在,但由于金红石相TiO2主要起传递电子和空穴的过渡作用,电子和空穴主要由锐钛矿相产生,因而光催化活性降低了。

图6 紫外光下各样品对甲基橙的分解比例Fig.6 Rate of decompose of the samples for methyl orange under UV-light

图7 SnO2-TiO2纳米管光催化机理示意图[13]Fig.7 Schematic illustration of the SnO2-TiO2 photocatalysts[13]
图6中的插图为SnO2/TiO2纳米管S-C-1在可见光下降解甲基橙1 h的重复使用曲线,第1、2、3、4、5次的分解比例分别为96.5%、94.2%、90.3%、85.3%和78.2%,说明催化剂有一定的循环使用价值。
4 结 论
(1)当锡源为SnCl2,且脉冲沉积液中含硫粉时,经脉冲沉积、煅烧后,SnO2/TiO2纳米管仍保持纳米管状结构,且Sn大部分以SnO2的形式均匀分散在纳米管表面,少量掺杂进入TiO2晶格;Sn4+掺杂能在煅烧时促进TiO2锐钛矿相的发育,SnO2/TiO2纳米管在700 ℃煅烧后其TiO2相仍保持未掺杂样品的锐钛矿相结构。
(2)SnO2/TiO2纳米管经750 ℃煅烧后主晶相为锐钛矿相TiO2,含少量金红石相TiO2和SnO2,三者两两之间形成异质结,促进光生电子-空穴对的分离,此时SnO2/TiO2纳米管表现出最佳的光催化活性,紫外光下对甲基橙1 h分解比例由32.4%提升至96.5%。
