miR-202通过降低肝癌细胞ROCK1表达抑制其迁移和侵袭
2019-04-17袁琳琳喻晓芬
袁琳琳,喻晓芬
(浙江省人民医院 手术室,浙江 杭州 310014)
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的原发性恶性肿瘤,其症状隐匿,在初次被发现时多处于中晚期,严重威胁患者健康[1]。对于中晚期HCC患者,目前能够显著延长患者总体生存期的靶向治疗药物依然有限,因此这类患者的总体预后依然较差[2]。近年来,微小RNA(microRNA,miRNA)在恶性肿瘤发生发展中的作用逐渐引起重视[3]。miRNA能够结合在下游靶基因的3’端非编码区,导致靶基因mRNA的降解或翻译受阻,从而抑制靶基因的表达,发挥调控肿瘤细胞增殖、运动、耐药性等生物学功能[4]。大量研究表明,多种miRNA在HCC中存在异常表达,并且与HCC患者的临床病理特征及预后具有显著相关性[5]。miR-202近来被发现在多种恶性肿瘤组织中存在异常表达,其在胃癌[6]、骨肉瘤[7]及胰腺癌[8]中存在低表达,能够抑制肿瘤细胞的增殖,从而发挥抑癌作用。有研究表明miR-202在HCC组织中低表达,且能抑制HCC细胞的增殖[9]。然而,miR-202对HCC细胞侵袭转移能力的调控作用目前仍不明确。本研究拟通过Transwell实验和Western blot实验探明miR-202对HCC细胞迁移侵袭能力以及上皮间质转化的影响,并进一步检索生物信息学数据库发现miR-202在HCC细胞中的作用靶点,利用Western blot及荧光素酶实验证实miR-202对下游靶点的调控作用。
1 材料和方法
1.1 材料 肝癌细胞系(Hep3B、Huh7、HCCLM3细胞)及永生化的正常肝细胞LO2购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),并在液氮中长期冻存。本实验所用细胞均利用DMEM培养基进行培养。DMEM培养基、胎牛血清、抗生素购自美国Gibico公司;转染试剂Lipofectamine 2000、荧光定量PCR试剂盒购自美国Invitrogen公司;引物购自上海生工生物工程技术服务有限公司;miR-202模拟物(miR-202 mimic)和miRNA空白对照(miRNA control,miR-control)、miR-202抑制物(miR-202 inhibitor)和miRNA阴性对照(miRNA negative control,miR-NC)、野生型Rho相关卷曲螺旋形成蛋白激酶1(Rho-associated coiled-coil-containing protein kinase 1,ROCK1)3’-UTR质粒和突变型ROCK13’-UTR质粒购自广州市锐博生物科技有限公司;Transwell孔板购自美国Corning公司;兔抗GAPDH抗体、兔抗E-cadherin抗体、鼠抗N-cadherin抗体、鼠抗ROCK1抗体购自美国Cell Signaling公司;HRP标记的山羊抗鼠/兔二抗购自北京兰博利德公司。
1.2 方法
1.2.1 细胞复苏、培养及转染:提取冻存于液氮的HCC细胞系及LO2细胞,置于37 ℃水浴箱快速解冻后,加入5 mL无血清DMEM培养基,1000 r/min离心5 min后,弃去上清,利用10 mL含有10% FBS的DMEM培养基重悬后,接种于细胞培养皿,置于37 ℃恒温细胞培养箱中培养,隔日更换细胞培养基,每日观察细胞生长状况。当细胞融合度达50%~70%时,根据Lippofectamine2000试剂盒说明书将miR-202 mimic、miR-control、miR-202 inhibitor及miR-NC终浓度调整为5 mmol/L后,加入6孔板细胞中,培养24 h后,更换为含10% FBS的DMEM培养基,48 h后,qRT-PCR检测转染效果,并将细胞用于后续实验。
1.2.2 Transwell实验:将HCCLM3细胞分为HCCLM3空白对照组和miR-202过表达组,将Hep3B细胞分为Hep3B阴性对照组和miR-202敲低组。胰酶消化上述细胞后,利用无血清DMEM培养基重悬细胞,并将细胞密度调整至1×106/mL备用。向Transwell孔板(24孔)的实验孔中加入700 μL含有10% FBS的DMEM培养基;向Transwell小室中加入200 μL上述备用细胞悬液,并将盛有细胞悬液的Transwell小室置于含有培养基的实验孔中;将上述Transwell孔板置于细胞培养箱中培养24 h;取出Transwell小室,PBS清洗后,利用棉签擦去小室薄膜上层细胞后,结晶紫染色薄膜下层细胞后,置于显微镜下计数拍照。对于侵袭能力检测,在向Transwell小室接种细胞悬液前,在每个小室膜上滴加70 μL利用DMEM稀释的基质胶,待基质胶固化后再接种细胞,其余步骤同上。
1.2.3 实时定量PCR:使用Trizol提取细胞内RNA,利用反转录试剂盒将RNA反转录成cDNA。利用荧光定量PCR试剂盒检测细胞内miR-202及ROCK1 mNRA的表达;分别用U6和GAPDH作为miR-202及ROCK1的内参,引物序列见表1。

表1 实时定量PCR引物序列
1.2.4 Western blot检测细胞内ROCK1及GAPDH蛋白的表达:使用RIPA裂解液提取细胞内的蛋白,细胞充分裂解后,14000 r/min离心15 min后,去蛋白上清,利用BCA试剂盒测定蛋白浓度;SDS-PAGE胶的上样孔中每孔加入50 μg蛋白样品,电泳分离蛋白后,采用半干转膜系统,20 V转膜1 h,5%脱脂奶粉室温封闭1 h后,分别加入ROCK1抗体(1∶1000)和GAPDH抗体(1∶1000),4 ℃冰箱孵育过夜后,TBST缓冲液漂洗3次,每次5 min,分别加入山羊抗兔或鼠IgG二抗(1∶5000),室温孵育1 h TBST缓冲液漂洗3次,每次5 min。暗室中,在膜上滴加ECL发光液显影。
1.2.5 荧光素酶报告基因实验:将Hep3B细胞分为如下8组:miR-control与野生型ROCK13’-UTR质粒共转染组,miR-202 mimic与野生型ROCK13’-UTR质粒共转染组,miR-NC与野生型ROCK13’-UTR质粒共转染组,miR-202 inhibitor与野生型ROCK13’-UTR质粒共转染组,miR-control与突变型ROCK13’-UTR质粒共转染组,miR-202 mimic与突变型ROCK13’-UTR质粒共转染组,miR-NC与突变型ROCK13’-UTR质粒共转染组,miR-202 inhibitor与突变型ROCK13’-UTR质粒共转染组。共转染完成后48 h收集细胞。按双荧光素酶活性检测试剂盒说明书操作,用荧光检测仪检测荧光素酶活性。
1.3 统计学处理方法 利用GraphPad Prism软件进行数据分析。计量资料以±s表示,2组比较采用t检验,多组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 miR-202在肝癌细胞系中低表达 与永生化的正常肝细胞LO2相比,3种肝癌细胞Hep3B、Huh7、HCCLM3细胞中miR-202的表达水平均显著降低,差异有统计学意义(P<0.05),见图1。在3种HCC细胞中,miR-202在Hep3B中的表达水平最高,而在HCCLM3细胞中的表达水平最低。因此,本研究选择Hep3B细胞进行miR-202的敲低实验,选择HCCLM3细胞进行miR-202的过表达实验。
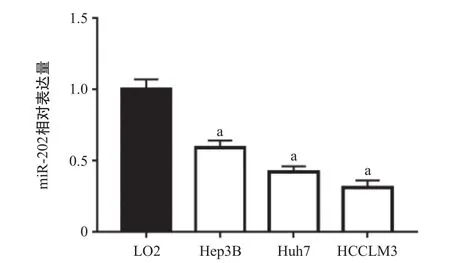
图1 miR-202在3种肝癌细胞及正常肝细胞LO2中的表达
2.2 HCCLM3细胞中过表达miR-202 与miR-control组比,转染miR-202 mimic可显著增加HCCLM3细胞中的miR-202表达水平,差异有统计学意义(1.00±0.05 vs. 8.99±1.25,P<0.01)。
2.3 过表达miR-202降低HCCLM3细胞的迁移和侵袭能力 Transwell迁移实验结果显示:过表达miR-202后,HCCLM3的迁移能力显著降低(P<0.05);侵袭实验结果显示:过表达miR-202后,HCCLM3的侵袭能力显著降低(P<0.05)。见图2。
2.4 Hep3B细胞中敲低miR-202 与miR-NC组相比,转染miR-202 inhibitor可显著降低Hep3B细胞中的miR-202表达水平,差异有统计学意义(1.00±0.06 vs.0.12±0.02,P<0.01)。
2.5 敲低miR-202增强Hep3B细胞的迁移和侵袭能力 Transwell迁移实验结果显示:敲低miR-202后,Hep3B细胞的迁移能力显著降低(P<0.05);侵袭实验结果显示:敲低miR-202后,Hep3B细胞的侵袭能力显著降低(P<0.05)。见图3。
2.6 生物信息学网站预测和荧光素酶报告基因实验验证miR-202靶基因为ROCK1 通过miRNA靶基因预测网站TargetScan,miR-202可能的靶基因为ROCK1。miR-202与ROCK1的3’-UTR间存在互补配对序列(见图4A)。进一步的荧光素酶报告基因实验结果显示,过表达miR-202后,野生型ROCK13’-UTR组细胞荧光素酶活性显著降低(P<0.05);敲低miR-202后,野生型ROCK13’-UTR组细胞荧光素酶活性显著增加(P<0.05);过表达或敲低miR-202对突变型ROCK13’-UTR组细胞荧光素酶活性没有显著影响。见图4B。

图3 敲低miR-202增强Hep3B细胞的迁移(A)及侵袭(B)能力

图4 生物信息学网站预测及miR-202调控ROCK13’-UTR的荧光素酶活性
2.7 过表达miR-202后HCCLM3细胞ROCK1表达降低 实时定量PCR检测结果显示,miR-202 mimic组HCCLM3细胞中ROCK1 mRNA水平较miR-control组降低,差异有统计学意义(P<0.05),见图5A;Western blot结果表明,过表达miR-202后HCCLM3细胞中ROCK1蛋白表达水平显著降低,差异有统计学意义(P<0.05),见图5B。
2.8 敲低miR-202后HCCLM3细胞ROCK1表达增加实时定量PCR检测结果显示,miR-202 inhibitor组Hep3B细胞中ROCK1 mRNA水平较miR-NC组明显升高,差异有统计学意义(P<0.05),见图6A;Western blot结果表明,过表达miR-202后HCCLM3细胞中ROCK1蛋白表达水平显著增加,差异有统计学意义(P<0.05),见图6B。
3 讨论
miRNA在肝癌发生发展中的作用近年来逐渐引起关注[10]。多种miRNA,如miR-7[11]、miR-92a[12]及miR-122[13]等被发现在肝癌组织中存在异常表达,且与肝癌患者的临床病理特征及预后具有显著相关性。因此,miRNA已被作为肝癌患者诊断及预后评估的潜在生物学标志物,并有望成为肝癌治疗的新靶点。miR-202是近来被发现的在多种肿瘤中存在异常表达的miRNA。研究数据显示:miR-202在胃癌[6]、骨肉瘤[7]及胰腺癌[8]中存在低表达,能够抑制肿瘤细胞的生长及转移,发挥抑癌作用。然而,miR-202对肝癌细胞的影响,尤其是迁移和侵袭能力的影响,目前仍不明确。

图5 实时定量PCR(A)和Western blot(B)检测过表达miR-202对ROCK1表达的影响

图6 实时定量PCR(A)和Western blot(B)检测敲低miR-202对ROCK1表达的影响
基于上述研究背景,本研究利用qRT-PCR、Western blot、Transwell实验以及荧光素酶报告基因等分子生物学技术手段探明miR-202对肝癌细胞迁移及侵袭能力的影响及可能分子机制。本研究结果表明:miR-202通过抑制肝癌细胞的侵袭能力,在肝癌病情进展中发挥抑癌作用。本研究进一步通过对生物信息学网站TargetScan检索发现,ROCK1基因的3’-UTR含有与miR-202的互补配对序列,可能是miR-202的靶基因。进一步利用荧光素酶实验证实miR-202能够与ROCK13’-UTR结合,表明ROCK1是miR-202的靶基因。qRT-PCR及Western blot实验表明:miR-202能够抑制细胞ROCK1的表达。值得关注的是:骨肉瘤中的研究显示Gli2蛋白是miR-202的靶基因[7];而在胰腺癌中的研究发现,miR-202可调控细胞内Mxd1和Sin3A的表达[8]。这些研究结果表明:miR-202在不同的肿瘤中具有不同的下游靶点。miR-202在肝癌中是否具有其他的下游作用靶点仍需进一步研究。
本研究所发现的miR-202的下游靶基因即ROCK1基因,是ROCK家族的一员,在多种肿瘤中高表达,并对肿瘤细胞的运动能力具有直接调控作用[14]。乳腺癌中的研究表明:miR-340通过抑制ROCK1的表达,发挥对乳腺癌细胞转移能力的抑制作用[15]。膀胱癌中的研究表明:miR-1280通过抑制ROCK1的表达,发挥对膀胱癌细胞转移能力的抑制作用[16]。上述既往研究结果表明:ROCK1是多种miRNA的下游靶点。
综上所述,miR-202在肝癌细胞中呈显著低表达,能够抑制肝癌细胞的侵袭和转移能力;miR-202能够与ROCK13’-UTR结合,抑制肝癌细胞内ROCK1的表达。因此,miR-202可能通过抑制ROCK1的表达发挥对肝癌细胞迁移和侵袭的抑制作用。miR-202有望成为肝癌诊断及预后评估的新生物学标志物,可能成为肝癌治疗的新靶点。
