继代培养时间对抗性黑松体胚发生的影响
2019-04-16王艳丽孙婷玉沈李元吴小芹叶建仁朱丽华
王艳丽 孙婷玉 沈李元 吴小芹 叶建仁 朱丽华
( 南京林业大学南方林业协同创新中心,林学院,江苏 南京 210037)
松材线虫病是由松材线虫(Bursaphelenchus xylophilus)引起的一种毁灭性森林病害,主要危害松属植物,对森林资源和生态环境造成了严重的威胁,大量研究表明,松材线虫病抗性选育已成为防御松材线虫病危害的重要途径[1]。日本松材线虫病抗性育种工作较为先进,先后2次对感病黑松(Pinus thunbergii)和赤松(Pinus densiflora)开展了抗性选育工作,最终筛选出了多个黑松、赤松抗性家系并建立抗病种子园[2]。江苏省有害生物预防与控制重点实验室于2004年从日本引进一批抗性种子材料,并建立了抗松材线虫病黑松、赤松优良家系基因资源库,但种质资源有限,远不能满足林业大规模生产的需要。因此建立优良无性系黑松的快繁体系具有重要意义。另外李清清等[3]已对抗松材线虫病赤松组培苗进行了抗病性测定,抗性家系表现出一定的抗病性,朱丽华等也报道了赤松的微繁殖及其对线虫的抗性[4]。
目前,抗性黑松体细胞胚胎发生及植株再生体系虽已经建立[5],但抗性黑松胚性愈伤组织诱导率较低,最高仅为7.8%[6],所以胚性愈伤弥足珍贵,胚性愈伤组织保持十分重要。植物组织培养过程中,继代培养是其中重要的环节,而长期继代则是种质资源离体保存的必要手段[7]。已有研究发现,植物细胞在离体培养时,再生频率和再生植株的质量与培养时间密切相关[8]。随着继代次数的增加很多植物愈伤组织的分化率会呈下降趋势[9],如梨 S 系矮化砧 (Picea wilsonii)[10]、叶毛枣(Ziziphsu mauritiana)[11]、杉木(Cunninghamia lanceolata)[12]、球根海棠(Begonia tuberhybrida)[13]以及一些落叶松属的树种[14-15]。也有研究表明,胚性愈伤组织的体胚发生能力是可以长期保持的,如白杄(Picea meyeri)的胚性愈伤组织继代培养3 a其增殖能力和分化潜力仍保持在原来的水平,无明显降低趋势[16];青杄(Picea wilsonii)愈伤组织在适宜的继代条件下,培养3 a继代40次体细胞胚的分化率仍可达90%以上[17];此外,棉花(Gossypiumspp.)、玉米(Zea mays)等的胚性愈伤组织体胚发生能力也是能够长期保持的[18-20]。在长期继代中愈伤组织是否会保持一定的体胚发生和植株再生能力,这关系到组培快繁技术的实用化问题。国内外文献虽见对黑松组培技术的相关研究,但有关黑松愈伤组织在长期继代中分化能力的研究却很少。因此,通过对抗性黑松胚性愈伤组织体胚发生及植株再生能力进行了研究,以培养0.5、1.5、3.5 a的胚性愈伤组织为材料,从细胞形态、愈伤组织增殖率、每克胚性愈伤形成的体胚数、以及获得体胚的正常萌发率和植株成活率等方面,具体评估继代培养时间对愈伤组织再生分化的影响,以期为抗性黑松体胚发生快繁体系中筛选出最佳的培养材料,提高组培苗的生产效率。
1 材料与方法
1.1 材料
黑松未成熟球果采集于抗松材线虫病黑松优良家系基因资源库(本课题组于2004年从日本良种繁育中心引进抗性种子材料建立[21]),当年从球果中剥离出未成熟合子胚并诱导出具有胚性的愈伤组织,愈伤组织的诱导方法见文献[5-6]。诱导的抗性黑松37#家系胚性愈伤组织在DCR+2,4-D 0.5 mg/L+KT 0.1 mg/L和DCR+NAA 0.5 mg/L+6-BA 0.5 mg/L 2种增殖培养基交替培养,培养时间分别为0.5 a(继代12次)、1.5 a(继代36次)和3.5 a(继代84次)。愈伤组织采用半固体增殖的培养方式,培养周期为15 d。
1.2 培养基
增殖培养基采用DCR基本培养基[22],添加麦芽糖15 g/L、肌醇1 g/L、谷氨酰胺0.5 g/L、酸水解干酪素0.5 g/L、维生素C 0.5 mg/L、2-(N-吗啡啉)乙磺酸0.25 g/L、琼脂(Agar)5.4 g/L。
成熟培养基采用LP为基本培养基[23],添加脱落酸(ABA)10 mg/L、赤霉素(GA3)0.5 mg/L、麦芽糖30 g/L、肌醇1 g/L、谷氨酰胺1.5 g/L、聚乙二醇(PEG 8000)130 g/L、活性炭(AC)1.5 g/L、植物凝胶(Phytagel)3.4 g/L。
萌发培养基采用1/2 LP,添加麦芽糖20 g/L、活性炭(AC)1 g/L、琼脂(Agar)8 g/L。
诱导生根培养基采用WPM基本培养基[24],添加0.15 mg/L NAA、1 mg/L IBA、1 g/L活性炭和琼脂5.4 g/L。
生长培养基采用1/4 WPM基本培养基(大量元素减少),添加硝酸铵5 mg/L、硼酸0.15 mg/L、蔗糖17.5 g/L、肌醇0.1 g/L、卡拉胶9 g/L。
所有培养基在灭菌前pH调至5.8,121 ℃高压灭菌20 min。
1.3 实验方法
1.3.1 细胞形态观察
取少量抗性黑松愈伤组织置于载玻片上,滴1滴清水,用镊子打散,采用醋酸洋红和伊文思蓝双染色法染色(先用1%醋酸洋红染色,后滴加0.05%伊文思蓝),加盖玻片吸去多余染液,然后将临时装片置于蔡司体式显微镜下观察愈伤组织的细胞结构。
1.3.2 指标测定
增殖率:称取一定量抗性黑松胚性愈伤组织(M1),在DCR半固体增殖培养基上生长15 d,称取愈伤组织质量(M2),愈伤组织增殖率=(M2-M1)/M1×100%。
每克胚性愈伤组织发育形成成熟体细胞胚数量:将一定量的增殖愈伤转入LP成熟培养基,2个月后统计形成的体胚数。以每克愈伤组织形成的成熟胚数量作为衡量细胞产胚能力的主要参数。每克愈伤组织形成成熟胚数量的测定:称取一定量愈伤组织放入成熟培养基,2个月后统计每培养皿成熟培养基的体胚数。每培养皿3团胚性愈伤组织,每团1 g,3个重复。每克胚性愈伤组织形成的成熟体细胞胚数量=愈伤组织出胚数(个)/愈伤组织质量(m)。在此期间,记录愈伤组织形成成熟体细胞胚的时间。
体胚萌发率、畸形率、死亡率:将成熟培养基所得的成熟体细胞胚水平放置1/2 LP萌发培养基上,每皿15个胚,3个重复,非直射光照培养5 d,再转直射光照培养25 d后统计体胚的萌发情况。萌发率(%)=萌发正常体胚个数/接种体细胞胚个数×100%;畸形率(%)=畸形体胚个数/接种体细胞胚个数×100%;死亡率(%)=死亡体胚个数/接种体细胞胚个数×100%。
植株成活率:将正常萌发的植株转入诱导生根培养基中,生长1个月后形成根、茎、叶完整的再生植株。再将植株转入加WPM营养液,V(蛭石)∶V(珍珠岩)为2∶1的基质中。2个月后统计植株成活率。每个处理15棵植株,3个重复。植株成活率=成活株数/接种株数×100%。
1.3.3 培养条件及数据处理
培养温度设定为(23±1)℃,光照强度为3000 lx,愈伤组织诱导、增殖和成熟阶段均为暗培养方式,萌发及生根壮苗阶段采用光培养方式(光照16 h,黑暗8 h)。数据采用Excel处理,用SPSS19.0软件进行方差分析和差异显著性检验。
2 结果与分析
2.1 继代培养时间对愈伤组织形态的影响
在继代培养过程中,肉眼可见细胞团结构逐渐疏松。显微观察发现,培养0.5、1.5 a和3.5 a的细胞团均具有胚性胚柄细胞团(ESM)结构(图1)。继代培养0.5 a的胚性愈伤组织形态一致性较好,胚柄纤长,染成红色的胚头部分(染色体或染色质)在整个结构中所占面积较大,细胞核物质丰富,细胞排列紧密(图1a)。继代培养1.5 a的胚性愈伤组织细胞结构,长型的胚柄细胞结构明显增长,胚头部分减少,细胞排列紧密(图1b)。培养3.5 a的胚性愈伤组织细胞胚头结构比培养0.5 a和1.5 a的细胞胚头结构松散,胚头结构明显减少,胚柄细胞缩短变粗,细胞结构一致性差,出现细胞形态紊乱的现象。另外在培养3.5 a的胚性愈伤组织中,我们还发现不少无胚头结构的空泡细胞(图1c)。
2.2 继代培养时间对愈伤组织增殖的影响
由图2可知,继代培养0.5 a和1.5 a的胚性愈伤组织的增殖率分别为200.37%和182.47%,增值率下降不显著(P>0.05)。而继代3.5 a的胚性愈伤组织虽然仍有一定的增殖能力,但是胚性愈伤组织增殖率(111.63%)较培养0.5 a和1.5 a的胚性愈伤组织显著下降(P<0.05)。由此可知,随着培养时间的增长,胚性愈伤组织的增殖能力呈下降趋势。培养1.5 a以内的胚性愈伤组织较适于继代增殖培养。
2.3 继代培养时间对愈伤组织体细胞胚成熟的影响
2.3.1 愈伤组织体胚分化至各阶段的时间差异
将继代培养0.5、1.5、3.5 a的愈伤组织在DCR增殖培养基上继代1个周期(15 d)后,选取生长状态较好的愈伤(图3a)转至成熟培养基中,于蔡司体式显微镜下观察发现,愈伤慢慢开始聚拢,逐渐干燥,愈伤表面抽出的丝状结构慢慢增粗(图3b)。一段时间后,愈伤组织表面出现肉眼可见的柱状胚伸出,至柱状胚早期阶段(图3c)。之后,柱状胚逐渐伸长、增粗、颜色白或黄,至柱状胚阶段(图3d)。柱状胚顶端清晰可见子叶形状至子叶胚前期阶段(图3e)。子叶胚颜色(颜色白或黄)加深,子叶伸长,收拢或张开,形状基本保持不变,形成成熟子叶胚(子叶胚阶段)(图3f)。

图1 抗性黑松不同培养时间胚性愈伤组织的形态观察Fig. 1 Morphology of embryogenic callus with subculture times of nematode-resistant P. thunbergii

图2 不同继代培养时间愈伤组织的增值率Fig. 2 Proliferation rate of callus vary with subculture time
观察愈伤组织体胚分化成熟过程发现,不同继代培养时间的愈伤组织分化至体胚各阶段的时间存在差异(表1)。培养0.5 a的胚性愈伤组织在18 d观察到肉眼可见的柱状胚前期阶段,而培养1.5 a和3.5 a的胚性愈伤组织分别在21 d 和25 d观察到该现象。在随后的发育过程中,培养0.5 a的胚性愈伤组织达到柱状胚阶段、子叶胚前期阶段和子叶胚阶段分别用了26、32、46 d;而1.5 a的胚性愈伤组织分别用了30、40、63 d;3.5 a的胚性愈伤组织发育更为缓慢,达到柱状胚阶段、子叶胚前期阶段和子叶胚阶段分别用了38、55、74 d,培养时间越长体胚成熟所需时间越长,体胚发育能力越弱。因此认为,随着培养时间的延长,胚性愈伤组织细胞在逐渐老化,以致于不同培养时间的愈伤组织形成体胚的时间不一致。

图3 抗性黑松体细胞胚成熟观察Fig. 3 Developmental stages of somatic embryo of nematode-resistant P. thunbergii
2.3.2 培养时间对胚性愈伤组织产胚数量的影响
每克愈伤形成的体胚数量统计结果见图4。
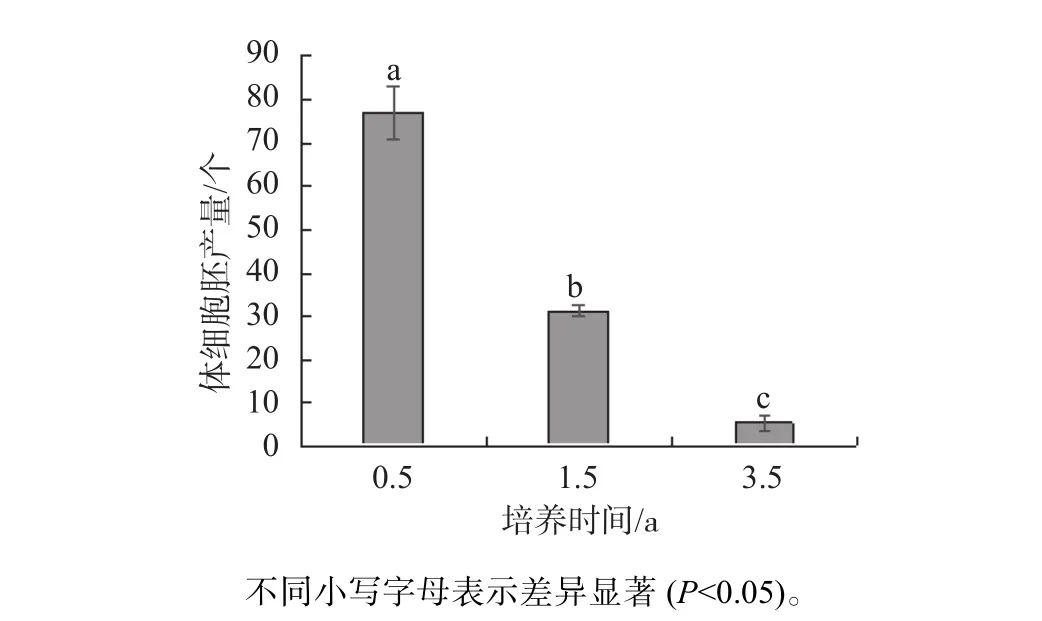
图4 每克愈伤形成的体胚数量Fig. 4 Somatic embryos yiels of per gram callus
由图4可知,不同培养时间的胚性愈伤组织体胚分化能力差异显著,培养0.5 a胚性愈伤组织每克可生产77个体细胞胚;而培养1.5 a每克可生产31个体细胞胚;培养3.5 a每克可生产5个体细胞胚。培养1.5 a的胚性愈伤组织产胚能力较培养0.5 a的胚性愈伤组织显著(P<0.05)下降;培养3.5 a的胚性愈伤组织产胚能力较培养0.5 a和1.5 a的胚性愈伤组织均显著(P<0.05)下降。因此,认为短期(0.5 a)培养的胚性愈伤组织较1.5 a和3.5 a培养时间的胚性愈伤组织更容易诱导产生体细胞胚,但随着培养时间的延长,胚性细胞的分化能力会降低。
2.4 继代培养时间对体胚萌发与再生植株成活的影响
培养时间对体胚萌发及生长的影响结果见图5,体胚萌发及植株生长发育情况见图6。培养0.5 a的胚性愈伤组织的体胚萌发率为84.5%,再生植株的成活率为73.3%;而培养1.5 a和3.5 a的胚性愈伤组织的萌发率分别为51.1%和11.1%,再生植株的成活率分别为50.0%和6.7%。培养3.5 a的胚性愈伤组织的萌发率和植株成活率较培养1.5 a的胚性愈伤组织显著(P<0.05)下降;并且培养1.5 a的胚性愈伤组织的萌发率和植株成活率较培养0.5 a的胚性愈伤组织也呈显著(P<0.05)下降趋势。但是,研究发现随着培养时间的增长,畸形率和死亡率呈上升趋势。培养0.5 a的胚性愈伤组织的畸形率为8.9%,死亡率为6.9%;而培养1.5 a和3.5 a的胚性愈伤组织的畸形率分别为26.7%和37.8%,死亡率分别为22.3%和40.0%。研究显示体细胞胚的萌发和再生植株成活率随培养时间的增长呈显著下降,而萌发的畸形率与死亡率随培养时间的增长则呈显著上升趋势。

图5 培养时间对体胚萌发及生长的影响Fig. 5 The effects of sub-culture time on germination and growth of regenerated plant

图6 抗性黑松体胚萌发及植株的生长发育Fig. 6 Somatic embryo germination and plant growth of somatic embryos of nematode-resistant P. thunbergii
3 结论与讨论
目前,许多学者对松树的组织培养进行了相关研究,也取得了一定进展。2015—2017年,本实验室先后报道了抗性黑松[5-6]、抗性赤松的体胚发生[21,25],但至今抗性黑松的体胚发生仍存在一些问题,如胚性愈伤组织的诱导率较低,获得胚性愈伤组织材料极为有限,所以胚性愈伤组织的保持与维持就显得极为重要。
先前的研究发现:在胚性胚柄细胞团(ESM)结构中,胚柄是由胚头基部的分生组织细胞分裂、分化而成的,它对胚头可提供结构上的支持和吸收营养物质的作用,也是合成生长调节物质和储存一些产物的场所[26]。然而在长期的继代培养过程中,发现愈伤组织的胚头结构会减少,胚柄细胞也出现缩短增粗的现象。胚性愈伤组织形态结构的变化很可能会导致愈伤胚性能力的退化。这与都小龙等对吉粳88愈伤组织细胞形态结构发生变化的研究中报道相似[27]。
胚性愈伤组织是由胚柄和大量胚性细胞团以及原胚组成的,所以本身就具有一定的分裂能力,可以保持一定的增殖能力。但是研究中发现抗性黑松胚性愈伤组织增殖率随着培养时间的增长而降低,这可能与显微观察发现胚头减少,胚性细胞与原胚团降低有关。在对白云杉(Picea glauca)、黑云杉(Picea mariana)[28-29]、青杄[17]及思茅松(Pinus kesiyavar.langbianensis)[30]的研究中,也观察到了相似的现象。因此认为在胚性细胞的增殖培养时间不宜过长,最好不要超过1.5 a。且在增殖过程中,要及时将细胞形态一致性较好的胚性愈伤组织保存。
在培养时间对体胚产量的研究中发现培养0.5 a的愈伤组织产胚能力较强,每克可生产77个体细胞胚,而培养3.5 a的愈伤仅为5个。随着培养时间的增长,每克愈伤产胚数量呈显著(P<0.05)下降趋势。另外,培养0.5 a的胚性愈伤组织形成子叶胚的时间为46 d,培养1.5 a胚性愈伤组织需要63 d,而培养3.5 a的胚性愈伤组织需要74 d,培养0.5 a的胚性愈伤组织形成子叶胚的时间要比培养3.5 a的胚性愈伤组织缩短28 d,培养时间越长体胚成熟过程越慢。这可能与胚性愈伤组织形态紊乱,胚头比例下降,胚性逐渐丧失有关。在对杉木(Cunninghamia lanceolata)、海棠(Malusspp.)以及毛叶枣(Ziziphsu mauritiana)的研究中也有发现胚性愈伤组织在长期继代过程中会出现形态发生能力丧失的现象[9-15]。研究证实了在松属树种中这个现象仍然存在。另外,研究发现培养时间对体胚萌发和再生植株的成活也具有非常大的影响。培养1.5 a的胚性愈伤组织的萌发率(51.1%)和植株成活率(50.0%)较培养0.5 a的胚性愈伤组织的萌发率(84.5%)和植株成活率(73.3%)显著下降;培养3.5 a的胚性愈伤组织的萌发率(11.1%)和植株成活率(6.7%)较培养1.5 a的胚性愈伤组织也呈显著下降趋势。而随着培养时间的增长,萌发的畸形率和死亡率则由8.9%和6.9%上升到37.8%和40.0%(图5)。体胚的萌发和再生植株成活率都随着培养时间的延长显著下降,而萌发的畸形率与死亡率与培养时间则呈显著上升趋势。这与薛美凤等对棉花胚性愈伤组织长期继代的结果相一致[8]。
因此,随着继代培养时间的增长,胚性愈伤组织的增殖能力、产胚能力以及体胚萌发和再生植株成活能力均下降,而萌发的畸形率和死亡率在逐渐增加。因此,在抗性黑松体胚发生过程中要及时对培养的胚性愈伤组织进行更新换代,以保持体胚发生良好的原始材料;在胚性愈伤组织培养过程中要对胚性细胞形态进行及时的跟踪观察,确保细胞的形态维持良好;短期培养的胚性愈伤组织(0.5 a)为抗性黑松体胚发生较为理想的初始材料,且愈伤组织继代培养时间不宜超过1.5 a。
