不同盐胁迫条件下东方杉的生长及生理响应研究
2019-04-16马晓华宫莉霞张旭乐项德强
孔 强 马晓华 宫莉霞 张旭乐 项德强 郑 坚
( 1. 乐清市林业局,浙江 温州 325600;2. 浙江省亚热带作物研究所,浙江 温州 325005)
东方杉(Taxodium mucronatum×Cryptomeria fortunei)为杉科落羽杉属,半常绿的高大乔木,是1963年我国著名林木育种家叶培忠教授将中国柳杉和墨西哥落羽杉进行跨属杂交育成的杉科新树种[1]。东方杉树形优美,适应性十分广泛,其具有生长迅速、耐盐碱和耐水湿能力强等特点,且具有较强的抗风能力[2],因此东方杉近年在沿海防护林和生态公益林的建设中逐步受到青睐。
有研究表明,沿海地带土壤主要表现为盐碱含量高、表层板结、海水倒灌反盐,十分不利于植物的生长发育[3]。目前,我国拥有大面积的盐碱地,仅海岸带、滩涂地等就达670多万hm2,且有逐年递增的趋势[4]。在我国人口不断增加,耕地面积日趋紧张和淡水资源不断减少的严峻形势下,盐碱地的开发利用已是国内外生物学者迫切需要解决的研究课题。在盐碱地土壤对植物的危害中通常认为在无机盐对植物生长的危害是最显著的,大部分植物或农作物都对NaCl极为敏感,即使是在低盐度条件下的 50 mmol/L NaCl对于具有一定耐盐能力的水稻(Oryza sativa)也具有致死作用[5]。本研究对2年生东方杉盐胁迫试验,测定和分析其在盐胁迫环境下的各项形态及生理指标,以期探讨盐胁迫条件下东方杉的生长及生理变化,为开发及选育耐盐性强的植物资源提供依据。
1 材料与方法
1.1 试验材料
2015 年4 月,于浙江温州(119°37′~121°18′E;27°06′~28°36′N)智能温室进行东方杉耐盐性试验,选用健壮且长势一致(苗高为(62±0.5)cm,地径为(68±0.5)mm)的2年生东方杉,在光强为1000 μmol /(m2·s), 温度为 28 ℃/25 ℃(昼/夜),光周期为12 h,湿度为(70 ± 5)%的条件下进行水培试验研究。营养液配比按照霍格兰营养液作一定调整后配制。营养液配方如下:Ca(NO3)2·4H2O 2.00 mmol/L,KH2PO40.10 mmol /L,MgSO4·7H2O 0.50 mmol /L,KCl 0.10 mmol/L,K2SO40.70 mmol/L,H3BO310.00 μmol/L,MnSO4·H2O 0.50 μmol/L,ZnSO4·7H2O 1.00 μmol/L,CuSO4·5H2O 0.20 μmol/L,(NH4)6Mo7O240.01 μmol/L,Fe-EDTA 100 μmol /L。
1.2 试验方法
东方杉植株适应生长2个月后,开始进行不同浓度的盐处理。选用容积为10 L的塑料桶,每桶1株,培养液体积为7.5 L。试验设置0‰(CK)、3‰(T1)、6‰(T2)3个盐胁迫浓度,每个浓度重复5次。在处理前后的培养过程中每天用pH计测定营养液pH值,隔天用 1 mol/L H3PO4或 1 mol/L KOH调节pH,保持营养液pH为5.8;保持24 h连续通气,每8 d换1次营养液。分别于处理后的第 10、20、30、40 和 50天上午 7:00—8:00采取每株叶位相近的当年生叶片,用封口袋装并做好标记后置于冰盒中迅速带回实验室,用液氮冷冻后于-80℃冰箱保存,用于测定其各项生理和生化指标。
1.3 测定方法
1.3.1 生长指标测定
分别在试验处理第10、20、30、40、50天时用钢直尺(精度0.1 mm)测量各处理东方杉的固定枝长长度,按公式(1)计算东方杉固定枝条相对生长长度,即生长增量。
相对生长长度=试验测量时长度-试验处理前长度(1)
1.3.2 生理指标的测定
分别于试验处理第10、20、30、40、50天采集0.2 g胁迫后的东方杉叶片,采用茚三酮比色法[6]用UV-2550分光光度计(岛津公司,日本)测定叶片内的脯氨酸含量;根据Armon[7]的方法,于663 nm和645 nm测定叶绿素含量;采用NBT比色法[8]测定超氧化物歧化酶(SOD)活性;参照Buege等[9]的方法用硫代巴比妥酸法测定丙二醛(MDA)含量;采用电导法[10]测定相对电导率(REC)。
1.4 分析方法
所有数据采用SPSS 16.0进行统计分析,用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 盐迫条件下植物存苗率及叶色变化
盐胁迫对东方杉存苗率和叶形态的影响结果见表1。

表1 盐胁迫对东方杉存苗率和叶形态的影响Table 1 Effects of salt cooperative force on the rate and form of T. mucronatum×C. fortunei seedlings
由表1可知,盐胁迫50 d后,不同盐胁迫存苗率的处理间差异达显著水平(P<0.05),T1的存苗率与CK无显著差异,T2的存苗率显著地低于CK与T1(P<0.05)。东方杉在T1胁迫下处理50 d后的叶色叶形表现生长,与CK无显著差异;在T2胁迫下处理50 d后,叶色出现变黄的现象。
2.2 盐胁迫条件下植东方杉固定枝条相对生长长度变化
由图1可知,不同盐浓度处理条件下的东方杉生长速度不同,在盐胁迫处理的前期,T1枝条的生长未受到显著抑制,而在胁迫理至50 d时,相比CK,T1枝条的生长出现缓慢减弱的现象。而T2枝条从第20天开始呈现出显著地生长抑制现象(P<0.05);胁迫至第50天时,T2胁迫下东方杉枝条生长是CK的18.1%。

图1 不同盐胁迫下东方杉的相对生长长度变化Fig. 1 Changes of relative growth length of T. mucronatum×C. fortunei under different salt stress conditions
2.3 盐胁迫条件下东方杉叶片中叶绿素含量变化
由图2可知,在试验胁迫的前40 d,T1新叶中的叶绿素含量与CK相比未出现显著差异;在胁迫第50天时,T1叶片叶绿素含量显著低于CK(P<0.05),是CK的88.9%。而在T2胁迫下,20 d后其叶绿素含量显著低于CK和T1(P<0.05),随着处理时间的增加;在胁迫至第50天时,T2新叶叶绿素含量是CK的37.6%。
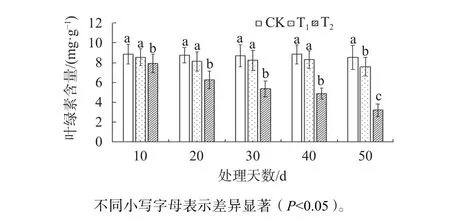
图2 不同盐胁迫下东方杉叶绿素含量变化Fig. 2 Changes of chlorophyll content of T. mucronatum×C. fortunei under different salt stress conditions
2.4 盐胁迫条件下东方杉叶片MDA含量与REC的变化
由图3可知,T2胁迫下MDA含量随着处理时间的增加而增加,且显著高于CK和T1(P<0.05),在胁迫至第50天时,分别是CK和T1的3.49和2.60倍。试验40 d前,T1的MDA含量与CK无显著差异;在第50天时,T1的MDA含量显著高于 CK(P<0.05),是 CK的 1.34倍。在 T2下,东方杉REC值显著高于CK与T1(P<0.05),在试验至第50天时,分别是CK和T1的1.97和1.51倍。试验40 d前,T1的REC与CK差异不显著;在第50天时,T1的REC显著高于CK(P<0.05),是CK的1.30倍。
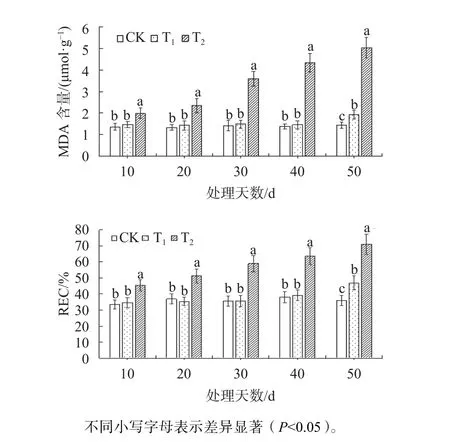
图3 不同盐胁迫下东方杉MDA含量与REC变化Fig. 3 Changes of MDA content and REC of T. mucronatum×C. fortunei under different salt stress conditions
2.5 盐胁迫条件下东方杉叶片中脯氨酸含量的变化
如图4可知,T1和T2的脯氨酸含量在第20天时显著高于CK(P<0.05);在胁迫30 d后,T1胁迫的脯氨酸含量有所下降,但仍显著高于CK(P<0.05),而T2的脯氨酸含量继续增加,显著高于CK与T1的脯氨酸含量(P<0.05),是CK的2.12倍;在胁迫50 d后,T1的脯氨酸含量仍显著高于CK(P<0.05),T2的脯氨酸含量为CK的2.70倍。
2.6 盐胁迫条件下东方杉叶片SOD活性的变化
由图5可知,随着处理时间的增加,T1和T2的SOD活性均显著高于CK(P<0.05)。在胁迫至第40天时,T2的SOD活性达到最高值,分别是CK与T1的1.34与1.25倍;在胁迫至第50天时,T2的SOD活性下降。
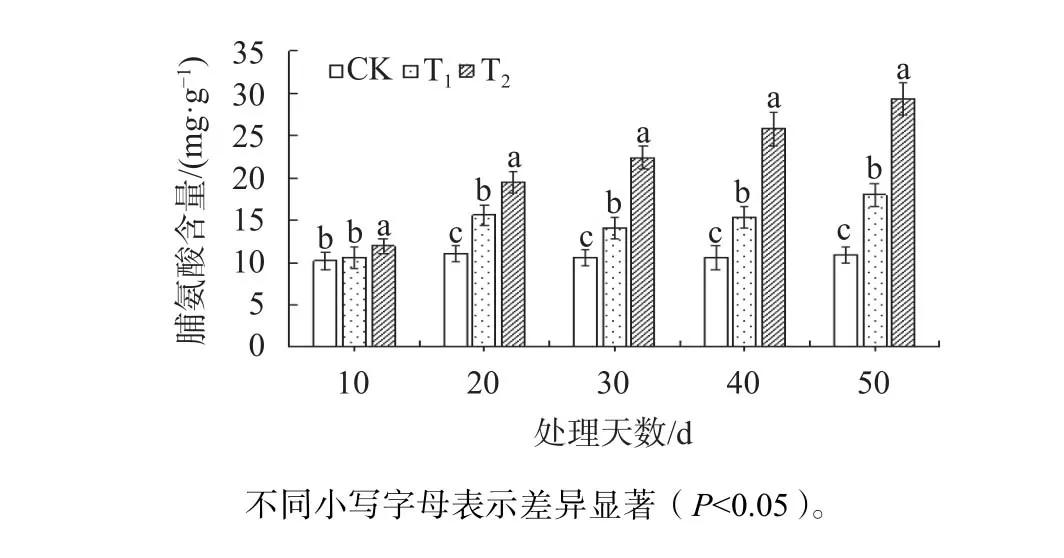
图4 不同盐胁迫下东方杉脯氨酸含量变化Fig. 4 Changes of proline content of T. mucronatum×C. fortunei under different salt stress conditions
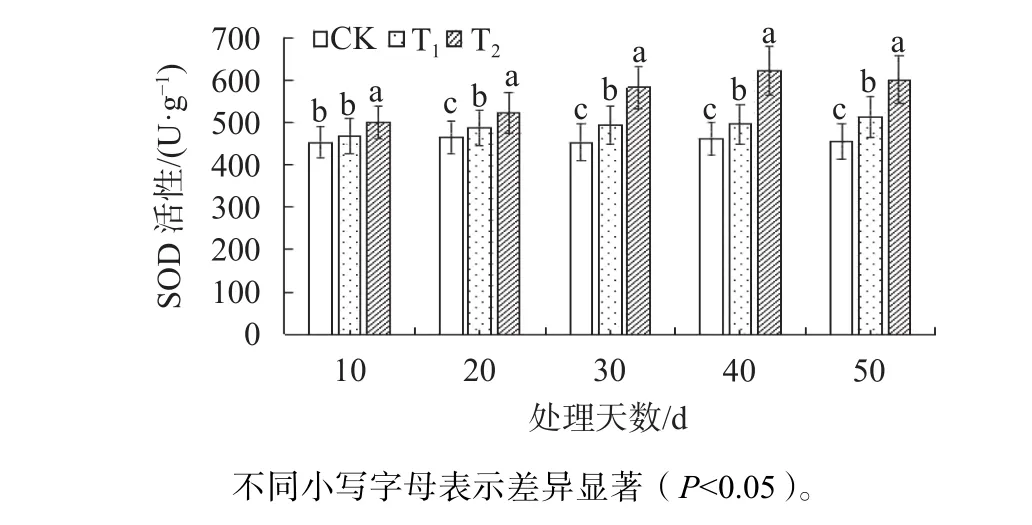
图5 不同盐胁迫条件下东方杉SOD活性变化Fig. 5 Changes of SOD activity of T. mucronatum×C. fortunei under different salt stress conditions
3 结论与讨论
盐胁迫是限制植物生长发育的主要环境因素之一。高盐度对植物的毒害可以导致植物生长缓慢、产量降低甚至植株死亡[11]。在盐胁迫条件下,植物体内的主要生理生化过程, 如水分吸收、光合作用、能量和物质代谢等均会受到不同程度的抑制。总体来说,盐胁迫主要通过细胞膜渗透胁迫、离子毒害及营养失衡等对植物进行生长抑制。本研究发现,在T2盐胁迫条件下,东方杉的枝条生长量减少,生长受到显著抑制,而在较低的盐浓度(T1)条件下,东方杉的枝条增量与对照组差异不显著。这表明东方杉枝条在高浓度的盐胁迫条件下,植物体为维持渗透压的稳定,加剧了渗透调节物质的合成和积累,这就导致了植物体内的能量消耗增加,进一步限制了植物的生长[12]。
叶绿素是与植物光合作用相关的最重要的色素,盐胁迫可能破坏植物叶片内的叶绿体功能结构,从而使叶绿素合成减少,含量降低下降,最终导致植株光合力减弱[13]。低浓度的盐胁迫可以刺激植物体内的保护机制,促使叶绿素含量增加[14]。本研究发现,低浓度盐胁迫处理初期,东方杉叶片内的叶绿素含量与CK差异不显著,而随着处理时间的增加,T1盐胁迫条件下的东方杉叶片叶绿素含量略微下降;而T2盐胁迫条件下的东方杉叶绿素含量一直显著低于CK,表明盐胁迫处理损害了东方杉的叶绿素合成路径或合成器官,致使其叶片内的叶绿素合成受阻,叶绿素含量降低[15]。
细胞膜是盐胁迫对植物造成伤害的原初位点,尤其是质膜,质膜在受到盐胁迫伤害后会发生一系列的胁变,它的透性、渗透调节等功能都会因受到伤害而发生变化[16]。MDA是植物体内膜脂过氧化的最终产物,也是膜系统受伤害程度的重要标志之一,REC是反映细胞膜渗透率的重要指标。本研究发现,在低浓度的盐胁迫条件下,东方杉体内的MDA含量和REC与CK差异不显著,这表明东方杉作为耐盐性较强的植物之一,在较低的盐胁迫条件下,其细胞膜并未受到明显伤害,但盐胁迫时间的延长,细胞膜亦出现了轻微损伤。而T2对东方杉植株产生了显著伤害,其MDA含量和REC相比CK显著增加。这与钱琼秋等[17]的研究相似,表明不同浓度的盐胁迫和不同的处理时间可对植物细胞膜造成不同程度的伤害。
许多研究表明,植物在盐胁迫下其渗透保护物质含量会增加,如茉莉酸、脯氨酸等[18]。本研究发现,东方杉在盐处理下叶片中脯氨酸含量显著高于CK,表明在东方杉体内脯氨酸可作为渗透调节物及膜和酶的保护物质对其起保护作用。在逆境胁迫条件下,SOD作为植物抗氧化保护酶系统重要的组成成分之一。它的变化可以反映细胞清除活性氧的能力,它可以能直接清除H2O2和O2.-,减少活性氧积累对植物造成的伤害[19],本研究发现盐胁迫处理条件下的东方杉其SOD活性显著高于CK。这表明盐胁迫导致了东方杉体内活性氧含量的增加,而东方杉启用自身保护机制通过增强SOD活性来清除活性氧,维持体内活性氧的动态平衡。本研究对东方杉在盐胁迫下枝条增量、生理生化等分析比较,发现东方杉在3‰的盐度生境下均能较好生长,只随着处理时间的增加而出现生长略微受到抑制的现象,而在6‰的盐度下其生长明显受到抑制,直到植株死亡。
