宫颈癌外照射Pinnacle与Monaco系统容积调强物理方案的比较分析及方案质量评估模型的创建*
2019-04-15柏晗吴星娆陈飞虎刘旭红鄢佳文
柏晗,吴星娆,陈飞虎,刘旭红,鄢佳文
650118昆明,云南省肿瘤医院·昆明医科大学第三附属医院·云南省癌症中心
最新《Lancet》[1]上的数据显示2010~2014年我国大陆女性宫颈癌的5年生存率为67.6%,虽较10年前上升了14.3%(2000~2004年这一数据为53.3%),但仍处于全球的平均水平。目前用于宫颈癌治疗的主要手段仍然是手术、放疗和化疗。2017年NCCN指南指出,对于肿瘤直径>4cm的IB2、ⅡA2期患者和出现宫旁受累的ⅡB期及以上患者以同步放化疗作为首选治疗;对于IA、IB1、ⅡA1期患者同步放化疗亦能取得与手术相似的效果。可见,放疗在宫颈癌的治疗中占有十分重要的地位。
放疗外照射物理方案质量决定着放疗的疗效和毒副反应的程度[2-6],不同的物理方案设计系统(TPS)因采用不同的方案优化算法和剂量计算方法(例如筒串卷积算法和蒙特卡罗算法)会在同一病种中表现出明显的剂量学差别,有研究表明对于肺癌的VMAT计划,Pinnacle在肺的保护方面有明显的优势,而Monaco的优势表现在靶区剂量分布和心脏的保护上[7];对于乳腺癌的VMAT计划,Pinnacle的靶区剂量均匀性略有优势,Monaco在OAR的保护上更有优势[8]。但是基于这2种计划系统在宫颈癌计划设计方面的研究鲜见报道。因此本文拟采用传统的物理方案质量评估方法对Pinnacle与Monaco系统中宫颈癌外照射容积调强的物理方案进行比较和分析,并在此基础上尝试建立新的有效的物理方案质量评估模型,以弥补传统评估物理方案质量方法的不足。
1 患者资料收集
1.1 患者资料
宫颈癌患者12例为研究对象。患者的年龄35~61岁,中位年龄48岁;患者均未接受过手术,无放疗禁忌症,行根治性放疗。腹盆腔内阳性淋巴结(GTVnd)外扩0.5cm后形成计划靶区(PGTVnd),给治疗剂量62.5Gy/25F;CTV前后左右外放0.5cm,上下(头脚)外放0.8cm得到计划靶区PTV,给预防剂量45Gy/25F。
1.2 数据采集
患者均采用仰卧位,热塑网膜固定,在自由呼吸状态下应用德国Siemens公司的Sensation Open 24 CT模拟定位机扫描定位,扫描范围从横膈顶至耻骨联合下缘1cm, 重建3cm层厚,经局域网传至Pinnacle 9.10三维放疗计划系统工作站。
1.3 靶区和危及器官定义
由患者的放疗主管医生根据ICRU 52、62号报告定义放疗靶区,GTVnd包括下腹部和盆腔内阳性淋巴结;CTV上界至腹主动脉分叉处,约L4~L5间隙,下界至闭孔下缘,左右界包括双侧髂总,髂内外血管周围、闭孔淋巴区。定义的危及器官主要包括:直肠、膀胱、小肠和股骨头。
2 方 法
2.1 Pinnacle TPS设计方案辅助器官的生成
(1)在PTV内,将PGTVnd外扩0.1cm,生成PGTVnd+0.1cm; (2) 在PTV内,将PGTVnd外扩0.5cm,生成PGTVnd+0.5cm; (3)在Skin内,将PGTVnd外扩0.7cm,生成PGTVnd+0.7cm; (4)PTV+( PGTVnd+0.7cm ),生成PTV’; (5)(PGTVnd+0.5cm )-( PGTVnd+0.1cm );生成M59.37; (6)PTV- (PGTVnd+0.5cm ),生成M50。在优化物理方案时对“M59.37”和“M50”进行合适的剂量约束。
2.2 pV-Plan,mV-Plan两种物理方案的设计
采用6MV-X射线,容积旋转照射方式,(逆时针)弧度范围为175°至185°,双弧,机架在每段弧上取90个控制点,剂量计算网格(grid)取4mm,MLC的运动速度上限设定为0.46cm/deg。2种物理方案的目标函数,如表1所示。
2.3 f(EUD)模型和f(TCP~NTCP)模型
Qi等[9]在尝试用EUD模型优化物理方案中危及器官和靶区剂量时,创建了一个以EUD为自变量的函数f(EUD)对整个物理方案进行综合评估。结果显示,f(EUD)能有效地对头部、头颈部、肺、胰腺和前列腺肿瘤的物理方案作出正确的综合评估。
(1)

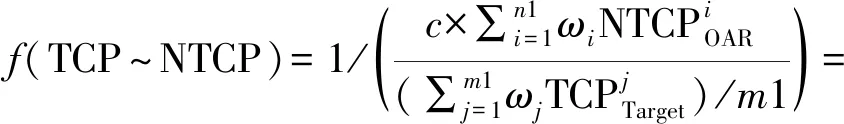
(2)
其中,n1,m1分别指危及器官和靶区的个数;wi,wj分别是的权重,文中取wi=1,wj=1;m,n分别是危及器官特有的常数,其对应取值见参考文献[10]。TD50是危及器官并发症概率为50%时可接受的均匀剂量,TCD50是靶区的控制概率为50%时需要的均匀剂量,对于PGTVnd,TCD50=51.24Gy,γ50=0.83;对于PTV-PGTVnd(指在PTV内扣除PGTVnd的“环形”部分),TCD50=36.5Gy,γ50=0.72[11];在计算PGTVnd和PTV的EUD时,a=-10。取c=10,以保证f(TCP~NTCP)的值在合适的范围,便于后续的比较和分析。
2.4 统计参数及分析方法
(1)采用传统的评估指标,Vx、MeanDose和MaxDose等比较pV-Plan和mV-Plan物理方案,并采用SPSS 20.0进行统计分析;(2)采用f(EUD)模型和f(TCP~NTCP)模型评估pV-Plan和mV-Plan物理方案,并将2者的评估结果进行比较。
3 结 果
3.1 pV-Plan与mV-Plan物理方案中靶区的比较结果
如表2所示,就PGTVnd的适形指数CI而言,pV-Plan优于mV-Plan,差异有统计学意义(P<0.05);但就PTV的CI而言,mV-Plan优于pV-Plan,差异也有统计学意义(P<0.05)。2种物理方案中,PTV的均匀性指数HI非常相近,差异不具有统计学意义(P>0.05)。
表12种TPS优化物理方案所采用目标函数的对照表
Table1.ObjectiveFunctionsUsedinTwoTPSOptimizedPhysicalSchemes
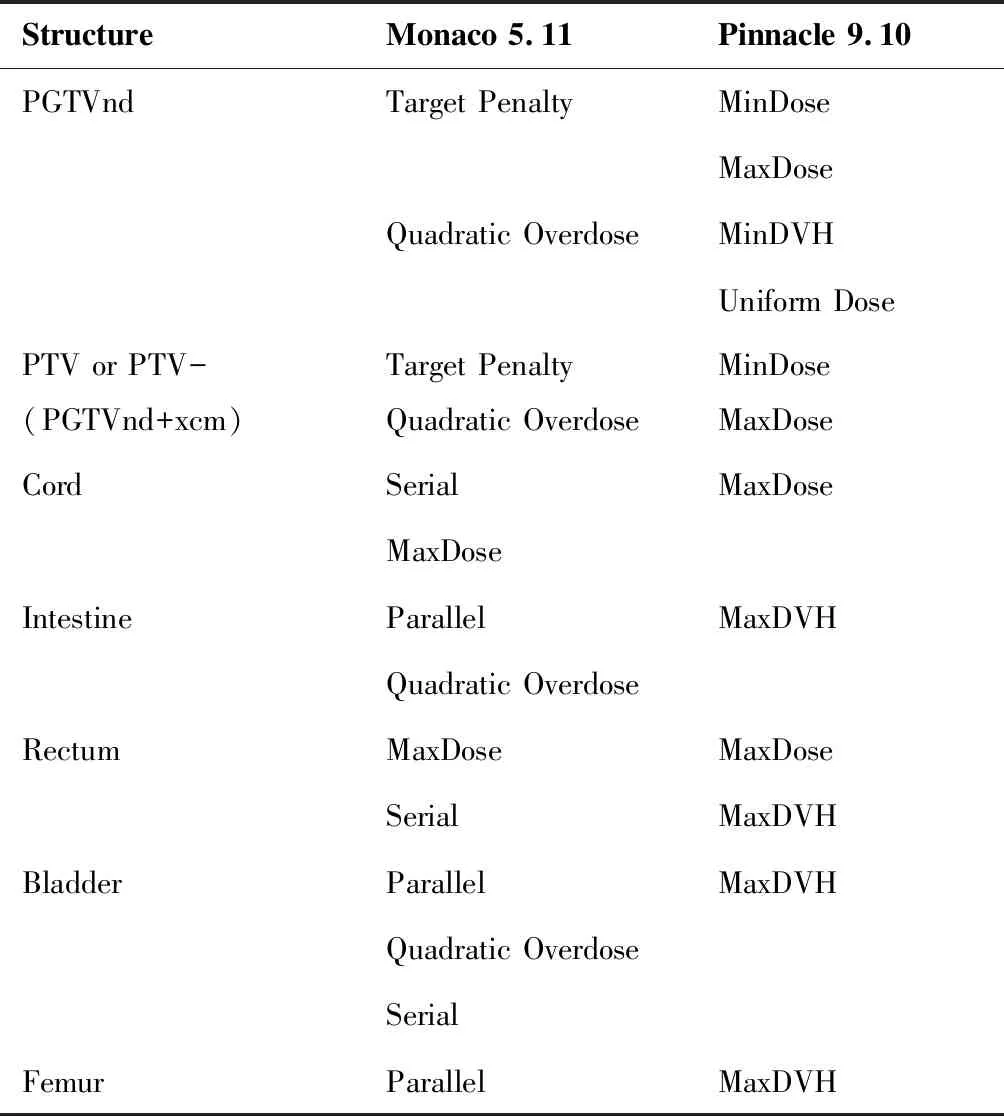
StructureMonaco 5.11Pinnacle 9.10PGTVndTarget PenaltyMinDoseMaxDoseQuadratic OverdoseMinDVHUniform DosePTV or PTV-(PGTVnd+xcm)Target PenaltyQuadratic OverdoseMinDoseMaxDoseCordSerialMaxDoseMaxDoseIntestineParallelMaxDVHQuadratic OverdoseRectumMaxDoseMaxDoseSerialMaxDVHBladderParallelMaxDVHQuadratic OverdoseSerialFemurParallelMaxDVH
3.2 OARs的比较结果
如表3所示,在比较2种物理方案在损伤危及器官时,主要比较了脊髓、小肠、直肠、膀胱和股骨头等5个主要的危及器官及与其放射并发症密切相关的剂量参数。pV-Plan在直肠的V20、V30,膀胱的V30、V40和小肠的V20,V30等剂量参数上优于mV-Plan;而在其它的剂量参数上mV-Plan又优于pV-Plan。其中差异有统计学意义(P<0.05)的剂量参数有:直肠的V20和平均剂量,膀胱的V30、V40和平均剂量,小肠的V10、V30,股骨头的V20、V30和V40。
表2pV-Plan与mV-Plan物理方案中靶区的CI和HI对照表
Table2.CIandHIofTargetsinpV-PlanandmV-Plan
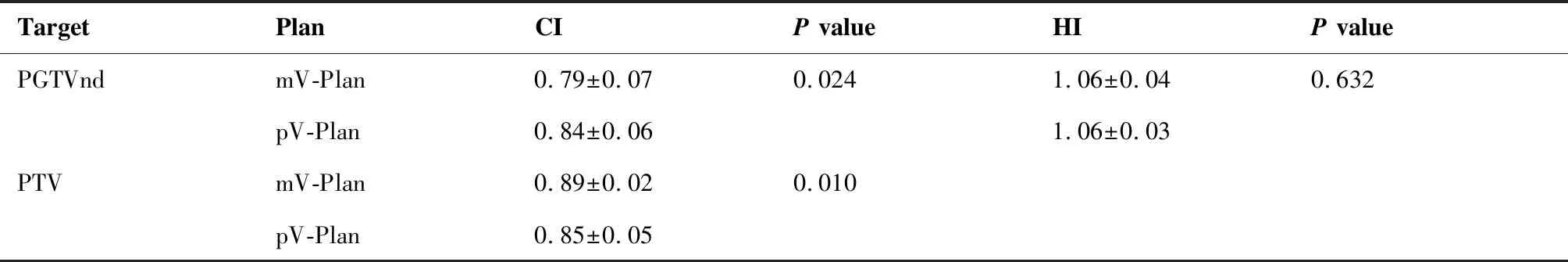
TargetPlanCIP valueHIP valuePGTVndmV-Plan0.79±0.070.0241.06±0.040.632pV-Plan0.84±0.061.06±0.03PTVmV-Plan0.89±0.020.010pV-Plan0.85±0.05
3.3 分别采用f(EUD)、f(TCP~NTCP)比较物理方案
采用f(TCP~NTCP)评估pV-Plan和mV-Plan,对比采用f(EUD)评估pV-Plan和mV-Plan,如表4所示。当采用f(EUD)和f(TCP~NTCP)评估mV-Plan、pV-Plan物理方案的质量得到的数值分别存放于命名为f(E)m,f(T)m和f(E)p,f(T)p的数组中。结果发现,用f(EUD)和f(TCP~NTCP)评价物理方案具有较好的一致性:当f(E)m、f(E)p的值比较大时,f(T)m、f(T)p的值也比较大。对比分析数组,f(E)mvsf(E)p,P=0.473;f(T)mvsf(T)p,P=0.353。
表3pV-Plan与mV-Plan物理方案中危及器官(OARs)的吸收剂量对照表
Table3.AbsorbedDoseofOrgansatRiskinpV-PlanandmV-PlanPhysicalSchemes
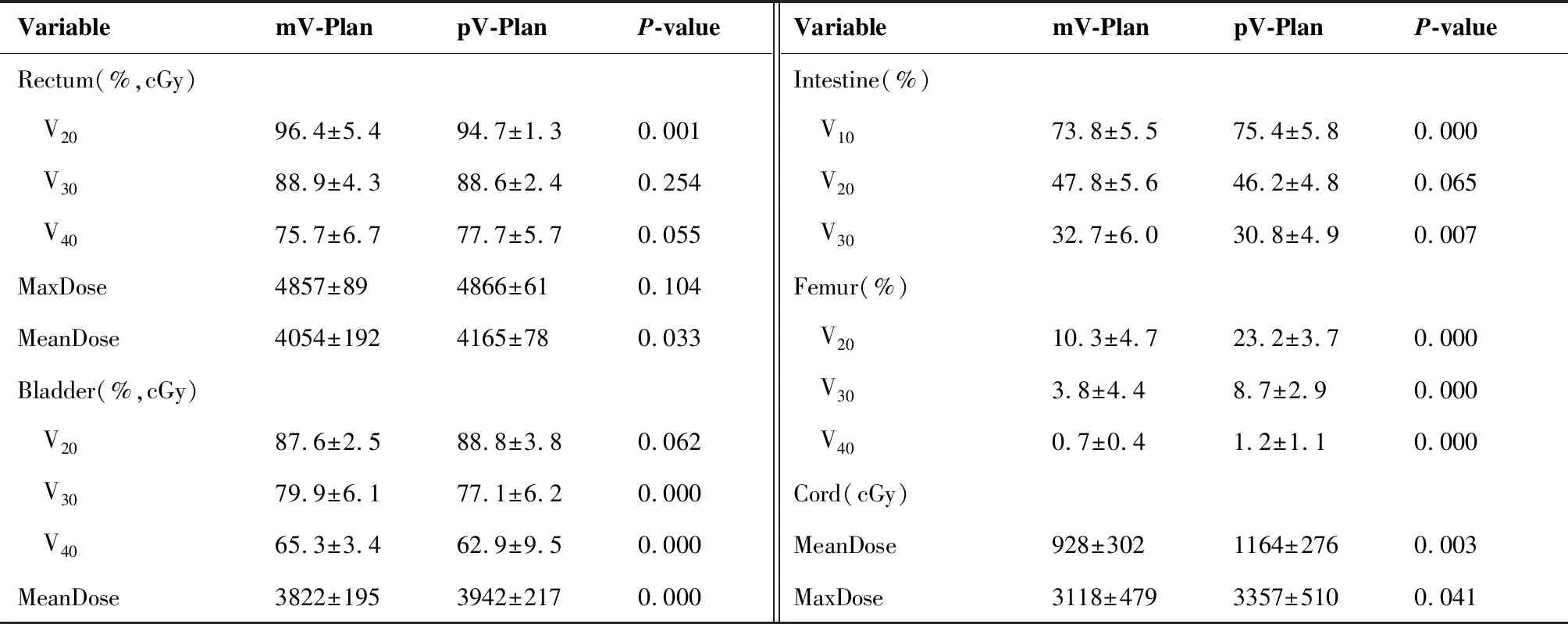
VariablemV-PlanpV-PlanP-valueVariablemV-PlanpV-PlanP-valueRectum(%,cGy)Intestine(%) V2096.4±5.494.7±1.30.001 V1073.8±5.575.4±5.80.000 V3088.9±4.388.6±2.40.254 V2047.8±5.646.2±4.80.065 V4075.7±6.777.7±5.70.055 V3032.7±6.030.8±4.90.007MaxDose4857±894866±610.104Femur(%)MeanDose4054±1924165±780.033 V2010.3±4.723.2±3.70.000Bladder(%,cGy) V303.8±4.48.7±2.90.000 V2087.6±2.588.8±3.80.062 V400.7±0.41.2±1.10.000 V3079.9±6.177.1±6.20.000Cord(cGy) V4065.3±3.462.9±9.50.000MeanDose928±3021164±2760.003MeanDose3822±1953942±2170.000MaxDose3118±4793357±5100.041
表4采用f(TCP~NTCP)和f(EUD)评估pV-Plan和mV-Plan的对照表
Table4.pV-PlanandmV-PlanEvaluatedbyf(TCP~NTCP)andf(EUD)
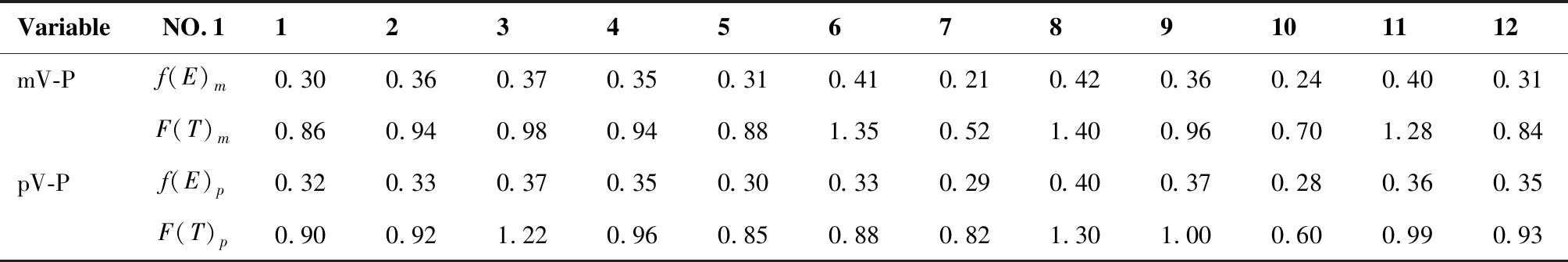
VariableNO.1123456789101112mV-Pf(E)m0.300.360.370.350.310.410.210.420.360.240.400.31F(T)m0.860.940.980.940.881.350.521.400.960.701.280.84pV-Pf(E)p0.320.330.370.350.300.330.290.400.370.280.360.35F(T)p0.900.921.220.960.850.880.821.301.000.600.990.93
4 讨 论
近10年来,在宫颈癌放疗外照射形式上的一个突出的进展是调强放射治疗(IMRT)技术的广泛应用[12-14]。Naik等[15]开展的一项入组40例患者的前瞻性随机对照研究表明,IMRT组和3DCRT组的物理方案均能达到足够的靶区适形度,IMRT组的适形指数更佳(P=0.001)。该研究中IMRT能使膀胱的D35和D50分别下降14.62%和32.57%,直肠D35和D50分别下降23.82%和43.68%,二级及以上的急性泌尿生殖系统、胃肠道不良反应均明显下降。
IMRT优于3DCRT。但在IMRT技术内,IMRT的不同形式间还存在各种差异;相同的IMRT形式,因TPS的不同算法也会产生差异[16-17]。Chitapanarux等[18]对20例宫颈癌接受全盆腔照射的病人的剂量进行了研究,发现采用TOMO比采用sIMRT,PTV的D5%、D50%和D95%会更好(P<0.001);2种调强形式PTV的适形指数不存在差异(P=0.057),但均匀指数HI,TOMO优于sIMRT;且TOMO中膀胱、直肠和小肠的D50%也低于sIMRT。在本研究中,采用Pinnacle与Monaco2种不同的TPS设计宫颈癌容积调强物理方案,也发现了在危及器官的保护上各有优劣的特点(见表3),pV-Plan在直肠的V20、V30,膀胱的V30、V40和小肠的V20、V30等剂量参数上优于mV-Plan;而在其它的剂量参数上mV-Plan又优于pV-Plan。其中差异有统计学意义(P<0.05)的剂量参数有:直肠的V20和平均剂量,膀胱的V30、V40和平均剂量,小肠的V10、V30,股骨头的V20、V30和V40。在pV-Plan中,目标函数的处罚权重是设计者人为给定的且目标函数只对DVH曲线上某个特定的“点”进行作用,在计划优化时,给定了相对较大处罚权重的目标比较容易实现,例如膀胱的V30。而在mV-Plan中,目标函数的处罚权重是根据整个目标函数组的要求优化后得来,且mV-Plan中的Parallel函数的作用会被分散在整根DVH曲线上,虽然在设定Parallel函数的参数时reference dose(RD)给定的为3 000cGy,但Parallel函数同时会对1 000cGy,2 000cGy,4 000cGy……等剂量对应在DVH曲线上的“点”进行作用,这些作用会对RD处的结果产生影响,这些影响可能是正向的也有可能是反向的。mV-Plan中直肠、膀胱和脊髓的平均剂量(MeanDose)均优于pV-Plan,原因是mV-Plan中提供了Serial函数,能对器官的Mean-Dose给予一定的约束,而pV-Plan中没有类似的函数(高版本的Pinnacle中的EUD模块具有类似的函数)。mV-Plan中股骨头的V20、V30、V40均优于pV-Plan中的,这主要是Parallel函数对整根DVH曲线作用的结果,而在pV-Plan中研究者采用DaxDVH仅对4 000cGy的值进行了约束,且处罚权重较低。
可见,采用传统的方法评估放疗物理方案质量,会出现采用不同的参数评价出现不同结果的现象。就本研究结果,若采用直肠的V20、V30,膀胱的V30、V40和小肠的V20、V30等剂量参数评估,我们会选择pV-Plan;若选择直肠、膀胱和脊髓的平均剂量,股骨头的V20、V30、V40进行评价,我们会选择mV-Plan。
Qi等[9]创建的f(EUD)模型能对整个物理方案进行综合评估,但该方法存在的一个缺陷:EUD并不直接反应TCP和NTCP的高低,存在TCP很低或NTCP很高的物理方案成为最优物理方案的风险。本研究团队创建了f(TCP~NTCP)模型,并将TCP<70%[19]和NTCP>5%的物理方案在方案优选前进行了排除。用f(EUD)和f(TCP~NTCP)评价物理方案具有较好的一致性:当f(E)m、f(E)p的值比较大时,f(T)m、f(T)p的值通常也比较大。对比公式(1)和(2),不难发现f(EUD)与f(TCP~NTCP)存在着内在的关联性,EUD越大,其对应的TCP或NTCP的值也会也大;但f(EUD)与f(TCP~NTCP)并不成绝对的正相关关系,因为TCP、NTCP是以EUD为自变量的非正比例函数,且f(TCP~NTCP)又是以TCP、NTCP为自变量经过非线性处理得来的,这也是mV-Plan中病人1的f(E)m=0.30小于病人12的f(E)m=0.31,而f(T)m=0.86大于病人12的f(T)m=0.84的原因。对比分析数组,f(E)mvsf(E)p,P=0.473(>0.05),差异不具有统计学意义;f(T)mvsf(T)p,P=0.353(>0.05)。这说明总体上来说采用Monaco系统设计宫颈癌的容积调强计划并不比采用Pinnacle系统有优势,但就某一病人来说,物理方案的优劣是可以通过f(TCP~NTCP)断定的,不管这种优劣是由设计者本身的经验还是计划系统本身带来的,因为从f(TCP~NTCP)的表达式(2)中可以得到f(TCP~NTCP)的数值越大,反映的是所有的NTCP和相对TCP的值在减少。就本课题中所研究的宫颈癌来说,在只考虑脊髓、小肠、直肠、膀胱和股骨头5个危及器官的情况下,f(TCP~NTCP)≥0.28;因为在TCP取最小值70%且NTCP都取最大值5%时,f(TCP~NTCP)得到它的最小值为:0.7/(10×0.25)=0.28。因此,在使用f(TCP~NTCP)模型评价宫颈癌时,f(NTCP~NTCP)的值都会大于0.28。同理,在使用该模型评价其他病种的放疗物理方案时,使用上述方法也能得到f(TCP~NTCP)值的下限。综上所述,f(TCP~NTCP)可以作为新的物理方案质量评估模型,辅助传统的方法评估物理方案质量。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
