59例骶尾部脊索瘤术后放疗后的生存分析*
2019-04-15路顺邹炳文彭新皓张菡奕郎锦义
路顺,邹炳文,彭新皓,张菡奕,郎锦义
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 放疗中心(路顺、彭新皓、张菡奕、郎锦义);614041 成都,四川大学华西医院 胸部肿瘤科(邹炳文)
脊索瘤是一种起源于人体脊索的罕见骨肿瘤,呈低度恶性,占恶性骨肿瘤的l%~4%,且约40%~50%发生于骶尾部。现阶段脊索瘤的主要治疗模式为手术治疗[1-2],术后放疗可有效提高患者无复发生存率[2]。图像引导下适形调强放疗(image-guided radiation therapy, IG-IMRT)和伽马刀(gamma knife surgery,GKS)是目前中国广泛使用的放疗技术[3]。Yamada等[4]在研究中提出,IMRT有助于降低骶尾部脊索瘤术后患者的复发率,Kim等[5]发现颅底的脊索瘤患者获益于GKS治疗。目前尚无文献报道不同的术后辅助放疗方式对骶尾部脊索瘤患者生存情况的影响。本研究回顾性分析了59例骶尾部脊索瘤患者接受单纯手术或术后辅助不同放疗方式的患者,并分析其生存情况,以明确骶尾部脊索瘤患者是否能从术后辅助放疗中获益,探索适合骶尾部脊索瘤术后放疗的放疗模式。
1 材料和方法
1.1 病例选择
纳入从2003年8月至2015年5月在我院治疗的59例骶尾部脊索瘤患者。所有患者在首诊医院完成病理学确诊和辅助检查(胸部平扫CT、腹部超声、全身骨扫描、部分患者PET/CT),明确未发生远处转移。本研究得到伦理委员会批准,所有的患者均知情并同意将其治疗及预后数据用于研究。
1.2 病例分组
纳入的59例患者分为单纯手术组(22例)、术后辅助IG-IMRT放疗组(24例)和术后辅助GKS组(13例)。全组患者总共进行了91次手术治疗,包括59次首程手术治疗以及32次复发后二程手术治疗。所有的首程手术治疗均在病理诊断明确后1个月内完成,所有接受术后放疗患者均在术后4~6周内开始放疗。所有入组患者在首次治疗方案结束后通过MRI疗效评估均为肿瘤完全消退。
1.2.1 IG-IMRT放疗 24例接受术后IG-IMRT治疗的患者在治疗前进行了带模1.5mm的薄层计算机断层扫描(computed tomography,CT)与1.5T/3.0T的核磁共振扫描(magnetic resonance imaging,MRI),MRI序列包括T1WI 快速自旋回波序列、T1WI增强序列、T2WI水抑制成像序列。对比患者术前与术后的CT/MRI图像来确定肿瘤靶区范围。CT-MRI融合图像用于引导靶区勾画。靶区勾画系统包括Oncentra Master Plan(Nucletron,Holland)、Brainlab iPlan software(Westchester,Illinois, United States) and MIM Maestro(MIM Software,United States)。在IGRT中使用螺旋CT图像进行图像引导。放射治疗实施采用Elekta Synergy IGRT系统(United Kingdom)和VARIAN Clinac-23EX IMRT 系统 (United States)。在患者摆位与进行放疗过程中均采用热塑模型进行固定。临床靶区(clinical target volume,CTV)包括残余大体肿瘤区(gross tumor volume, GTV)和术区。计划靶区(planning target volume,PTV)定义为CTV外扩5mm,如果外扩范围距危及器官(例如膀胱)太近,则进行适当的回缩。CTV和PTV的平均受照剂量为71.6 Gy(70~74Gy)和59.4 Gy(56~62Gy),单次剂量为2~2.2Gy。
1.2.2 伽马刀放疗 13例患者接受术后伽马刀放疗,采用Leksell Gamma Knife Model C(Elekta, Stockholm, Sweden),患者治疗前使用Leksell立体框架进行固定,患者均基于立体定向MRI进行放疗计划制作,3.0T MRI的T1WI增强序列与T2水抑制序列被运用与基准系统的构建。中位靶区体积为6.8cm3(1.5~17.3cm3)。肿瘤边缘2.6Gy。所有患者均在术后4~6周内开始放疗。
1.2.3 疗效评估 治疗期间每周检查1次,治疗后前2年每6个月随访1次,2年后每年随访1次。除常规体格检查外,每次行腹部B超、胸部正侧位片、盆腔增强MRI,必要时行其他检查。
1.3 统计学分析
患者临床数据来自于医院肿瘤科及信息科的病程记录、放疗记录等病例文书资料。临床数据搜集包括患者的性别、年龄、外科手术结果、放疗技术、放疗剂量、分次剂量及靶区范围等。随访时间从患者确诊时开始计算,随访终点包括复发、转移与死亡。随访数据来自于患者及家属成员的电话随访,所有患者随访至少2年以上。 统计软件采用SPSS 21.0 (IBM Corporation, Armonk, NY)。Kaplan-Meier用于计算无复发生存期(recurrence-free survival,RFS)、总生存期(overall survival,OS)以及生存曲线的绘制,log-rank进行单因素分析以及亚组组间比较。Cox回归风险模型用于多因素分析以及风险比(hazard ratio,HR)的计算。
2 结 果
2.1 患者临床特点
全组患者平均年龄为(49.1±14.6)岁(34.5~63.7岁);男女比为1.03(男性30名,女性29名);其中31例完全切除(gross total resection,GTR) 和18例为次全切(subtotal resection,STR)。 共37例患者接受术后放疗,24例为IG-IMRT放疗,13例为GKS放疗。32例患者治疗后出现局部复发,均接受了复发肿瘤的二次手术。其中14例为单纯手术组,7例为GKS组,11例为IG-IMRT组。局部复发后的处理、转归和患者详细临床信息见表1。
表1.全组59例患者临床特点
Table1.CharacteristicsandOutcomeofAll59InvestigatedPatients
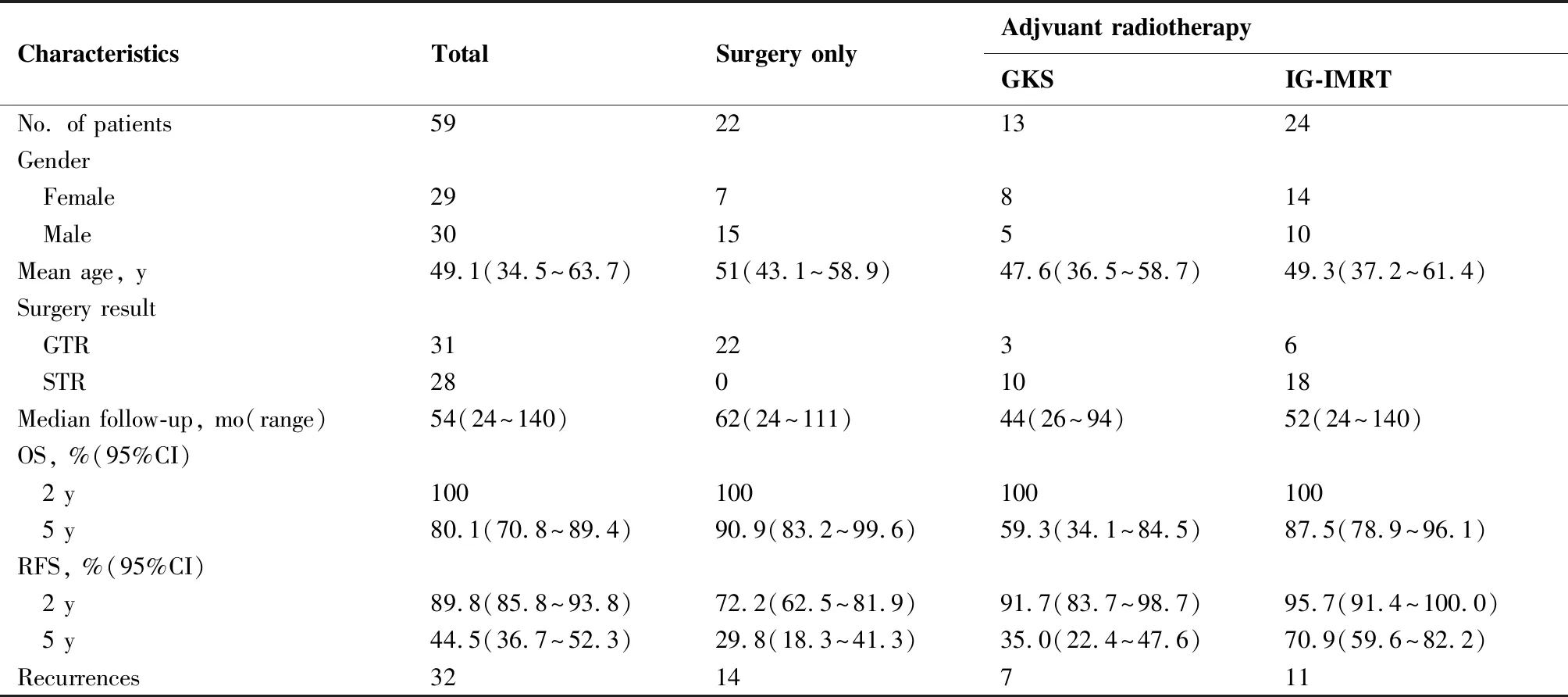
CharacteristicsTotalSurgery onlyAdjvuant radiotherapyGKSIG-IMRTNo. of patients59221324Gender Female297814 Male3015510Mean age, y 49.1(34.5~63.7)51(43.1~58.9)47.6(36.5~58.7)49.3(37.2~61.4)Surgery result GTR312236 STR2801018Median follow-up, mo(range)54(24~140)62(24~111)44(26~94)52(24~140)OS, %(95%CI) 2 y 100100100100 5 y 80.1(70.8~89.4)90.9(83.2~99.6)59.3(34.1~84.5)87.5(78.9~96.1)RFS, %(95%CI) 2 y 89.8(85.8~93.8)72.2(62.5~81.9)91.7(83.7~98.7)95.7(91.4~100.0) 5 y 44.5(36.7~52.3)29.8(18.3~41.3)35.0(22.4~47.6)70.9(59.6~82.2)Recurrences 3214711
2.2 生存情况
全组患者的中位随访时间为54个月(24~140个月),单纯手术组为62个月(24~111个月),GKS组为44个月(26~94个月),IG-IMRT组为52个月(24~140个月)。单纯手术组的2年与5年OS率分别为100.0%和90.9%,GKS组的2年与5年OS率分别为100.0%和59.3%,IG-IMRT组的2年与5年OS率分别为100.0%和87.5%,两组间OS比较差异无统计学意义(P=0.409)(图1)。在术后辅助放疗组的手术结果亚组分析中,GTR组的5年OS率为89.7%,STR组的5年OS率为90.3%,两组间OS比较差异没有统计学意义(P=0.75)(图2)。

图1单纯手术治疗组和术后放疗组的生存率比较
Figure1.ComparisonofSurvivalRatebetweenSurgeryGroupandPost-operativeRadiationGroup
Kaplan-Meier analysis of overall survival (A) and recurrence-free survival (B) in 59 patients treated by surgery exclusively or by adjuvant radiotherapy.

图2IMRT治疗组和GKS治疗组的生存率比较
Figure2.ComparisonofSurvivalRatebetweenIMRTgroupandGKSgroup
Kaplan-Meier analysis of recurrence-free survival (A) and overall survival (B) in patients treated by IG-IMRT or GKS for sacral chordoma. (C) Overall survival in patients with GTR and STR prior to radiotherapy.
单纯手术组患者的2年和5年RFS率分别为72.2%和29.8%;GKS组患者的2年和5年RFS率分别为91.7%和35.0%;而IG-IMRT组患者的2年和5年RFS率分别为95.7%和70.9%。值得注意的是虽然辅助放疗组比单纯手术组的RFS更优(P=0.029),但在OS上辅助放疗却没有任何的获益(图1),但进一步亚组分析显示,IG-IMRT组患者的RFS优于GKS组(P=0.023)。两种放疗模式的无复发生存曲线见图2。
3 讨 论
本研究回顾性分析了59例骶尾部脊索瘤术后患者,其中22例患者为单纯手术治疗,24例患者接受手术联合术后IG-IMRT治疗,13例患者为手术联合术后GKS治疗,旨在确认骶尾部脊索瘤术后患者是否能从辅助放疗中获益,并探索更为恰当的术后放疗模式。
目前骶尾部脊索瘤标准的治疗方案为手术完整地切除肿瘤联合术后辅助放疗[6]。包块完整切除是最重要的预后因素[7]。然而,目前的研究显示,仅有50%的病例能够实现满意的完整切除[8],既往文献报导GTR和STR在原发肿瘤的完成率仅为52.5%和47.5%。本研究结果显示骶尾部脊索瘤术后的患者接受辅助放疗的患者RFS优于单纯手术的患者(P=0.029)。在辅助放疗组的亚组分析中,却没有发现GTR组与STR组的OS有统计学差异。既往研究提示骶尾部脊索瘤手术治疗的患者RFS约为35%~50%[9],这与本研究中的单纯手术组相似。Eid等[10-11]也发现骶尾部脊索瘤的患者接受术后辅助放疗后,不管是扩大切除术组还是次全切术组,其RFS的差异均没有统计学意义。更有文献报导,即使是对于无法手术切除的脊索瘤患者,单纯放射治疗也能得到较为满意的RFS[12]。基于以上证据,我们建议术后辅助放射治疗应当作为骶尾部脊索瘤患者治疗方案中一个重要的部分。既往如果病灶范围较大且侵犯周围正常组织,那么手术的范围必须慎重考虑[13]。
本研究结果还提示,IG-IMRT组的患者RFS明显优于GKS组的患者。从放射生物学的角度考虑,脊索瘤具有较低的α/β值,GKS应当是一种恰当的放射治疗,但我们的研究结果却得出了相反的结论。同样,近期另一项关于GKS治疗颅内脊索瘤的研究也得出了与我们相似的RFS结果[5]。Zabel-du等[14]近期报导一项中位随访时间为4.5年的脊索瘤IMRT光子治疗研究,其RFS和OS分别为42%和83%,结果与本研究相近。该研究中计划靶区(PTV2)中位总剂量为66Gy(60~72Gy),最终同样发现颅底脊索瘤术后采用IG-IMRT的患者RFS优于采用GKS治疗的患者。推测原因可能为:由于正常器官的限量,GKS未能达到IG-IMRT的靶区治疗剂量。在本研究中,IG-IMRT组患者接受了稍低的放射治疗剂量(本研究CTV靶区中位剂量为71.6Gy,他们的研究中CTV靶区中位剂量为76Gy)。脊索瘤是一种耐放射治疗的肿瘤,IG-IMRT高剂量的放射治疗可能可以获得更好的RFS,且未增加毒副反应发生率[15-16]。当然,我们的结果同样也提示IG-IMRT与GKS治疗后OS差异没有统计学意义。本研究18例复发的患者接受了二程手术治疗(N=12)或放射治疗(N=6),虽然复发的骶尾部脊索瘤患者的生存结果差于没有复发的患者[14],但手术和放射治疗对局部复发的患者依然是延长生存期的有效手段[17-18]。
本研究为回顾性研究,病例诊断时治疗方案的选择无明显的统一规则,可能原因为有部分病例诊断时脊索瘤的诊疗尚未有规范,入组样本存在选择偏倚。并且,脊索瘤的相对治疗后生存时间较长,而本研究随访时间较短,在达到研究终点时患者仅仅只有2例死亡。这种小样本数据可能缺乏足够的统计学效力。
总的来说,本研究提示术后辅助放疗的确能有效地延长骶尾部脊索瘤术后患者的RFS,但未观察到在OS上的获益。骶尾部脊索瘤术后患者在IG-IMRT的治疗中能获得较为满意的RFS,因此我们推荐将IG-IMRT作为骶尾部脊索瘤首选的辅助放疗模式。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
