食管癌术后放疗骨照射剂量与骨髓抑制相关性
2019-04-15李丛张欣吴府容翁克贵
李丛,张欣,吴府容,翁克贵
400030重庆,重庆大学附属肿瘤医院/重庆市肿瘤研究所/重庆市肿瘤医院 放疗科
据2018全球癌症统计报道,食管癌每年新发病人数57.2万,死亡人数50.9万,为最常见的消化道恶性肿瘤之一[1]。放射治疗在食管癌的综合治疗中扮演重要角色。骨髓抑制是食管癌放疗最常见的毒副反应,极大地影响及限制着患者整体治疗耐受度及生活质量[2]。成年人的活性骨髓在骨盆、胸骨、脊椎等处占有相当的比例,其中所含造血干细胞对射线极其敏感[3-4],因此在放疗过程中骨受照剂量是骨髓抑制发生与否及严重程度的重要影响因素。目前,在宫颈癌[5-7]、直肠癌[8-9]等盆腔肿瘤的放疗中,部分研究已初步揭示骨盆保护的意义。而在食管癌等胸部肿瘤放疗中,骨剂量的评估暂未引起足够重视。本文回顾了我院38例食管癌术后放疗患者,探讨了胸骨、椎体骨及其他骨受照射剂量与骨髓抑制的关系,为胸部肿瘤放疗的骨保护提供思路。
1 方 法
1.1 临床数据筛选
选取2016年8月至2018年8月在我院放疗科行术后放疗的食管癌患者44例,所有患者均行胸腔镜下食管癌根治术,术后病理均为鳞癌。其中排除未按计划完成放疗者1例,螺旋断层放疗(Tomotherapy,TOMO)计划者2例(排除计划系统差异),定位扫描范围不足者3例(要求范围见1.3),最终纳入实际病例38例,两组患者的详细临床资料见表1。按照患者治疗过程中血象变化情况,本研究分为II度以下骨髓抑制组(0度5 例、Ⅰ度7例)和Ⅱ度以上骨髓抑制组(Ⅱ度21例、Ⅲ度5例)。
1.2 放射治疗方法
放疗均采用热塑膜体膜固定体位,在CT模拟机下扫描定位,扫描范围C2-L2,层厚为3~5mm,传入TPS系统进行勾画。靶区勾画:临床靶区(clinical target volume,CTV)包括原发灶术后吻合口、瘤床、原发灶上下各外放3~4cm及相应高危淋巴结引流区。计划靶区(planning target volume,PTV)为CTV外放0.5~1.0cm。放疗剂量:1.8~2.0Gy/次,1次/d,5次/周,总剂量45.0~50.4Gy。其中9个患者术后影像检查考虑淋巴结残留,局部转移灶加量至54~60Gy。放疗计划:均采用调强放疗技术(intensity modulated radiation therapy,IMRT),处方剂量应包括95%以上 PTV,同时脊髓最大剂量≤45Gy,双肺V5≤60%,V20≤25%,心脏V30≤40%。
1.3 骨结构定义及剂量测量
放疗医师勾画从T1上缘至T12下缘层面全部骨结构,定义为总体骨;勾画胸骨柄、胸骨体及剑突,定位为胸骨;勾画T1~T12不包括附件的椎体结构,定位为椎体骨;将总体骨剪除胸骨及椎体骨结构,定义为其他骨。利用TPS系统中剂量体积直方图(DVH),测定上述骨结构实际受照剂量Dmean(平均剂量)、Dmax(最大剂量)、V5、V10、V20、V30及V40(剂量体积百分比)。
1.4 统计学方法
使用SPSS 22.0统计学软件,应用单因素方差分析进行连续性变量组间比较,应用卡方检验进行分类变量组间比较,应用(receiver operating characteristic, ROC)曲线法寻找最佳预测指标。显著性水平α=0.05。
2 结 果
两组患者基本临床信息见表1,性别、年龄、分段、术后分期、有无放疗前化疗、同步放疗在两组患者中分布差异无统计学意义。本研究中6例患者采取同步放化疗,化疗方案为卡培他滨单药口服。共计19例患者有放疗前化疗史,主要为TP及DP方案,1~6周期不等。有无同步化疗(P=0.382)、有无化疗史(P=0.485)及周期数(P=0.72)与骨髓抑制强度在本研究中未表现出相关性。
表138例食管癌术后放疗患者临床资料
Table1.ClinicalCharacteristicsof38PatientswithEsophagealCancerTreatedbyPostoperativeRadiotherapy
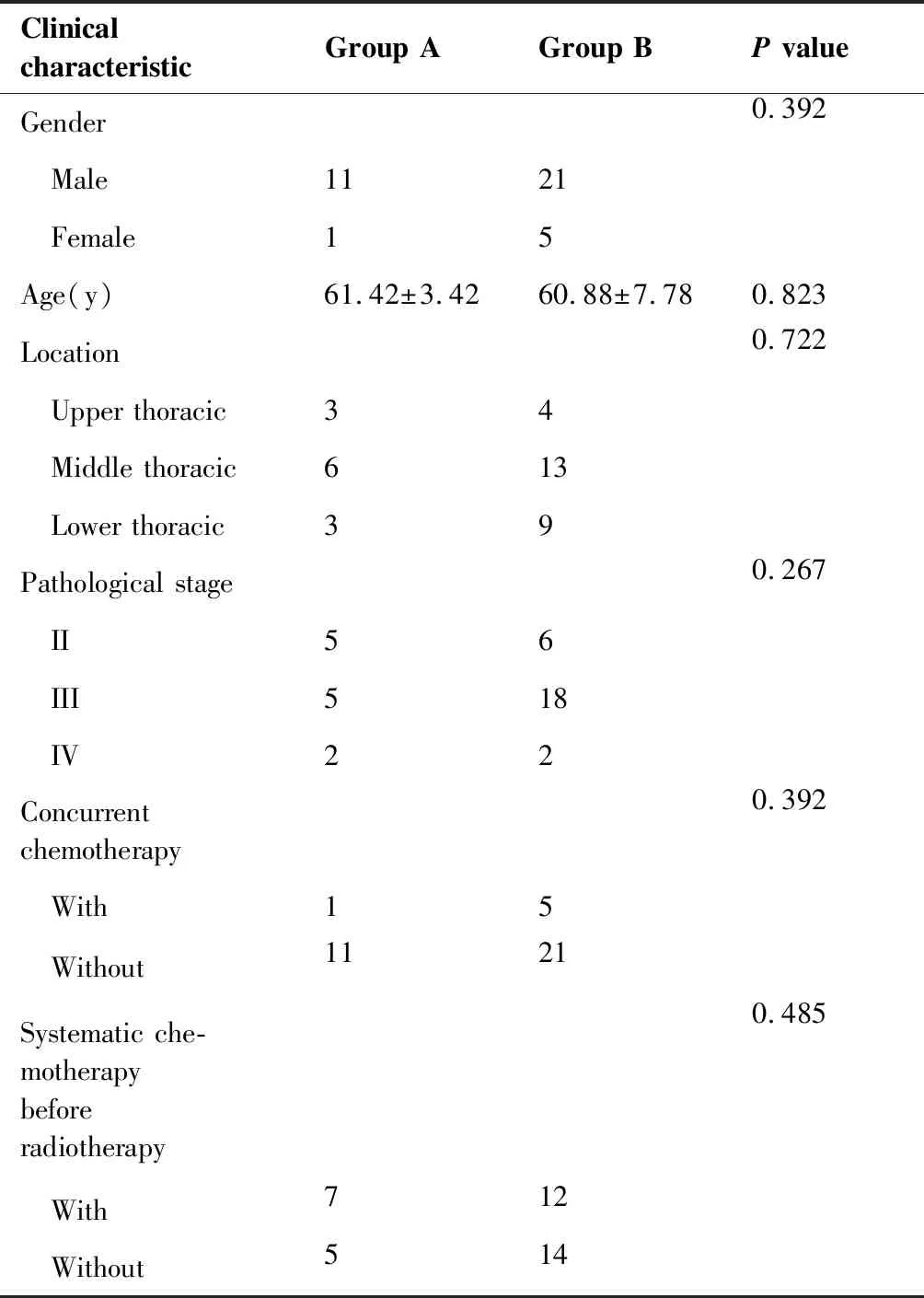
Clinical characteristicGroup AGroup BP valueGender0.392 Male1121 Female15Age(y)61.42±3.4260.88±7.780.823Location0.722 Upper thoracic34 Middle thoracic613 Lower thoracic39Pathological stage0.267 II56 III518 IV22Concurrent chemotherapy0.392 With15 Without1121Systematic che-motherapy before radiotherapy0.485 With712 Without514
两组患者骨受照剂量参数见表2,其中两组患者总体骨Dmean、V5、V10、V20,胸骨V5、V10,椎体骨V5、V10、V20与骨髓抑制差异有统计学意义。Ⅱ度以上骨髓抑制组患者上述指标均明显高于Ⅱ度以下骨髓抑制组。而除胸骨、椎体骨外其他骨受照剂量未体现出与骨髓抑制相关。我们选取有统计学意义骨受照参数分别作ROC曲线,其中总体骨、胸骨及椎体骨的V5、V10表现出相对较高的检验效能(图1)。
表2不同骨结构剂量参数与骨髓抑制的相关性分析
Table2.RelationbetweenDoseParametersofDifferentBoneStructuresandHematologicToxicity
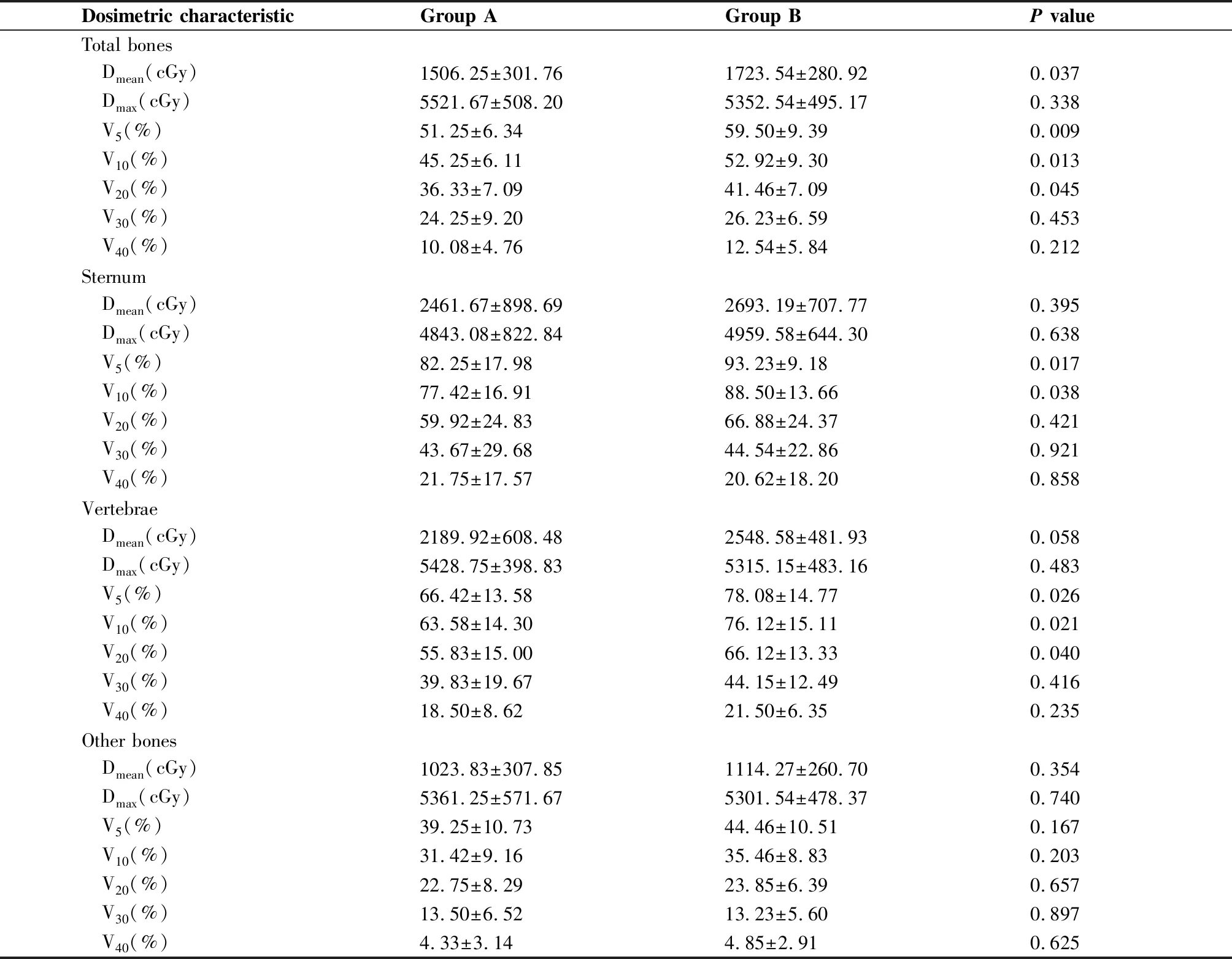
Dosimetric characteristicGroup AGroup BP valueTotal bones Dmean(cGy)1506.25±301.761723.54±280.920.037 Dmax(cGy)5521.67±508.205352.54±495.170.338 V5(%)51.25±6.3459.50±9.390.009 V10(%)45.25±6.1152.92±9.300.013 V20(%)36.33±7.0941.46±7.090.045 V30(%)24.25±9.2026.23±6.590.453 V40(%)10.08±4.7612.54±5.840.212Sternum Dmean(cGy)2461.67±898.692693.19±707.770.395 Dmax(cGy)4843.08±822.844959.58±644.300.638 V5(%)82.25±17.9893.23±9.180.017 V10(%)77.42±16.9188.50±13.660.038 V20(%)59.92±24.8366.88±24.370.421 V30(%)43.67±29.6844.54±22.860.921 V40(%)21.75±17.5720.62±18.200.858Vertebrae Dmean(cGy)2189.92±608.482548.58±481.930.058 Dmax(cGy)5428.75±398.835315.15±483.160.483 V5(%)66.42±13.5878.08±14.770.026 V10(%)63.58±14.3076.12±15.110.021 V20(%)55.83±15.0066.12±13.330.040 V30(%)39.83±19.6744.15±12.490.416 V40(%)18.50±8.6221.50±6.350.235Other bones Dmean(cGy)1023.83±307.851114.27±260.700.354 Dmax(cGy)5361.25±571.675301.54±478.370.740 V5(%)39.25±10.7344.46±10.510.167 V10(%)31.42±9.1635.46±8.830.203 V20(%)22.75±8.2923.85±6.390.657 V30(%)13.50±6.5213.23±5.600.897 V40(%)4.33±3.144.85±2.910.625
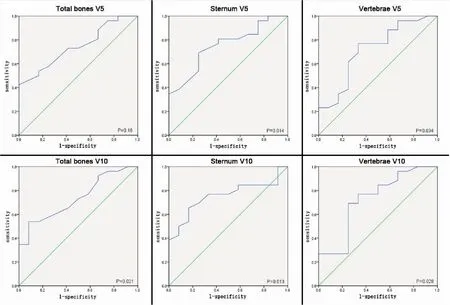
图1不同骨结构剂量体积参数的ROC曲线
Figure1.ROCCurveofDoseVolumeParametersofDifferentBoneStructures
ROC curves for grade>2 hematologic toxicity as a function of total bones V5& V10, sternum V5& V10, vertebrae V5& V10. The larger the area under the curve is, the greater the efficiency of this parameter for predicting bone marrow suppression is.
3 讨 论
放射治疗所致骨髓抑制与骨髓高度射线敏感性相关,实验发现骨髓细胞经8Gy以下剂量照射即会死亡[10]。临床观察到的骨髓抑制通常在放疗后短期内发生,其中淋巴细胞可在数小时至数天内达到低点,粒细胞和血小板在2~5周内明显下降[11],其造成的免疫功能低下、感染和出血风险以及严重时的治疗中断均带来恶劣影响。不止如此,许多研究亦证实在放疗后10年部分患者白细胞计数无法回升至基线水平[12-13]。因此,在剂量学水平进行骨髓保护意义重大。
在盆腔肿瘤放疗研究中,骨盆照射与骨髓抑制已证实存在明确相关性。Mell等[5]对37例宫颈癌患者进行研究,发现骨盆 V10≥90%及V20≥75%的宫颈癌患者易发生Ⅱ级以上白细胞减少。Rose等[6]在81例宫颈癌中发现V10≥95%及V20≥76%是Ⅲ度以上骨髓抑制的重要因素。黄维等[7]针对139例宫颈癌患者的研究证实骨盆V10控制在92%以下可有效减少Ⅱ度以上骨髓抑制。在直肠癌放疗中,王健仰等[8]研究提示腰骶骨V40<60%以及Yang等[9]研究提示腰骶骨V45<51%均为减少骨髓抑制的剂量参考。
而在胸部肿瘤中,少数研究探讨了胸骨剂量保护的意义。朱云云等[14]对43例食管癌放疗患者进行研究,发现骨髓抑制组患者Dmean、V20、V30均明显升高。高飞等[15]的前瞻性研究则将98例食管癌患者随机分组,治疗组通过改变照射给野方式降低胸骨平均剂量及V20、V30,且结果明显降低骨髓抑制发生。但事实上胸部约有接近全身35%的活性骨髓,除了胸骨,椎体骨质、锁骨、肋骨也应被作为可探讨的重要结构。Deek等[11]针对100例肺癌患者的研究提出,胸椎椎体照射剂量与重度骨髓抑制有明确相关性,胸椎Dmean<13.5Gy,V20≤56.0%,V30≤52.1%或可明显减低Ⅲ级以上骨髓抑制发生。此外,营养、高胸骨受量和接受同步化疗等被认为是增加血液毒性反应的关键因素[16]。在此次设计研究时,我们选取了进食状态、基础疾病、靶区设计等相对变异度较小的术后放疗人群,针对胸部所有骨结构作了细致的剂量学分析与亚组探讨。结果中有两点十分有趣。其一,胸骨及椎体骨在胸部骨结构照射中对骨髓抑制贡献较大,这可能由于活性骨髓分布存在异质性,各个骨结构实际活性骨髓量不能仅仅用骨体积作为替代。其二,低剂量(V5、V10)而非高剂量照射体积对于放疗造成的骨髓抑制有更明显的差异,这可能与骨髓敏感性高,致死剂量低等因素有关,也提示低剂量骨保护的重要性。
从放射生物效应分类,骨髓属于“并联器官”,因此剂量照射体积相较绝对放疗剂量有着更重要意义。纵观骨剂量照射的相关研究,研究者更多倾向于骨盆、胸骨等可在TPS中通过勾画计算总体体积的单个骨结构。而针对全身骨的剂量学研究较为困难,这与总体体积无法定义有关。探索一个可根据简单外形及体型数值估算总体骨体积的计算模式非常有意义。另外,骨髓造血活性分布不均,各个区域敏感性不同,在放射性骨保护中应存在优先级差异。有研究证实[17-19],基于18F的代谢性显像对于骨髓活性的判断有独到优势,同时治疗中及治疗后代谢性变化可助于评估骨髓损伤程度,更好地提示后续治疗的耐受能力[20]。另外,近期的研究证实肺是一种造血器官[21],动物体内有一半以上的血小板来自于肺部;并且肺部储存有多种造血祖细胞,可用于恢复受损骨髓的造血能力。肺剂量照射是否也与放疗后骨髓抑制相关目前还未有研究报道,值得我们更多探索和关注。
本研究样本量少,且为平衡各组数据分组未按照有无Ⅲ度骨髓抑制进行常规界定,ROC曲线整体效度不高。另外化疗为骨髓抑制重要影响因素,本文因样本量少,无法严格排除化疗的影响,如选取单纯放疗无化疗史的患者,但在此研究中化疗相关因素在两组分布中差异无统计学意义,仅能间接排除化疗相关影响。在未来大样本前瞻性研究中还需要进一步严格设计及论证,以便制定一个食管癌放疗乃至胸部肿瘤放疗的骨剂量限定标准。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
