EGFR突变阳性的晚期非小细胞肺癌交替使用EGFR-TKI及放化疗的回顾性研究*
2019-04-15饶明月文庆莲林盛张建文刘巧俐任培蓉吴敬波
饶明月,文庆莲,林盛,张建文,刘巧俐,任培蓉,吴敬波
646000 四川 泸州,西南医科大学附属医院 肿瘤科
非小细胞肺癌(non-small cell lung cancer, NSCLC) 的发病率高,起病隐匿,常发生远处转移且预后较差[1-2]。对于晚期NSCLC患者,临床上一般尽可能选择靶向治疗、化疗、转移灶姑息放疗等方法相结合的综合治疗[3]。对于表皮生长因子受体(epidermal growth factor receptor, EGFR) 突变阳性的晚期NSCLC患者,既往临床上常在一线放化疗失败后选择EGFR酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitor, EGFR-TKI)靶向治疗作为挽救治疗手段;靶向治疗耐药后,部分患者会再次接受放化疗。这种以放化疗为主的传统序贯治疗模式可被总结为放化疗-靶向-放化疗模式。然而,患者通常难以耐受这种治疗模式下的放化疗副作用,致使治疗计划中断,影响疗效。
目前,以厄洛替尼或吉非替尼为代表的第一代EGFR-TKI可作为EGFR基因突变型晚期NSCLC患者的标准一线治疗方案[4-9]。研究结果显示,与传统放化疗相比,EGFR-TKI的疗效更佳,且治疗相关副作用也更为轻微[9-11]。然而,EGFR-TKI也不可避免地会出现耐药,解决其耐药问题的研究亦在开展。研究报道[11-13],最初治疗NSCLC有效的EGFR-TKI药物发生耐药后,部分患者经过化疗会再次对EGFR-TKI治疗敏感。这种以EGFR-TKI为主的序贯治疗模式可被总结为靶向-放化疗-靶向治疗模式。
EGFR-TKI可作为晚期NSCLC EGFR敏感性突变患者的标准一线治疗。但EGFR-TKI存在不可避免的耐药性,靶向治疗失败后如何最大程度利用临床综合治疗手段尽可能延长患者生存期并提高生活质量仍需继续研究。因此,我们回顾性地比较了晚期NSCLC EGFR敏感性突变患者在临床治疗中较常见的两种序贯治疗模式:靶向-放化疗-靶向治疗与放化疗-靶向-放化疗的疗效及治疗相关副作用。
1 患者与方法
1.1 病例特征
连续性收集在西南医科大学附属医院肿瘤科病理诊断为非小细胞肺腺癌患者的病例资料,共46例。所有患者的病理组织均由基因检测判定为EGFR基因突变阳性。所有纳入的患者都接受了包括头颅核磁共振、胸腹部增强CT、全身骨扫描或者PET-CT的基线影像学检查以证实存在肿瘤远处转移,并且在治疗前均为多发性转移。所有患者都在2011年4月~2017年6月接受了临床指南所推荐的EGFR-TKI靶向治疗和放化疗的综合治疗。本研究中涉及到地所有的靶向治疗和放化疗,均经患者同意并签署了知情同意书。收集所有患者在治疗过程中接受转移灶放疗、全身化疗及EGFR-TKI的治疗数据。患者详细病例特征总结见表1。
表1患者病例特征
Table1.CharacteristicsofAllPatients

VariableRCT-TKI-RCT(n=26)TKI-RCT-TKI(n=20)PGender 0.510 Female1614 Male 106Age0.948 Range40~6146~63 Median5151KPS 0.858 801410 701210History of tobacco use1.000 No1814 Yes86EGFR mutation status0.917 Single point 1816
(Table 1 continues on next page (Continued from previous page)
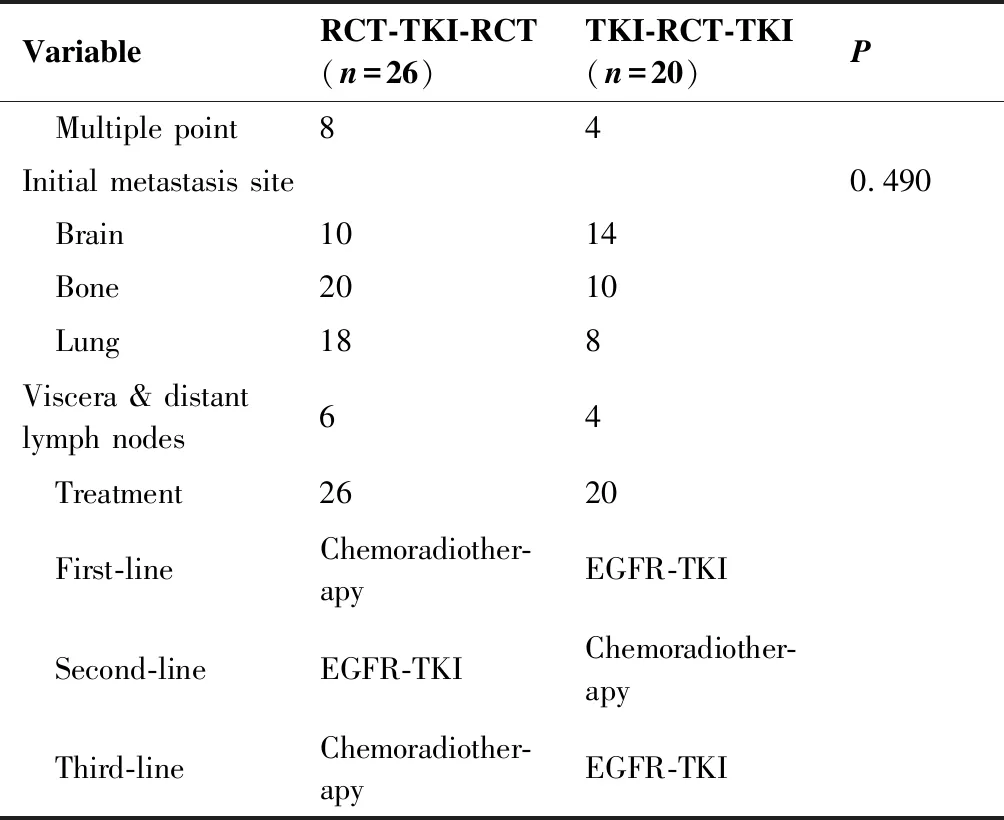
VariableRCT-TKI-RCT(n=26)TKI-RCT-TKI(n=20)P Multiple point84Initial metastasis site0.490 Brain1014 Bone2010 Lung188Viscera & distant lymph nodes64 Treatment2620 First-lineChemoradiother-apyEGFR-TKI Second-lineEGFR-TKIChemoradiother-apy Third-lineChemoradiother-apyEGFR-TKI
1.2 治疗方案
放化疗-靶向-放化疗组共纳入26例患者,一线治疗为全身化疗,药物和剂量具体为:10例患者接受培美曲塞+顺铂方案(AP :培美曲塞500 mg/m2,d1+顺铂75 mg/m2,d2)、10例患者接受紫杉醇+顺铂(TP:紫杉醇175 mg/m2,d1+顺铂75 mg/m2,d2)、6例患者接受吉西他滨+顺铂(GP:吉西他滨1250 mg/m2,d1,8+顺铂75 mg/m2,d2),均每3周为一周期。对引起明显症状的转移灶予以姑息放疗,具体为:10例患者接受脑转移灶姑息放疗、4例患者接受骨转移灶放疗、8例患者接受肺内病灶放疗。持续随访至患者发生疾病进展后,转为EGFR-TKI二线治疗:16例患者口服厄洛替尼 (150 mg/d)、10例患者口服吉非替尼(250 mg/d)。持续随访至患者的病情再次进展,转为接受三线放化疗:4例患者接受脑转移灶姑息放疗、10例患者接受骨转移灶放疗;4例患者的化疗方案为培美曲塞+顺铂、10例患者为紫杉醇+顺铂,4例患者为吉西他滨+顺铂。药物剂量及周期同一线化疗一致。另外有8例患者仅接受了局部放疗,未配合全身化疗。
靶向-放化疗-靶向治疗组共纳入20例患者。一线应用EGFR-TKI的标准推荐剂量:8例患者口服厄洛替尼 (150 mg/d),12例患者口服吉非替尼(250 mg/d)。持续随访至疾病进展后,转为放化疗二线治疗:4例患者接受脑转移灶姑息放疗,10例患者接受骨转移灶放疗,2例接受肺内病灶放疗;6例接受培美曲塞+顺铂方案化疗,10例接受紫杉醇+顺铂,2例接受吉西他滨+顺铂。药物剂量及周期同前。其中2例骨转移灶患者仅行局部放疗,未配合全身化疗。持续随访至疾病再次进展,采用EGFR-TKI作为三线治疗:10例患者口服厄洛替尼,10例口服吉非替尼,用法同前。治疗详情见图1。
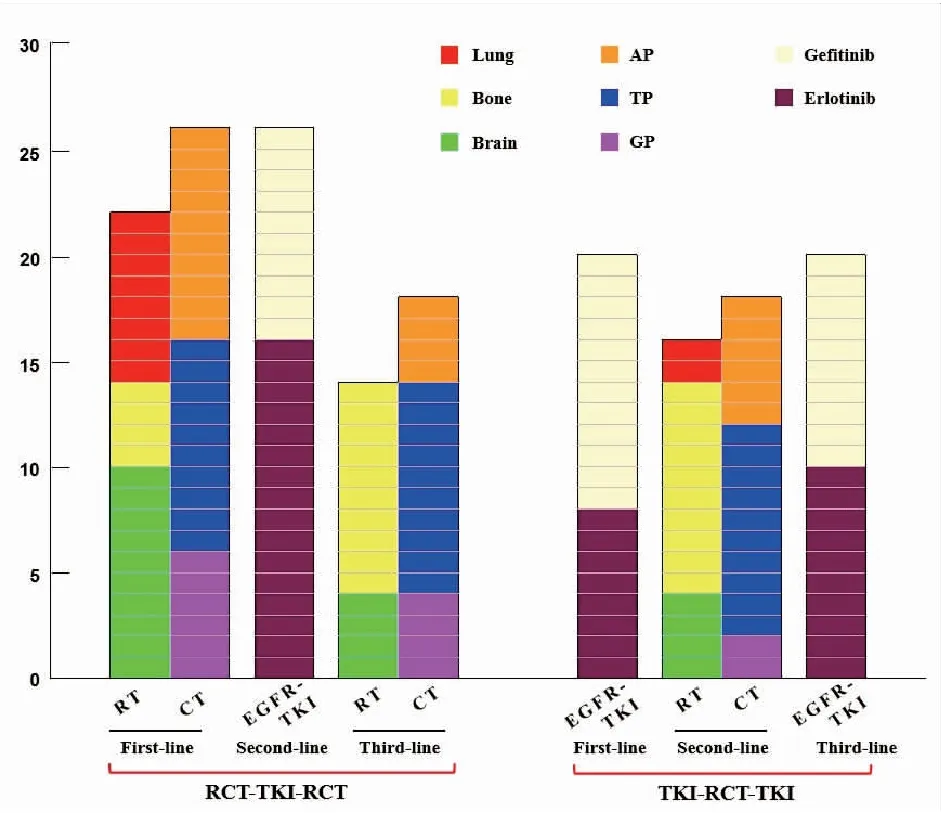
图1两组患者治疗方案详情图
Figure1.DetailsofTreatmentinPatientsofTwoGroups
AP: pemetrexide+cisplatin; TP: paclitaxel+cisplatin; GP: gemcitabine+cisplatin; RT: radiotherapy; CT: chemotherapy
1.3 病例资料中的随访情况
放化疗-靶向-放化疗组的患者在化疗期间每进行2~3周期化疗即随访1次,在放化疗结束后每2~3月随访1次,在口服EGFR-TKI期间每2月随访1次。靶向-放化疗-靶向组的患者在各线治疗期间及病程中的随访时间安排同放化疗-靶向-放化疗组相对应。随访内容包括:常规体格检查、实验室检查、心电图及适当的影像学检查(头颅核磁共振、胸腹部CT、全身骨扫描或PET-CT),以评价疗效。若患者出现与肿瘤进展相关的急性症状,及时进行体格检查和影像学检查,以评价疗效。
1.4 疗效评估
评价疗效的标准参照实体瘤的疗效评价标准1.1(response evaluation criteria in solid tumors,RECIST 1.1)[14]。按此标准将病例资料中记录的随访期间出现疾病进展(progressive disease, PD)的患者认定为相应治疗方式失败,记录相应指标的时间并调整治疗方案或模式。无疾病进展生存期(progression-free survival,PFS)定义为从治疗开始到疾病进展、死亡或末次随访的时间。PFS1为一线治疗开始到疾病进展的时期,PFS2为二线治疗开始到疾病再次进展的时期。总生存期(overall survival,OS)定义为确诊后直至患者死亡的时期。
提取病例资料中记录的患者一般状况、治疗相关副作用。尤其仔细收集放化疗患者在治疗结束后的1月内应密切随访(每周1~2次)以观察急性治疗副作用的变化情况。治疗相关副作用的分级标准采用国家癌症研究所不良事件通用术语标准分级3.0版[15]。
1.5 统计分析
两组患者的病例特征(性别、吸烟情况、EGFR突变情况、起始转移部位、进展转移部位)的比较均采用χ2检验,KPS评分状况采用Mann-WhitneyU检验。生存指标(PFS1, PFS2和OS)的比较采用Kaplan-Meier生存曲线,差异分析采用log-rank检验。治疗相关副作用的比较采用Mann-WhitneyU检验。
2 结 果2.1 疾病进展
在放化疗后,放化疗-靶向-放化疗组所有患者都发生了第一次疾病进展 (1-PD)。转移部位包括脑(30.7%)、骨(53.8%)、肺内(61.5%)、其他内脏和远处淋巴结(7.7%),转移部位均为多发性。第二次疾病进展(2-PD)与一线治疗后发生的1-PD类似。转移部位包括脑(46.2%)、骨(53.8%)、肺内(46.2%)、其他内脏和远处淋巴结(15.4%)。这些进展表现为起始转移灶增多、增大或出现新转移灶。靶向-放化疗-靶向治疗组所有患者同样都在靶向治疗后出现1-PD,转移部位包括脑(40.0%)、骨(60.0%)、肺内(60.0%)、其他内脏和远处淋巴结 (10.0%),同样是多发转移。2-PD 转移部位包括脑(40.0%)、骨(70.0%)、肺内(70.0%)、其他内脏和远处淋巴结(40.0%)。两组患者的1-PD 和2-PD特征相似,差异无统计学意义(P=0.989,P=0.772)(表2)。
表2两组患者一线、二线治疗失败后转移部位
Table2.TheMetastasisSitesafterFailureofFirstandSecondLineTreatmentinPatientsofTwoGroups

Metastasis siteRCT-TKI-RCT n (%)TKI-RCT-TKI n (%)P1-PD 0.989 Brain8 (30.7)8 (40.0) Bone14 (53.8)12 (60.0) Lung16 (61.5)12 (60.0) Viscera & distant lymph nodes 2 (7.7)2 (10.0)2-PD 0.772 Brain12 (46.2)8 (40.0) Bone14 (53.8)14(70.0) Lung12 (46.2)14(70.0) Viscera & distant lymph nodes 4 (15.4)8 (40.0)
2.2 疗效
靶向-放化疗-靶向治疗组患者的中位PFS1较放化疗-靶向-放化疗组延长,分别为6.6个月和5.3个月,但差异无统计学意义(P=0.077)(图2)。两组的中位PFS2依次为6.3个月和5.0个月,差异无统计学意义(P=0.646)(图3)。靶向-放化疗-靶向治疗组患者的中位OS较放化疗-靶向-放化疗组轻度延长,分别为21.3个月和21.0个月(P=0.506)(图4)。
2.3 治疗相关副作用
重度治疗相关副作用主要表现Ⅲ~Ⅳ度血液学毒性,即:中性粒细胞减少、血小板减少、贫血和消化道反应(恶心呕吐)。其中中性粒细胞减少和恶心呕吐是最常见的治疗相关副作用,在放化疗-靶向-放化疗组及靶向-放化疗-靶向治疗组的发生率分别为61.5%、76.9% 和30.0%、40.0% (P=0.142,P=0.079);Ⅲ~Ⅳ度血小板减少和贫血的发生率
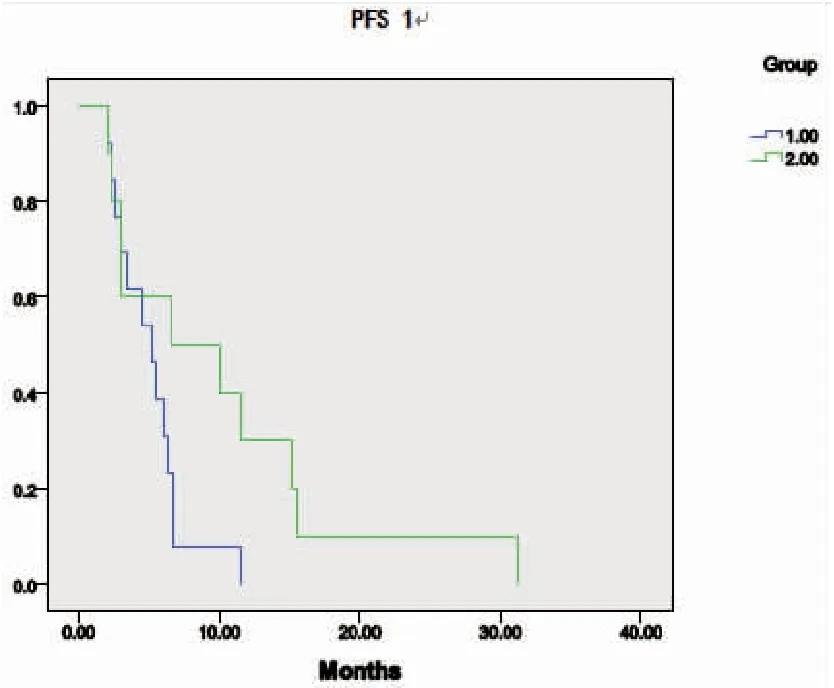
图2两组患者一线治疗失败后PFS1的比较
Figure2.ComparisonofPFS1afterFailureofFirst-lineTreatmentinPatientsofTwoGroups
1: RCT-TKI-RCT group; 2: TKI-RCT-TKI group
分别为30.8%、23.1%和10.0%、10.0%(P=0.242,P=0.422)。以靶向治疗为重点的靶向-放化疗-靶向治疗组发生重度治疗相关副作用的比例较低,但差异均无统计学意义。发生的一般治疗副作用如感觉异常、皮疹、腹泻和甲沟炎的程度均为Ⅰ~Ⅱ度,无Ⅲ~Ⅳ度,但感觉异常、皮疹、腹泻的发生率较高。两组的Ⅰ~Ⅱ度一般治疗相关副作用的差异无统计学意义。两组均无患者死于治疗相关副作用。治疗相关副作用的比较见表3。
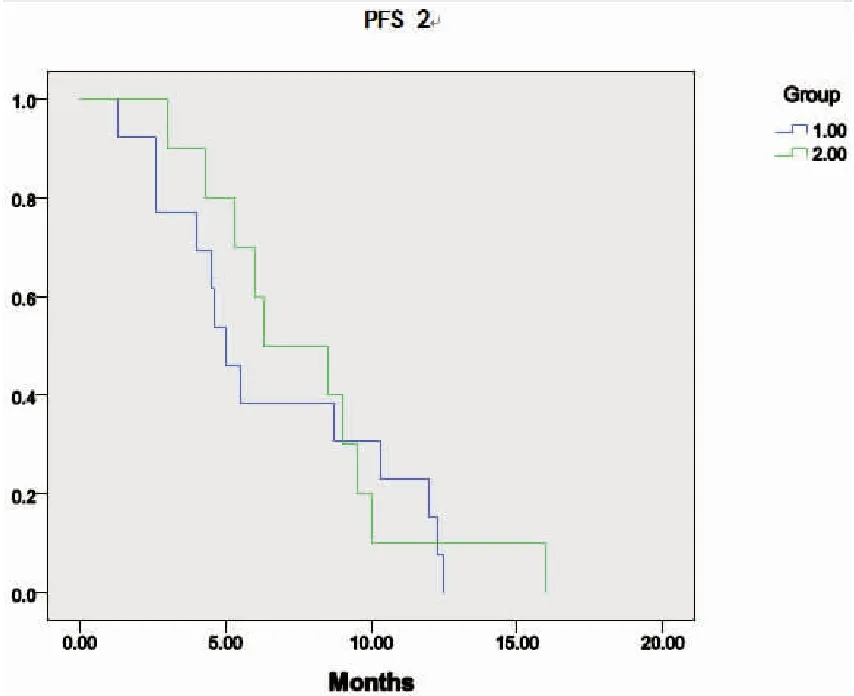
图3两组患者二线治疗失败后PFS2的比较
Figure3.ComparisonofPFS2afterFailureofSecond-lineTreatmentinPatientsofTwoGroups
1: RCT-TKI-RCT group; 2: TKI-RCT-TKI group
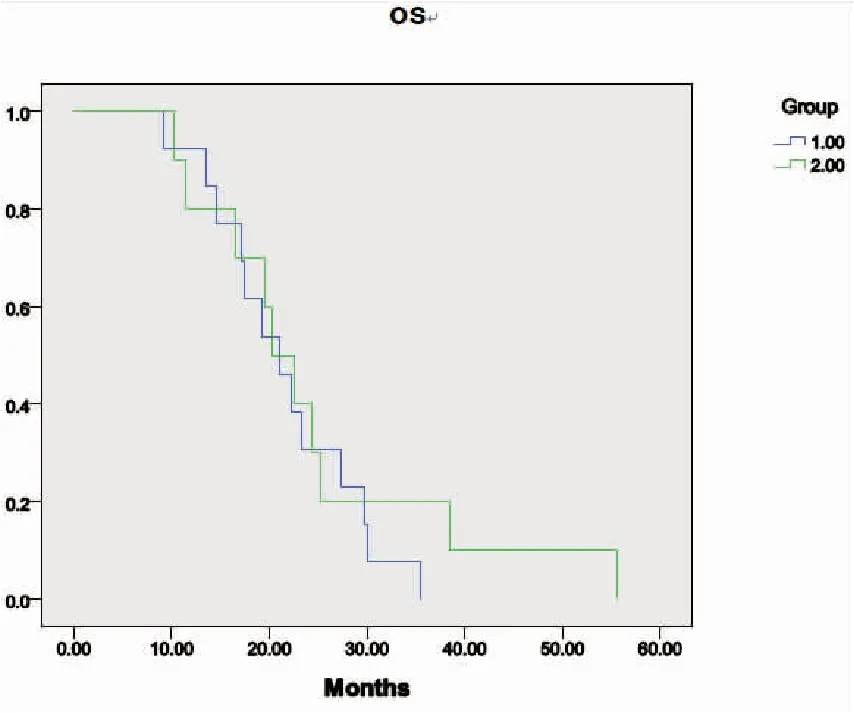
图4两组患者OS的比较
Figure4.ComparisonofOSinPatientsofTwoGroups
1: RCT-TKI-RCT group; 2: TKI-RCT-TKI group
表3两组的治疗相关副作用比较
Table3.ComparisonsofTreatment-relatedAdverseEffectsbetweenTwoGroups

Adverse effectRCT-TKI-RCT n(%)TKI-RCT-TKI n(%)PHematologic and gastrointestinal adverse effects (grade Ⅲ~Ⅳ) Neutropenia16 (61.5)6 (30.0)0.142 Thrombocytopenia8 (30.8)2 (10.0)0.242 Anemia6 (23.1)2 (10.0)0.422 Nausea/vomiting 20 (76.9)8 (40.0)0.079General adverse effects (grade Ⅰ~Ⅱ) Paraesthesias 10 (38.5)4 (20.0)0.619 Skin rash20 (76.9)14 (70.0)1.000 Diarrhoea8(30.8)4 (20.0)0.917 Paronychia2 (7.7)2 (10.0)1.000
3 讨 论
晚期NSCLC常发生多发转移,恶性程度高,预后差,肿瘤相关性死亡率高。对于晚期NSCLC患者,临床上需采取多种治疗方法相结合的综合治疗策略。在靶向治疗问世之前,静脉全身化疗是治疗晚期NSCLC最重要的手段。即便现在,静脉全身化疗与局部转移灶放疗相结合仍是经济负担能力有限的患者和/或EGFR基因突变阴性患者的标准治疗方案。然而,研究者们已证实,当作为EGFR基因突变阳性晚期NSCLC患者的一线治疗时,厄洛替尼、吉非替尼等EGFR-TKI靶向治疗药物的疗效优于静脉化疗作为一线方案[9-11]。Burotto等[16]对厄洛替尼和吉非替尼的疗效进行了荟萃分析,也证实当EGFR-TKI与化疗用作EGFR基因突变阳性晚期NSCLC患者的一线治疗方案时,接受EGFR-TKI的患者PFS更长。本回顾性研究亦显示,当使用EGFR-TKI作为携带EGFR敏感性突变的晚期NSCLC的一线治疗时,患者可受益于更长的PFS1(6.6个月和5.3个月),但差异无统计学意义(P=0.077),这可能是因为本研究的样本量较小。两组患者的PFS1范围跨度较大,放化疗-靶向-放化疗组为2.0~11.6个月,靶向-放化疗-靶向组为2.0~31.3个月,样本中存在的离群值和样本量较小可能导致统计分析无显著性差异。此外,Wu等[17]等研究者报道,当将吉非替尼用于一线治疗晚期NSCLC患者时,治疗初期肿瘤即有退缩的患者较退缩缓慢或病情稳定者具有更长的PFS和OS。本研究并非前瞻性研究,故无法获取患者在接受EGFR-TKI一线治疗时观察到的肿瘤退缩快慢情况。靶向-放化疗-靶向组的PFS1数据无法按照肿瘤退缩快慢进行分层分析,只能获取总体数据。这也可能导致PFS1在与放化疗-靶向-放化疗组比较时差异无统计学意义。
无论放化疗或EGFR-TKI,都会不可避免出现治疗失败,表现为出现新的转移灶或初始转移灶增大增多。不同于化疗敏感性的相对不确定性,EGFR-TKI失败的原因为基因突变。T790M突变是EGFR-TKI 耐药的重要机制之一。研究表明[18-19],约50%的患者接受EGFR-TKI治疗后发生了T790M二次突变。治疗失败的其他原因还包括c-MET基因扩增[20]、ERBB2基因扩增和向小细胞肺癌转化[21]。本研究中,我们将放化疗和EGFR-TKI分别作为挽救手段分别应用于EGFR-TKI 耐药和放化疗失败的患者。结果提示,两组一线治疗失败的患者在接受二线治疗挽救后病情仍可得到控制,患者能获益,且两组的中位PFS2 (6.3个月和5.0个月)亦接近。
目前,大多数临床研究都终止于一线或二线治疗失败,而未进一步干预疾病进程。Song等[22]在一项回顾性研究中发现,晚期NSCLC患者在接受三线化疗后可以获得相对较长的PFS,癌症相关症状明显得以改善,并推荐三线化疗方案选用单药。本研究继续观察了采用三线治疗尽可能延长患者生存期的效果。靶向治疗一线或二线应用都不可避免会耐药,而其他的综合治疗手段应可作为解救措施[23]。研究表明[11-13],在EGFR-TKI治疗有效后耐药的患者接受一段时间化疗后,再次对原EGFR-TKI治疗有效。此外,研究发现[24]因T790M突变而发生EGFR-TKI耐药的NSCLC细胞会对化疗敏感。基于这些研究发现,在应用EGFR-TKI耐药的患者经过放化疗后,再次给予原EGFR-TKI。这种创新性地交替使用 EGFR-TKI和放化疗有望挽救治疗失败,并尽可能使患者生存获益。结果表明靶向-放化疗-靶向治疗组患者中位 OS为21.3个月,放化疗-靶向-放化疗组为21.0 个月(P=0.506)。两组患者的OS范围跨度:放化疗-靶向-放化疗组为(9.2~35.5个月),靶向-放化疗-靶向组为(10.2~55.6个月)。靶向-放化疗-靶向治疗组患者的OS稍长,但差异无统计学意义,可能的原因为:样本量较小和数据分布;几乎所有第一代EGFR-TKI一线与标准化疗头对头比较的Ⅲ期随机对照临床试验(包括IPASS、NEJ002、WJTOG3405等研究),均发现EGFR-TKI治疗组的OS与对照组相比无显著性差异;此外本研究中二线、三线治疗的较大差异也可能影响了OS。未来开展随机对照的前瞻性临床研究应对两组所有的后续治疗进行限定,使之均衡。
EGFR-TKI与放化疗的副作用不同[25]。化疗常见的治疗相关副作用为骨髓抑制、恶心呕吐;靶向治疗以皮疹、腹泻较多见。转移灶姑息放疗的相关副作用常较轻,因为其照射剂量较低、范围较小。本研究中两组患者均接受了放化疗和EGFR-TKI,总体治疗相关副作用的种类相似,表现为骨髓抑制、恶心呕吐、皮疹、腹泻。Ⅲ~Ⅳ度骨髓抑制、恶心呕吐以及Ⅰ~Ⅱ度皮疹、腹泻发生程度差异无统计学意义;但发生率方面,以靶向治疗为主的靶向-放化疗-靶向治疗较低。严重影响患者生活质量的治疗副作用为骨髓抑制和恶心呕吐,主要是化疗相关的副作用。在靶向-放化疗-靶向组中,因为患者接受了相对较少周期的化疗,我们观察到患者在治疗期间有着相对积极的态度和舒适的感受。EGFR-TKI副作用较轻且容易被接受,更有可能提高患者的生存质量。
目前针对第一代EGFR-TKI(吉非替尼和厄洛替尼)一线治疗失败的挽救治疗的研究中,一项较新的AURA3研究头对头对比了奥希替尼与铂类联合培美曲塞双药化疗方案的疗效与安全性[26]。研究结果显示,与双药化疗方案相比,奥希替尼治疗能够显著延长患者的PFS(10.1个月vs4.4个月);客观缓解率在奥希替尼组也得到显著提高(71%vs31%)。此外,奥希替尼的缓解时间持续的更长,其与对照组的缓解持续时间分别为9.7个月和4.1个月;安全性方面,≥Ⅲ级的治疗相关性不良事件的发生率,奥希替尼组低于双药化疗组(6%vs34%)。另外对研究热门免疫检查点(PD-1/PD-L1)抑制药物治疗有驱动基因突变(EGFR突变)的NSCLC的荟萃分析发现[27]:在晚期NSCLC EGFR敏感性突变的患者EGFR-TKI一线治疗失败后,使用免疫检查点抑制药物与多西他赛化疗相比,不会提高OS。此外PD-1/PD-L1抑制药联合第一代EGFR-TKI会产生严重毒副反应。因此它们联合EGFR-TKI在一线和后续治疗中是否可以使用尚存争议,而其能否如同化疗般改善EGFR-TKI的耐药性以恢复其疗效的研究尚未见报道。
本回顾性研究存在许多不足。本研究纳入的病例数仅46例,样本量较少是导致两组结果差异无统计学意义的主要原因。此外,本研究在设计方面亦存在较多不足:观察EGFR-TKI一线治疗时未获取到敏感性数据,即肿瘤快速消退、缓慢消退及病情稳定的病例数;对于EGFR-TKI一线治疗失败,未分为快速进展、缓慢进展和局部进展分层分析;研究两种治疗模式的过程中针对化疗方案未做限定,因为不同的化疗方案可能存在疗效差异:一项荟萃分析发现,在EGFR-TKI一线治疗失败后,二线使用含培美曲塞方案较不含培美曲塞方案具有更长的PFS和OS[28]。这些原因都可能导致结果出现偏倚。晚期NSCLC EGFR敏感突变患者的治疗方案值得进一步探索。针对上述不足,我们拟设计前瞻性的随机对照临床试验,计算出恰当的样本量,密切观察患者在EGFR-TKI一线治疗时的肿瘤反应,根据肿瘤消退的快慢和进展速度的快慢以便分层分析,限定二、三线化疗方案。
本回顾性研究基于临床经验,单中心地比较了EGFR-TKI和放化疗交替应用于治疗EGFR基因敏感性突变的晚期NSCLC患者中的疗效和治疗相关副作用。靶向-放化疗-靶向序贯治疗模式的PFS1、PFS2和OS均具有优于放化疗-靶向-放化疗模式的趋势,且治疗相关副作用也具有较轻的趋势,但因样本量较小致差异无统计学意义。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
