不同治疗模式治疗早期结外NK/T细胞淋巴瘤的疗效对比*
2019-04-15权小英雷蕾汪品嘉陈小艳吴春芝叶斌冯薇臻欧阳楚桐张智慧
权小英,雷蕾,汪品嘉,陈小艳,吴春芝,叶斌,冯薇臻,欧阳楚桐,张智慧
610051 成都,成都市第六人民医院(权小英,雷蕾,汪品嘉,陈小艳,吴春芝,叶斌);610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院(冯薇臻,欧阳楚桐,张智慧)
结外NK/T细胞淋巴瘤,鼻型(extranodal natural killer/T-cell lymphoma,nasal type,ENKTL)是一种少见的非霍奇金淋巴瘤,具有地理分布差异,西方国家的发病率低于亚洲[1]。主要侵及上呼吸道区域(如鼻腔、鼻窦、鼻咽等部位),约20%侵犯远处结外部位(如皮肤、胃肠道、肾上腺等),故而就诊时大多数患者诊断为早期[2]。既往文献发现单纯放疗是局限期患者的主要治疗手段,完全缓解(complete response,CR)高达70%,5年总生存(overall survival,OS)约50%~80%[3-5],但是容易复发(近50%)[4-8]。既往研究显示ENKTL对传统化疗方案耐药,CR不到50%,5年OS低于66%[9-11],预后差。近来研究[12-14]报道以左旋门冬酰胺酶(L-asparaginase,L-ASP)为基础的化疗方案(如LOP, GELOX)展示了满意的结果。但是,鉴于L-ASP的免疫原性高,易发生过敏反应,临床使用受限[15]。培门冬酶(Pegaspargase,PEG-Asp)具有免疫原性低,安全性高的优势,获得了众多学者的高度认可。大量文献显示以培门冬酶为基础的P-Gemox化疗方案明显提高疗效和改善预后,CR约80%, ORR在90%以上,2年OS超过80%[16-20]。目前,尚无相关研究报道P-Gemox化疗方案夹心放疗和P-Gemox化疗方案序贯放疗治疗早期ENKTL的疗效差异。因此,本研究回顾性分析132例早期结外NK/T细胞淋巴瘤患者的临床资料,比较上述三种治疗模式的疗效差异,为临床治疗提供参考。
1 资料与方法
1.1 一般资料
回顾性分析四川省肿瘤医院于2009年6月至2017年9月初治的132例早期结外NK/T细胞淋巴瘤患者,符合以下标准:(1)病理诊断明确;(2)依据Ann Arbor分期[21],为IE~IIE期;(3)原发部位来自上呼吸道部位(鼻腔、鼻窦、鼻咽等);(4)未行放疗、化疗、靶向等抗肿瘤治疗;(5)无急慢性感染,亦无其他肿瘤;(6)资料完整,配合随访。排除标准:(1)前期接受过相关的抗肿瘤治疗;(2)肿瘤原发部位发生在非上呼吸道区域(皮肤、胃肠道等);(3)晚期、复发、难治者;(4)接受的化疗方案是CHOP、SMILE等;(5)不规范放化疗治疗或中途放弃治疗者;(6)合并心肺、肝肾功能等重要脏器功能不全者;(7)随访不合作,临床资料不完整。所有患者治疗前需行血常规、血生化、乳酸脱氢酶、骨髓涂片、骨髓流式细胞学等检验,同时完善鼻咽/颈部增强磁共振,胸腹部增强CT扫描等检查。外周血细胞计数通过全自动血细胞分析仪(型号Mindray BC-5800)分析,生化指标由全自动生化仪(型号Mindray BS-820)分析。其中男92例,女40例(2.3∶1),年龄范围15~86岁,中位年龄46岁,夹心放疗组(P-Gemox方案夹心放疗)共49例(37.1%),序贯放疗组(P-Gemox化疗方案序贯放疗)共42例(31.8%),单纯放疗组共41例(31.1%)。临床特征具体见表1。
表1ENKTL患者临床特征
Table1.ClinicalCharacteristicsoftheENKTLPatients
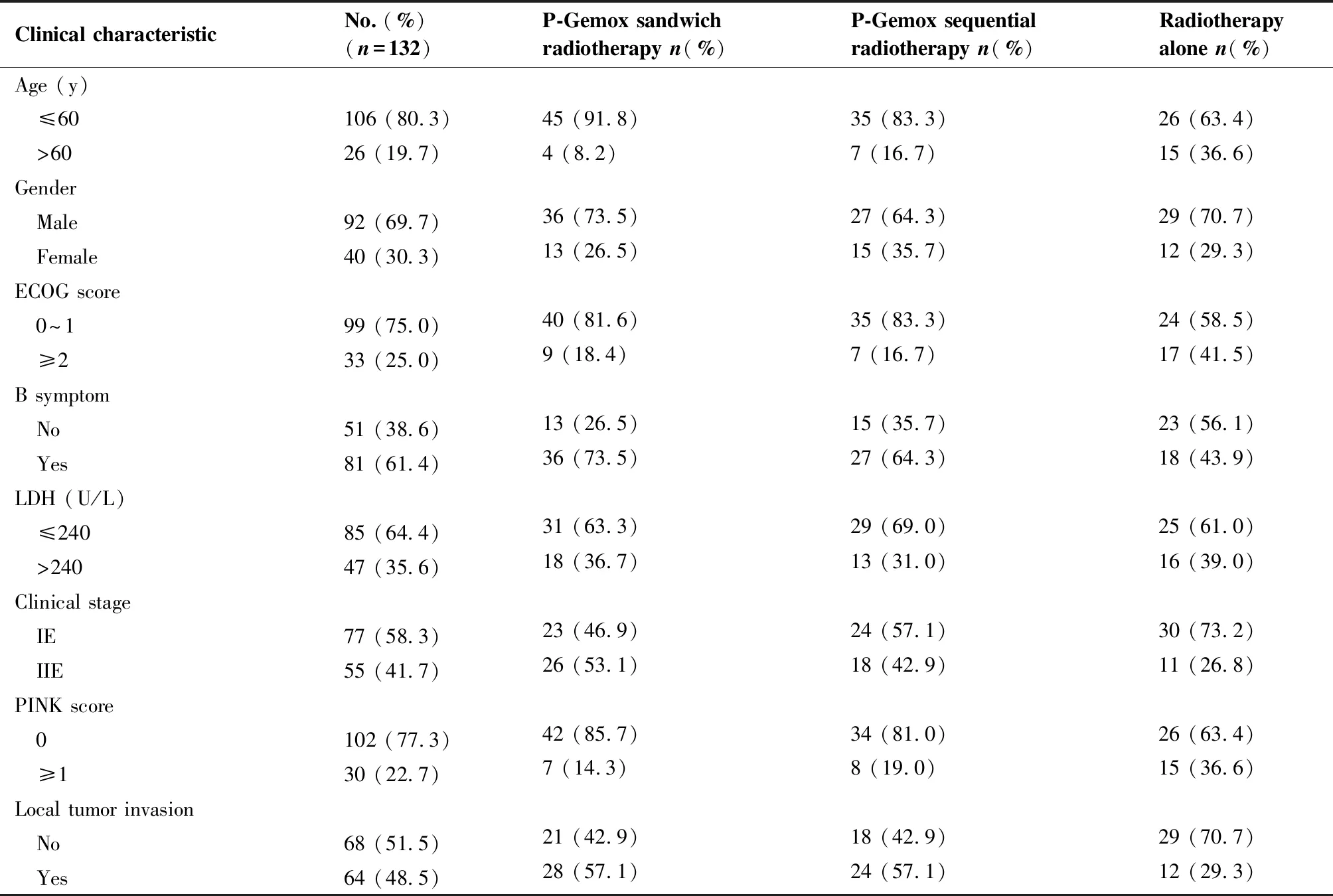
Clinical characteristicNo.(%)(n=132)P-Gemox sandwich radiotherapy n(%)P-Gemox sequential radiotherapy n(%)Radiotherapy alone n(%)Age (y) ≤60106 (80.3)45 (91.8)35 (83.3)26 (63.4) >6026 (19.7)4 (8.2)7 (16.7)15 (36.6)Gender Male92 (69.7)36 (73.5)27 (64.3)29 (70.7) Female40 (30.3)13 (26.5)15 (35.7)12 (29.3)ECOG score 0~199 (75.0)40 (81.6)35 (83.3)24 (58.5) ≥233 (25.0)9 (18.4)7 (16.7)17 (41.5)B symptom No51 (38.6)13 (26.5)15 (35.7)23 (56.1) Yes81 (61.4)36 (73.5)27 (64.3)18 (43.9)LDH (U/L) ≤24085 (64.4)31 (63.3)29 (69.0)25 (61.0) >24047 (35.6)18 (36.7)13 (31.0)16 (39.0)Clinical stage IE77 (58.3)23 (46.9)24 (57.1)30 (73.2) IIE55 (41.7)26 (53.1)18 (42.9)11 (26.8)PINK score 0102 (77.3)42 (85.7)34 (81.0)26 (63.4) ≥130 (22.7)7 (14.3)8 (19.0)15 (36.6)Local tumor invasion No68 (51.5)21 (42.9)18 (42.9)29 (70.7) Yes64 (48.5)28 (57.1)24 (57.1)12 (29.3)
Local invasion is defined as T3 or T4 where the primary lesions are based on the head and neck tumor of AJCC staging system (version 8). ECOG: Eastern Cooperative Oncology Group; LDH: lactate dehydrogenase; PINK: prognostic index of natural killer lymphoma.
1.2 治疗方案
P-Gemox化疗方案:培门冬酶2 500IU/m2im d0+吉西他滨800~1 000mg/m2ivgtt d1,8+奥沙利铂130mg/m2ivgtt d1,21天为1周期。夹心放疗组定义为先行2~3周期P-Gemox方案化疗后行放疗,后继续原方案2~3周期。序贯放疗组定义为2~3周期P-Gemox方案化疗后行放疗。放疗采用6-MeV电子线的直线加速器行适型调强放射治疗,靶区剂量(gross tumor volume,GTV)是通过肉眼或临床检查可见的鼻腔病灶及阳性淋巴结,临床靶区(clinical tumor volume,CTV)包括双鼻腔、双前组筛窦、硬腭和受累侧上颌窦,超出鼻腔者扩大至受累的临近器官或结构。每组GTV剂量为50~56Gy(中位剂量56Gy),单次剂量2.0Gy/天,每周共5次。
1.3 疗效评估与随访
每2周期化疗后或治疗完成后通过磁共振(magnetic resonance imaging,MRI)或CT进行疗效评价,依据疗效标准[21]:分为完全缓解(complete response,CR),部分缓解(partial response,PR),疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。每周期化疗后或全疗程化疗后通过患者症状体征、血常规、生化等指标进行化疗副反应评价[22],每阶段放疗结束后或放疗结束后进行副反应评价[23]。通过门诊或电话的方式进行随访,随访时间截止2018年9月。无进展生存期(progression free survival,PFS)是确诊之日到首次发生复发、进展、死亡或随访截止的间隔时间。总生存期(overall survival,OS)是以确诊之日到首次发生死亡或随访截止的间隔时间。
1.4 统计学方法
采用SPSS 17.0软件(P<0.05为有统计学意义),组间率比较行Chi-square检验,多个独立样本两两比较对检验水准行Bonferroni校正,Log-rank检验行单因素分析,COX回归模型行多因素分析,Kaplan-Meier检验描绘生存曲线。
2 结 果
2.1 近期疗效
整体的CR为79.5%,PR为11.4%,ORR为90.9%。其中,夹心放疗组的CR为89.8%,PR为6.1%,ORR为95.9%。序贯放疗组的CR为85.7%,PR为9.5%,ORR为95.2%。单纯放疗组的CR为61.0%,PR为19.5%,ORR为80.5%。3组间的CR (P=0.002),ORR(P=0.020)差异均有统计学意义。两两比较行Bonferroni校正显示,夹心放疗组和单纯放疗组的CR(P=0.001)差异有统计学意义,而ORR(P=0.047)差异无统计学意义。序贯放疗组和单纯放疗的CR(χ2=6.518,P=0.011)差异有统计学意义,而ORR(χ2=2.982,P=0.084)差异无统计学意义。此外,夹心放疗组和序贯放疗组的CR(χ2=0.355,P=0.552)和ORR(χ2=0,P=1)差异均无统计学意义(表2)。
表2三组近期疗效比较
Table2.ComparisonofShort-termEfficacyinThreeGroups

Treatment responseP-Gemox sandwich radiotherapy n(%)P-Gemox sequential radiotherapy n(%)Radiotherapy alone n(%)χ2PCR44 (89.8)36 (85.7)25 (61.0)12.8360.002PR3 (6.1)4 (9.5)8 (19.5)4.1800.124ORR47 (95.9)40 (95.2)33 (80.5)7.8280.020
2.2 化疗不良反应
P-Gemox化疗方案的不良反应主要表现为骨髓抑制(如白细胞减少、贫血、血小板减少)、胃肠反应(恶心、呕吐)、肝功能异常(转氨酶升高,胆红素升高),以I~II°常见,III~IV°少见。共91例患者接受P-Gemox方案化疗,其中III~IV°白细胞降低发生率49.5%,III~IV°贫血发生率24.2%,III~IV°血小板减少发生率29.7%,III~IV胃肠反应发生率20.9%,III~IV°转氨酶升高发生率8.8%,仅1例发生III~IV°胆红素异常。其中9例(9.9%)患者同时发生IV°白细胞减少和血小板减少,吉西他滨减量20%,其余化疗药物剂量无变化。相关副反应予对症治疗后均可恢复正常,未发生严重感染,亦未发生治疗相关死亡。两组间的副反应比较差异无统计学意义(P>0.05)(表3)。
表3化疗副反应
Table3.SideEffectsofChemotherapy
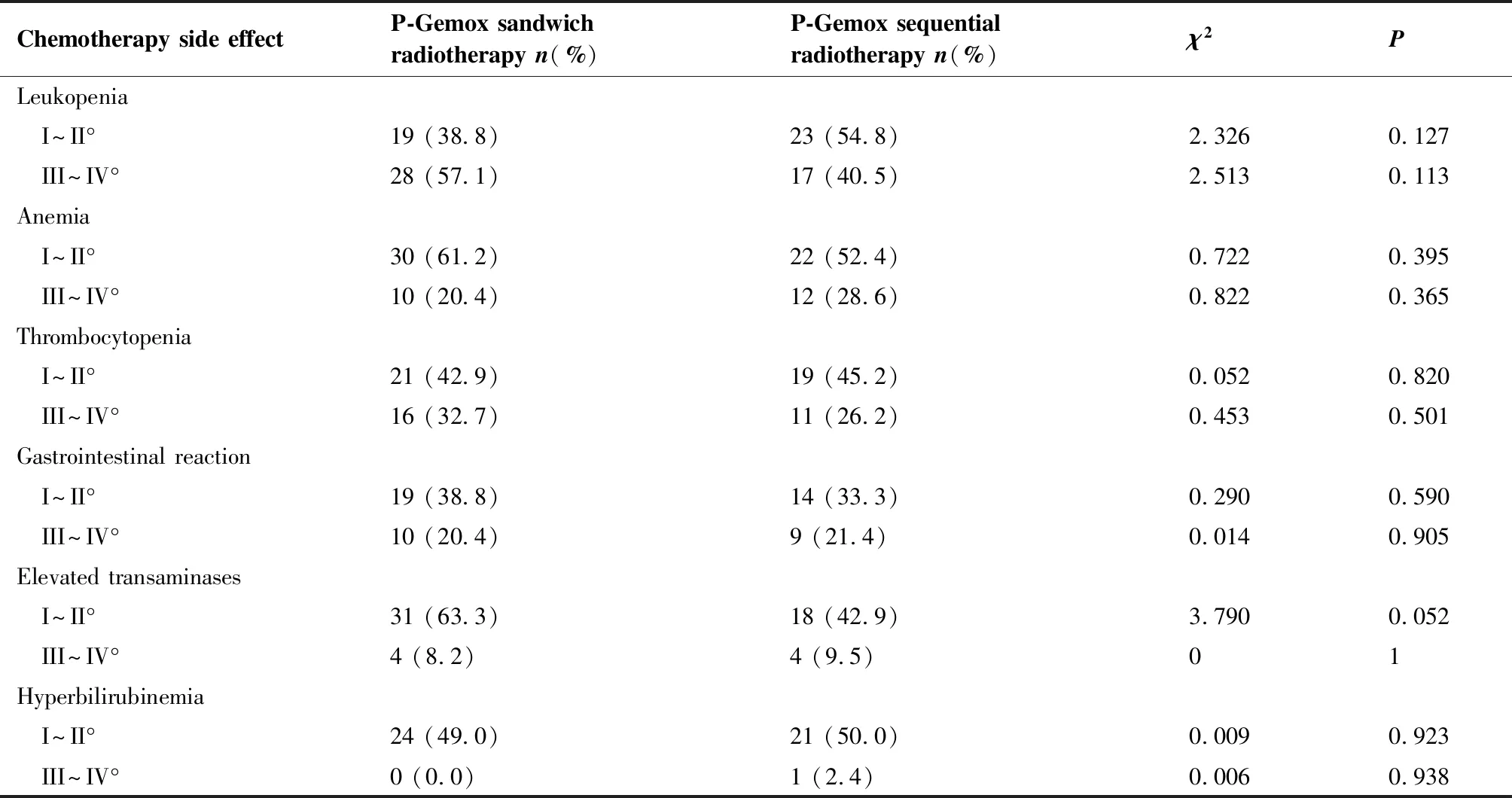
Chemotherapy side effectP-Gemox sandwich radiotherapy n(%)P-Gemox sequential radiotherapy n(%)χ2PLeukopenia I~II°19 (38.8)23 (54.8)2.3260.127 III~IV°28 (57.1)17 (40.5)2.5130.113Anemia I~II°30 (61.2)22 (52.4)0.7220.395 III~IV°10 (20.4)12 (28.6)0.8220.365Thrombocytopenia I~II°21 (42.9)19 (45.2)0.0520.820 III~IV°16 (32.7)11 (26.2)0.4530.501Gastrointestinal reaction I~II°19 (38.8)14 (33.3)0.2900.590 III~IV°10 (20.4)9 (21.4)0.0140.905Elevated transaminases I~II°31 (63.3)18 (42.9)3.7900.052 III~IV°4 (8.2)4 (9.5)01Hyperbilirubinemia I~II°24 (49.0)21 (50.0)0.0090.923 III~IV°0 (0.0)1 (2.4)0.0060.938
2.3 放疗不良反应
放疗副反应主要表现为骨髓抑制、放射性黏膜炎、放射性皮炎等。大部分以I~II°不良反应常见,III~IV°不良反应少见。3组间的I~II°白细胞减少 (P=0.028)差异有统计学意义。两两比较行Bonferroni校正显示,夹心放疗组和序贯放疗组(χ2=0.001,P=0.974)、单纯放疗组(χ2=5.608,P=0.018)差异均无统计学意义;序贯放疗组和单纯放疗组(χ2=5.364,P=0.021)差异也无统计学意义。3组间的I~II°贫血(P<0.001)差异有统计学意义。两两比较行Bonferroni校正显示,夹心放疗组和序贯放疗组(χ2=3.061,P=0.08)差异无统计学意义。而夹心放疗组和单纯放疗组(χ2=17.973,P<0.001)以及序贯放疗组和单纯放疗组(χ2=6.553,P=0.010)差异均有统计学意义。3组间的I~II°放射性皮炎(P=0.019)差异有统计学意义。两两比较行Bonferroni校正显示,夹心放疗组和单纯放疗组(χ2=6.931,P=0.008)差异有统计学意义。而夹心放疗组和序贯放疗组(χ2=5.417,P=0.020)、序贯放疗组和单纯放疗组(χ2=0.1,P=0.752)差异无统计学意义(表4)。
表4放疗副反应
Table4.SideEffectsofRadiotherapy
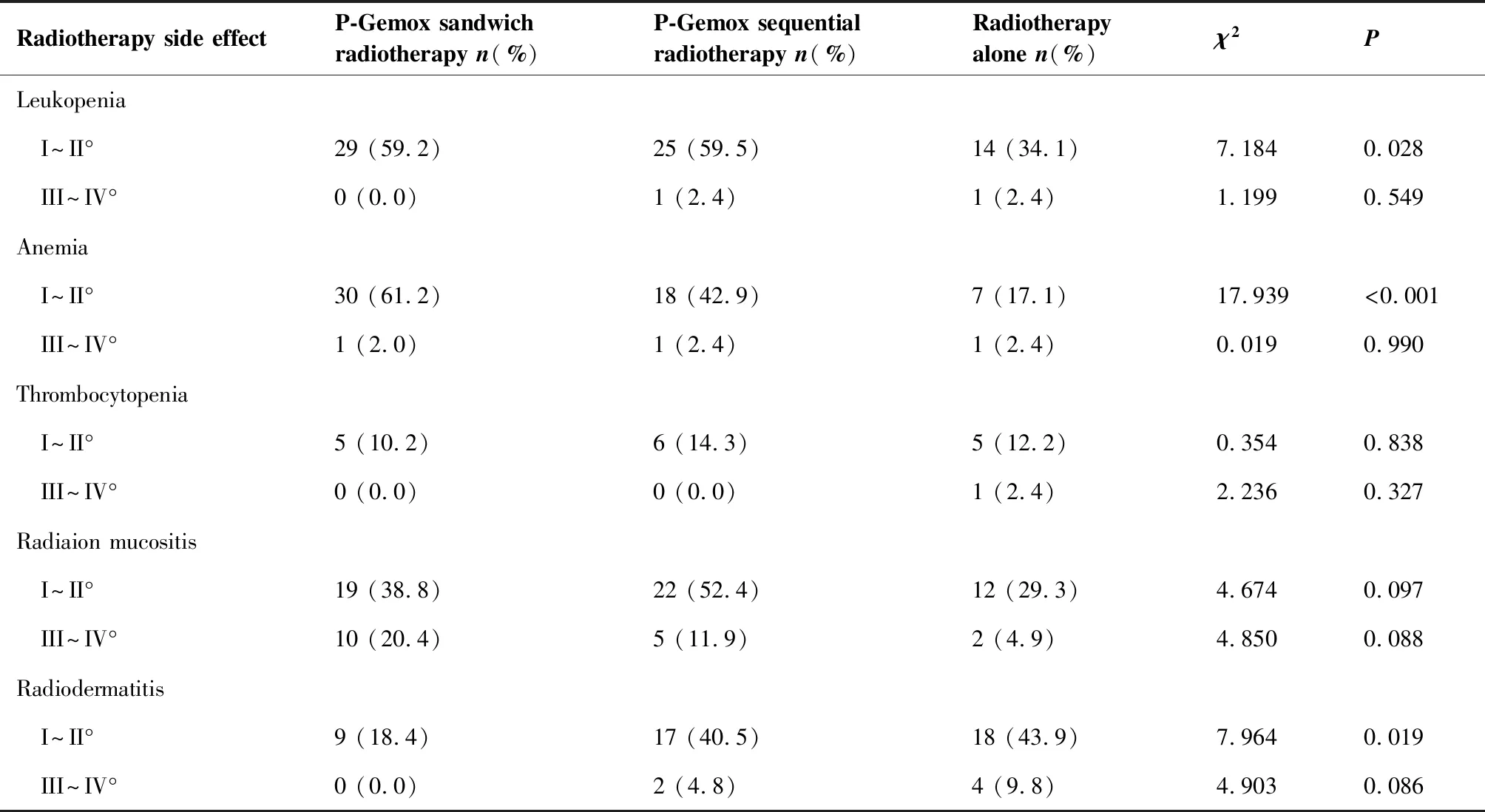
Radiotherapy side effectP-Gemox sandwich radiotherapy n(%)P-Gemox sequential radiotherapy n(%)Radiotherapy alone n(%)χ2PLeukopenia I~II°29 (59.2)25 (59.5)14 (34.1)7.1840.028 III~IV°0 (0.0)1 (2.4)1 (2.4)1.1990.549Anemia I~II°30 (61.2)18 (42.9)7 (17.1)17.939<0.001 III~IV°1 (2.0)1 (2.4)1 (2.4)0.0190.990Thrombocytopenia I~II°5 (10.2)6 (14.3)5 (12.2)0.3540.838 III~IV°0 (0.0)0 (0.0)1 (2.4)2.2360.327Radiaion mucositis I~II°19 (38.8)22 (52.4)12 (29.3)4.6740.097 III~IV°10 (20.4)5 (11.9)2 (4.9)4.8500.088Radiodermatitis I~II°9 (18.4)17 (40.5)18 (43.9)7.9640.019 III~IV°0 (0.0)2 (4.8)4 (9.8)4.9030.086
2.4 整体生存分析
随访时间截止2018年9月,随访3~109个月(中位随访31.5个月)。132例患者整体的3年PFS为58.8%(图1A),3年OS为65.8%(图1B)。

图1结外NK/T细胞淋巴瘤患者的生存曲线
Figure1.TheSurvivalCurveoftheENKTLPatients
A: The survival curve of PFS; B: The survival curve of OS
2.5 影响PFS预后因素
单因素分析显示:ECOG,LDH,B症状,分期,局部肿瘤浸润,治疗模式不同与PFS有相关性(P<0.05)。多因素分析显示:ECOG和LDH是影响PFS预后的独立因素(表5)。
表5PFS预后因素分析
Table5.AnalysisofPrognosticFactorsAffectingPFS
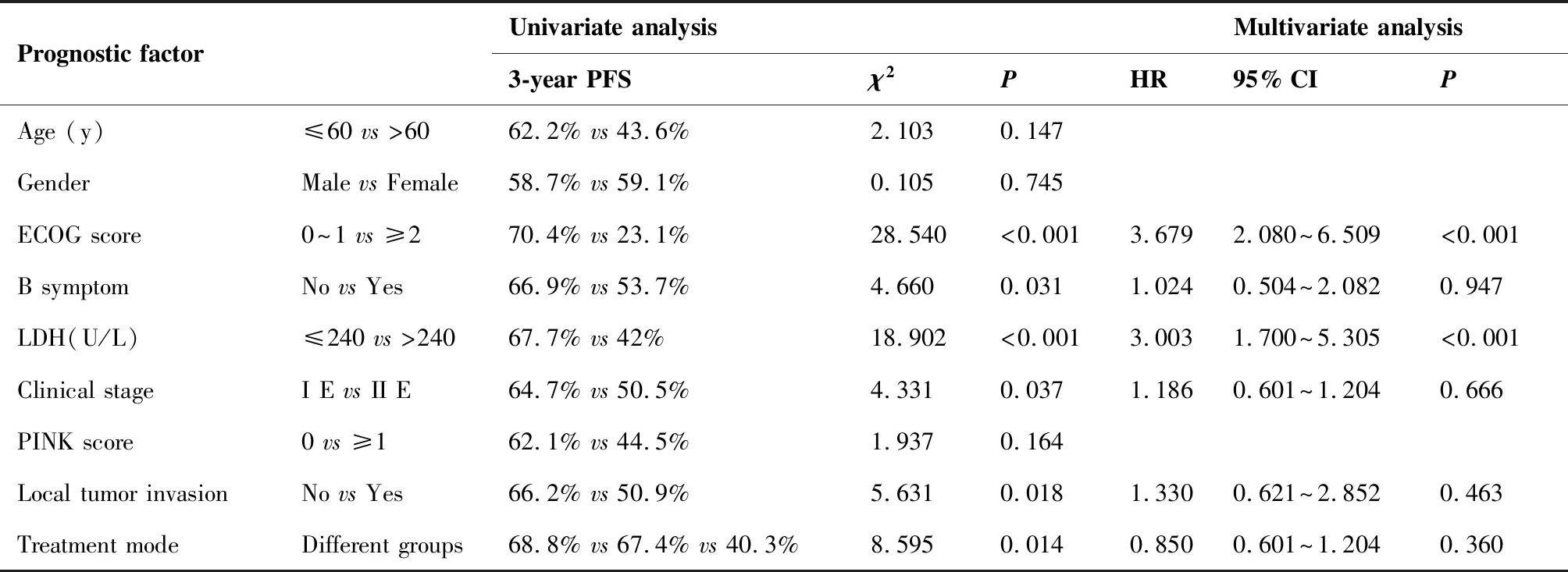
Prognostic factorUnivariate analysisMultivariate analysis3-year PFSχ2PHR95% CIPAge (y)≤60 vs >6062.2% vs 43.6%2.1030.147GenderMale vs Female58.7% vs 59.1%0.1050.745ECOG score0~1 vs ≥270.4% vs 23.1%28.540<0.0013.6792.080~6.509<0.001B symptomNo vs Yes66.9% vs 53.7%4.6600.0311.0240.504~2.0820.947LDH(U/L)≤240 vs >24067.7% vs 42%18.902<0.0013.0031.700~5.305<0.001Clinical stageI E vs II E64.7% vs 50.5%4.3310.0371.1860.601~1.2040.666PINK score0 vs ≥162.1% vs 44.5%1.9370.164Local tumor invasionNo vs Yes66.2% vs 50.9%5.6310.0181.3300.621~2.8520.463Treatment modeDifferent groups68.8% vs 67.4% vs 40.3%8.5950.0140.8500.601~1.2040.360
Different groups: the P-Gemox sandwich radiotherapy group, the P-Gemox sequential radiotherapy group, and the radiotherapy alone group
2.6 影响OS预后因素
单因素分析:ECOG,LDH,B症状,分期,年龄,PINK评分,局部肿瘤浸润,治疗模式不同与OS有相关性(P<0.05)。多因素分析显示:ECOG和LDH是影响OS预后的独立因素(见表6)。
表6OS预后因素分析
Table6.AnalysisofPrognosticFactorsAffectingOS

Prognostic factorUnivariate analysisMultivariate analysis3-year OSχ2PHR95% CIPAge(y)≤60 vs >6070.2% vs 46.5%4.3030.0381.4440.173~12.0430.734GenderMale vs Female68.2% vs 59.4%0.3540.552ECOG score0~1 vs ≥275.3% vs 37.2%32.465<0.0013.6661.741~7.7200.001B symptomsNo vs Yes71.8% vs 62.2%4.9330.0261.3470.674~2.6930.399LDH(U/L)≤240 vs >24077.2% vs 45.4%20.471<0.0013.0601.665~5.623<0.001Clinical stageIE vs IIE70.5% vs 59.2%4.6060.0321.0140.457~2.2480.973PINK score0 vs ≥170.5% vs 47.2%4.3780.0360.7680.093~5.5170.750Local tumor invasionNo vs Yes71.2% vs 59.9%6.0780.0141.2940.553~3.0290.552Treatment modalitiesDifferent groups78.7% vs 76.9% vs 44.3%9.3200.0090.8690.596~1.2670.466
Different groups: the P-Gemox sandwich Radiotherapy group, the P-Gemox sequential Radiotherapy group, and the radiotherapy alone.
2.7 不同治疗模式PFS生存曲线
夹心放疗组,序贯放疗组及单纯放疗组的3年PFS分别是68.8%,67.4%,40.3%,差异有统计学意义(图2A:χ2=8.595,P=0.014 )。两两比较行Bonferroni校正显示,夹心放疗组与序贯放疗组(图2B:χ2=0.096,P=0.756),以及序贯放疗组与单纯放疗组(图2D:χ2=4.988,P=0.026)的生存差异无统计学意义。而夹心放疗组与单纯放疗组的生存差异有统计学意义(图2C:χ2=6.653,P=0.010)。
进一步分层分析发现,对于男性患者,夹心放疗组,序贯放疗组及单纯放疗组的3年PFS分别是66.3%,74%,37.4%,差异有统计学意义(χ2=10.436,P=0.005)。两两比较行Bonferroni校正显示,夹心放疗组与单纯放疗组(χ2=5.908,P=0.015),以及序贯放疗组与单纯放疗组(χ2=7.831,P=0.005)的生存差异有统计学意义。而夹心放疗组与序贯放疗组(χ2=0.240,P=0.624)的生存差异无统计学意义。对于女性患者,3组间的PFS差异无统计学意义(χ2=1.415,P=0.493)。
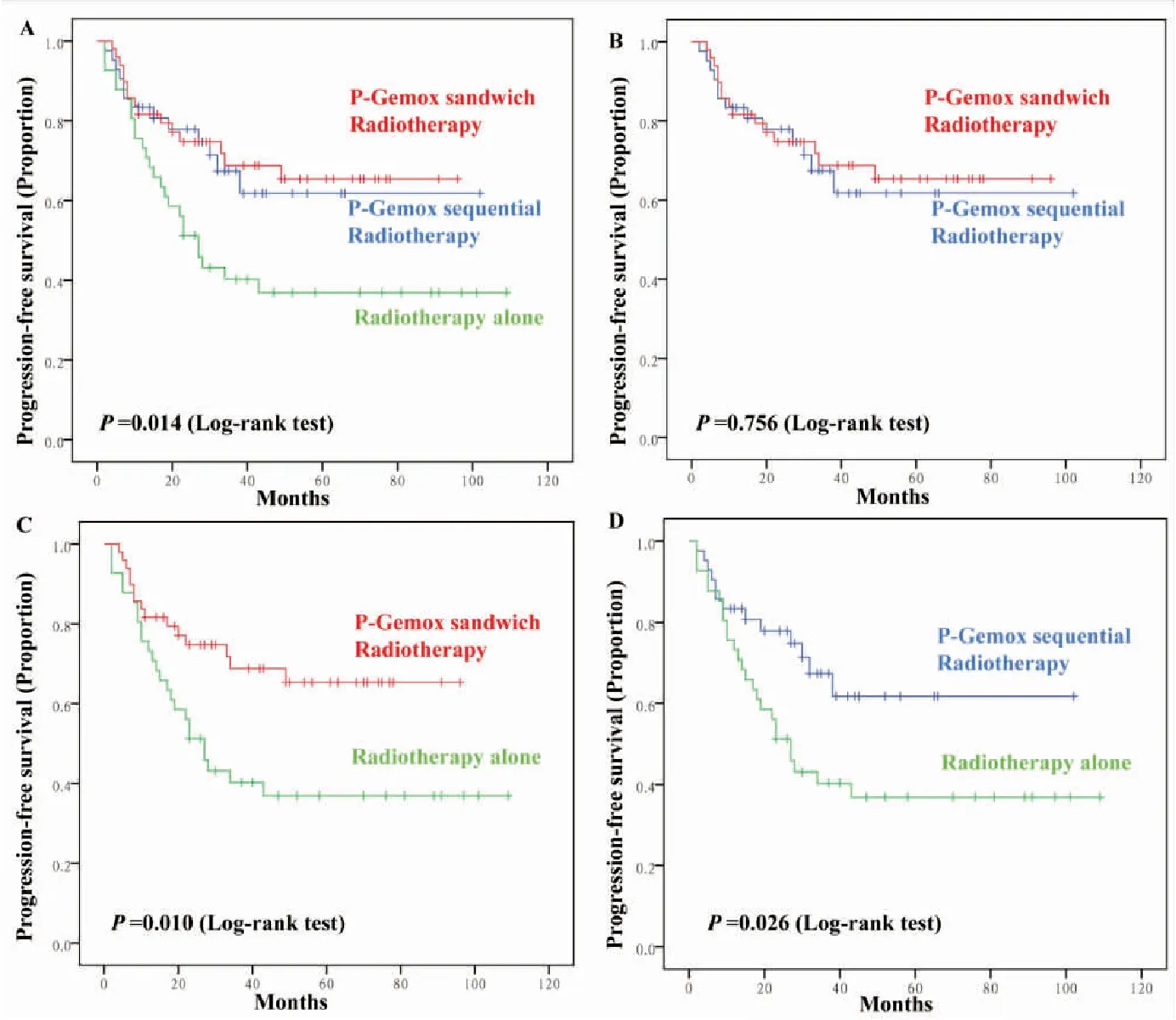
图2结外NK/T细胞淋巴瘤整体患者不同治疗模式PFS生存曲线
Figure2.ThePFSCurveofENKTLPatientsTreatedbyDifferentTherapies
A: The PFS curves of three groups; B: The PFS curves of P-Gemox sandwich radiotherapy and P-Gemox sequential radiotherapy; C: The PFS curves of P-Gemox sandwich radiotherapy and radiotherapy alone; D: The PFS curve of P-Gemox sequential radiotherapy and radiotherapy alone.
对于IE期患者,夹心放疗组,序贯放疗组及单纯放疗组的3年PFS分别是72.8%,80.8%,48.1%,差异有统计学意义(χ2=6.411,P=0.041)。两两比较行Bonferroni校正显示,3组间的差异均无统计学意义(P>0.05)。对于IIE期患者,夹心放疗组,序贯放疗组及单纯放疗组的3年PFS分别是64.7%,49.2%,18.2%,差异有统计学意义(χ2=9.745,P=0.008)。两两比较行Bonferroni校正显示,夹心放疗组与单纯放疗组(χ2=9.745,P=0.002)生存差异有统计学意义。而夹心放疗组与序贯放疗组(χ2=1.695,P=0.193),以及序贯放疗组与单纯放疗组(χ2=3.131,P=0.077)的生存差异无统计学意义。
2.8 不同治疗模式OS生存曲线
夹心放疗组,序贯放疗组及单纯放疗组的3年OS分别是78.7%,76.9%,44.3%,差异有统计学意义(图3A:χ2=9.320,P=0.009 )。两两比较行Bonferroni校正显示,夹心放疗组与序贯放疗组(图3B:χ2=0.124,P=0.725),以及序贯放疗组与单纯放疗组的差异均无统计学意义(图3D:χ2=4.878,P=0.027)。夹心放疗组与单纯放疗的差异有统计学意义(图3C:χ2=7.435,P=0.006)。
进一步分层分析发现,对于男性患者,夹心放疗组,序贯放疗组及单纯放疗组的3年OS分别是76.7%,87.4%,43.8%,差异有统计学意义(χ2=11.362,P=0.003)。两两比较行Bonferroni校正显示,夹心放疗组与单纯放疗组(χ2=6.255,P=0.012),以及序贯放疗组与单纯放疗组(χ2=8.123,P=0.004)的生存差异有统计学意义。而夹心放疗组与序贯放疗组(χ2=0.426,P=0.514)的生存差异无统计学意义。对于女性患者,3组间的OS差异无统计学意义(χ2=2.360,P=0.307)。
对于IE期患者,夹心放疗组,序贯放疗组及单纯放疗组的3年OS分别是82%,91.7%,50.2%,差异有统计学意义(χ2=8.050,P=0.018)。两两比较行Bonferroni校正显示,3组间的差异均无统计学意义(P>0.05)。对于IIE期患者,夹心放疗组,序贯放疗组及单纯放疗组的3年OS分别是76%,56.6%,27.3%,差异有统计学意义(χ2=6.758,P=0.034)。两两比较行Bonferroni校正显示,夹心放疗组与单纯放疗组(χ2=6.634,P=0.010)生存差异有统计学意义。而夹心放疗组与序贯放疗组(χ2=0.727,P=0.394),以及序贯放疗组与单纯放疗组(χ2=2.655,P=0.103)的生存差异无统计学意义。

图3结外NK/T细胞淋巴瘤整体患者不同治疗模式的OS生存曲线
Figure3.TheOSCurveofENKTLPatientsTreatedbyDifferentTherapies
A: The OS curve of three groups; B: The OS curve of P-Gemox sandwich radiotherapy and P-Gemox sequential radiotherapy; C: The OS curve of P-Gemox sandwich radiotherapy and radiotherapy alone; D: The OS curve of P-Gemox sequential radiotherapy and radiotherapy alone.
3 讨 论
结外NK/T细胞淋巴瘤,鼻型是一种少见的非霍奇金淋巴瘤,发病率较低,具有明显的地理区域和种族分布差异,北美洲和欧洲的发病率约1%,亚洲的发病率约10%[24]。该病具有侵袭性强,预后差的特点。患者就诊时绝大多数诊断为IE/IIE期,放疗在局限期患者的治疗中起了主要作用。然而,单纯放疗的治疗强度往往不够理想,容易发生复发或远处转移[3-8]。既往研究证实放疗剂量是影响患者治疗效果的因素之一,Yang等[25]报道的一项回顾性研究提出了放疗剂量与治疗效应存在相关性,对于早期患者给予不低于50Gy的放射剂量可明显提高患者局部控制率和改善预后。本研究中,所有入组患者均接受至少50Gy的照射剂量,同样取得了满意的疗效。其中单纯放疗组的CR为61.0%,ORR为80.5%,而放化疗联合组的CR接近90%,ORR均超过95%,提示了我们单纯放疗或放疗联合化疗在局限期患者治疗上的优势,与既往文献结果相似[25]。传统常规放疗副反应重,且疗效欠佳。有报道证实[26]适型调强放疗(intensity modulated radiation therapy,IMRT)在提高靶区剂量和减轻毒副作用方面优于常规放疗。放疗副作用也是我们一直关注的重点之一。本研究所有患者均接受IMRT照射获得了满意的结果,近期不良反应主要表现为轻中度骨髓抑制、放射性黏膜炎及放射性皮炎。两两比较显示,夹心放疗组较单纯放疗组更容易引起I~II°贫血和I~II°放射性皮炎,以及序贯放疗组也较单纯放疗组更容易发生I~II°贫血,差异均有统计学意义。可能与放化疗副作用累积叠加有关,均予以对症处理后恢复。其余不良反应两两比较差异无统计学意义,可能是因为一方面本研究采取IMRT照射技术,不仅提高了治疗疗效,而且减少了放疗副反应。同时间接表明了P-Gemox方案是安全可行的,增加化疗疗程并不明显增加治疗相关副作用。
既往研究发现ENKTL对蒽环类药物为基础的化疗方案耐药,疗效欠佳,预后差[9-11]。国内外众多学者着眼于新药的研究,有文献报道[12-14]以门冬酰胺酶为基础的化疗方案在ENKTL治疗中提高了临床疗效。但是,鉴于其高免疫原性,易发生过敏反应,临床使用受限制[15]。培门冬酶具有低免疫原性和安全性高的优点,已被临床推广使用。一系列研究证实[16-20]P-Gemox化疗方案治疗ENKTL的疗效满意,且副反应轻,CR约80%,ORR超过90%,2年OS达80%。本研究中,夹心放疗组CR为89.8%,ORR为95.9%,3年PFS为68.8%,3年OS为78.7%。序贯放疗组CR为85.7%,ORR为95.2%,3年PFS为67.4%,3年OS为76.9%。再次证实P-Gemox化疗方案能明显提高疗效,与文献报道较接近[16-19]。此外,夹心放疗组的CR,PFS和OS均优于单纯放疗组,且有统计学意义,这提示联合化疗可改善预后,减少远处转移。对性别行进一步分层分析发现,在男性患者夹心放疗组和序贯放疗组的PFS和OS均优于单纯放疗组,且有统计学意义。对分期进行分层分析发现,IIE期患者夹心放疗组的PFS和OS均优于单纯放疗组,有统计学意义。体现了P-Gemox化疗方案的高效低毒优点[16-20]。值得一提的是,在生存曲线分析中不难看出,夹心放疗组的生存期较序贯放疗组略显优势,但是差异无统计学意义。可能的原因是:(1)入组对象均是局限早期患者,对放化疗敏感,治疗效果满意;(2)本研究属于单中心小样本回顾性研究,随访时间相对较短。
预后模型如IPI评分[27]和韩国预后指数KPI[28]常常作为判断ENKTL预后的指标。但是,有研究证实上述预后评分在ENKTL的临床使用受限,原因是该评分建立在传统化疗方案(CHOP or CHOP-like)基础上。近来以门冬酰胺酶为基础建立的PINK评分[29]展示了良好的应用前景。我们的研究发现PINK评分与OS存在相关性,但不是独立的预后因素。分析其原因可能为:(1)该病发病率低,本研究入选标准严格,根据PINK评分绝大部分患者分为低危组(77.3%),导致分布不平衡;(2)由于疾病本身临床异质性特点,以上预后指标大部分为临床因素,并不完全体现ENKTL的临床特性;(3)本研究随访时间较短,截尾数据多,下一步有待继续随访追踪。
有文献报道[30-32]局部肿瘤浸润广、分期晚、LDH高、ECOG评分≥2的ENKTL生存期短,预后差,是影响预后的独立因素。本研究同样得出LDH和ECOG是影响预后的独立因素,与上述文献结果一致。单因素分析发现分期、局部肿瘤浸润、B症状与预后存在相关性,但不是独立的预后因素,分析原因可能是:放疗在早期患者的治疗中扮演主要角色;该病发病率低,临床病例数不足,加之纳入标准严格,全部为早期患者,而合并IIE期,有局部肿瘤浸润,有B症状者不到一半,样本量较少,分布不均衡也有一定影响。亦可能与本研究属于单中心回顾性研究,随访时间相对短,截尾数据多有关。因此,分期、局部肿瘤浸润、B症状对患者预后的影响需继续随访来进一步验证。值得注意的是,大量文献报道年龄超过60岁的患者往往生存期短,是预后不良的独立因素[30-31]。另有研究发现[33],年龄与预后不存在相关性。我们的研究单因素分析结果显示大于60岁患者的总生存期短,但不是影响预后的独立因素,与文献[33]报道相符。可能的原因为:(1)相比CHOP方案,培门冬酶为基础的P-Gemox化疗方案疗效好,副反应轻;(2)随着放射治疗技术的优化改进,使得老年人更能耐受治疗。因此,年龄是否仍是不良的预后因素值得我们继续随访观察。
化疗副作用也是我们长期以来考虑的因素之一。日本Yamaguchi等[34]学者的一项关于SMILE化疗方案治疗ENKTL的研究结果显示:有32%的患者发生III~IV°转氨酶升高,100%的患者出现III~IV°粒细胞减低。类似的,法国Jaccard等团队报道[35]AspaMetDex化疗方案治疗ENKTL,有16%的患者合并III~IV°转氨酶升高,42%的患者发生III~IV°中性粒细胞减少。本研究中,49.5%患者发生III~IV°白细胞降低,有24.2%的患者发生III~IV°贫血,29.7%的患者发生III~IV°血小板减少,8.8%的患者发生III~IV°转氨酶升高,仅1例发生III~IV°胆红素异常。对比以上SMILE和AspaMetDex方案,P-Gemox方案的疗效好,毒副作用轻,患者更能耐受。因此,P-Gemox化疗方案相对是一种高效、低毒的治疗选择。
综上,P-Gemox化疗方案联合放疗治疗早期结外NK/T细胞淋巴瘤的疗效较单纯放疗好。然而,由于该病发病率低[24],难以进行大样本临床试验研究,本研究属于单中心小样本回顾性研究,一个潜在的局限性是每个组分层下的样本量相对较少,加之本研究纳入标准严格,样本数相对不足,我们将在未来的研究里继续累积病例扩大样本量进行反复验证。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
