BR3胞外区保守结构域附近刚性区域分析①
2019-04-12张小娟冯德明李罗曼苏丽丽
张小娟 冯德明 李罗曼 苏丽丽 孙 剑
(天津大学药物科学与技术学院,天津300072)
B细胞活化因子(B cell-activating factor,BAFF),TNF家族第13位成员,在B细胞发育和T淋巴细胞激活过程中发挥重要作用[1]。BAFF可通过与B细胞上的受体结合,激活细胞内信号通路,而诱导抗凋亡因子的表达、抑制凋亡因子表达,使B细胞数量显著升高[2,3]。所以,BAFF的过量表达会致使B细胞数量增长,自身抗体表达,进而引发一系列的自身免疫疾病如系统性红斑狼疮(Systemic lupus erythematosus,SLE)、类风湿关节炎(Rheuma-toid arthritis,RA)、多发性硬化(Multiple sclerosis,MS)及B细胞恶性肿瘤[4]。
BAFF的受体有三种:钙调节剂和亲环素配体相互作用剂(TACI)、B细胞成熟抗原(BCMA)及BAFF受体(BAFF-R)。随着BAFF研究的深入,阻断BAFF与其B细胞上受体的结合,进而降低B细胞数量已成为治疗BAFF过量表达引发这类疾病的一个重要策略[5]。目前有三类被广泛研究的生物制剂用于BAFF相关疾病的治疗:受体融合蛋白,单克隆抗体和拮抗肽,其代表产品分别是Atacicept和Briobacept,Belimumab和Tabalumab,以及Blisibimod(AMG623)。但其中只有Belimumab于2011年获FDA批准上市用于治疗SLE,Blisibimod和Tabalumab目前正在接受治疗RA的临床试验,其他大多因达不到预期治疗效果而终止研究[6-9]。本实验将BR3胞外结合区分为了两部分,通过基因重组的方法构建纯化其与人IgG Fc的融合蛋白。通过ELISA结合实验和小肽竞争实验来探究胞外区对BR3与BAFF结合的影响,来阐明BR3胞外区对其与BAFF结合的作用。从而设计出高亲和性、特异性的BAFF拮抗剂。
1 材料与方法
1.1材料
1.1.1实验试剂 限制性核酸内切酶EcoRⅠ,HindⅢ和NdeⅠ(NEB);DNA聚合酶、T4 DNA连接酶、DNA和蛋白Marker(TaKaRa);引物和测序(北京三博远志公司),引物BR3-1-f(5′-TATGTGCTTCGACCTGCTGGTCCGCCACGGTGTGGCCTGCGGTG-GAGGTGGATCTG-3′),BR3-1-r(5′-AATTCAGATCCACCTCCACCGCAGGCCACACCGTGGCGGACCAGC-AGGTCGAAGCACA-3′),BR3-2-f (5′-TATGTGCGGCCTGCTGCGTACCCCGCGTCCGAAACCGGCGGTG-GAGGTGGATCTG-3′),BR3-2-r(5′-AATTCAGATCCACCTCCACCTGCCGGTTTCGGACGCGGGGTACGC-AGCAGGCCGCACA-3′);肽BR3-1(CFDLLVRHC-VAC),肽BR3-2(GLLRTPRPKPA),肽BCMA1(NEYFDSLLHACIPC),肽BCMA2(QLRCSSNT-PPLT)和肽NP(DIDFLIEEIERL-GQDL)(宁波康贝生物化学有限公司);HRP辣根过氧化酶标记的山羊抗人IgG抗体(北京中杉金桥生物科技有限公司);卡那霉素抗生素,异丙基硫代半乳糖苷(IPTG),TMB(Sigma)。其他化学试剂(国药化学试剂有限公司)。
1.1.2实验材料 大肠杆菌DH5α、BL21(DE3)、pET-30a-Fc质粒、IgG1Fc、BAFF蛋白均为天津大学药物科学与技术学院实验室储存。
1.2方法
1.2.1BR3-1和BR3-2的设计 根据BAFF-BCMA、BAFF-TACI和BAFF-BR3复合物的空间结构和序列同源性分析,在BAFF受体中有共同的保守DxL结构域,其包含6个氨基酸残基序列(F/Y/W)I-DII-XIII-LIV-(V/T)V-(R/G)VI[10]。BR3胞外区存在4个半胱氨酸(C19,C24,C32,C35),形成两个二硫键结构(C19-C32,C24-C35),我们选取包含DxL 结构域的(C24-C35)区域作为BR3-1序列,其后包含3个脯氨酸(P41,P43,P45)的序列作为BR3-2。形成了具有DxL结构域的BR3-1(CFDLLVRHGVAC,C32突变为G32以保证二硫键的正确形成)和BR3-2(GLLRTPRPKPA)。
1.2.2pET30a-BR3-1-Fc和pET30a-BR3-2-Fc融合质粒构建 根据BR3-1、BR3-2氨基酸序列设计包含NdeⅠ和EcoRⅠ酶切位点的引物片段。将上、下游引物溶解后,沸水浴3 min冷却至室温,获得BR3-1和BR3-2基因片段。利用T4连接酶将基因片段和NdeⅠ和EcoRⅠ双酶切后的pET30a-Fc载体连接,并转化入DH5α宿主菌,菌落、菌液PCR,HindⅢ单酶切鉴定阳性克隆后,将阳性重组质粒送公司测序(三博远志有限公司)。
1.2.3融合蛋白的诱导表达和纯化 将测序正确的重组质粒转化到大肠杆菌BL21(DE3)中,挑取单克隆于3 ml LB培养基中,37 ℃恒温摇床培养至OD600=0.6~0.8后,加入IPTG(终浓度为0.5 mmol/L),18℃诱导18 h,8 000 r/min离心10 min收集细胞沉淀,用40 μl磷酸盐缓冲盐水(PBS)将细胞悬浮,加入10 μl 6×上样缓冲液,煮沸后SDS-PAGE筛选目的蛋白的高表达菌株。取30 μl 保存的高表达菌株菌种于3 ml LB培养基中37℃过夜培养,然后按照1∶500接种于3 L LB培养基用于大规模培养提取目的蛋白。离心收集细菌。将细菌悬浮后反复冻融3次,在冰浴中使用高压匀质仪破菌,将破碎后菌液12 000 r/min离心20 min。离心上清过滤去除细胞碎片。过滤后的上清液加到蛋白A凝胶色谱层析柱中,用柠檬酸缓冲液(pH=3.0)洗脱结合的目的蛋白。PBS(pH=7.0)过夜透析去盐,通过SDS-PAGE分析提取蛋白质纯度。
1.2.4ELISA融合蛋白结合的活性分析和小肽竞争 BR3-1-Fc和BR3-2-Fc融合蛋白的结合活性分析,用pH=9.6的碳酸盐缓冲液稀释BAFF至10 μg/ml,加50 μl的BAFF稀释液于96孔板酶标条中,然后放置到4℃包被20 h。用PBST洗涤酶标条3次,每次5 min后,在每孔中加入150 μl 1×PBS稀释的脱脂牛奶(5% M/V),37℃放置2 h封闭。然后在每孔中加入50 μl相应浓度的融合蛋白(BR3-1-Fc、BR3-2-Fc、IgG1Fc),并在37℃孵育1 h。PBST洗涤3次后,加入50 μl 1∶5 000稀释的辣根过氧化酶标记的山羊抗人IgG抗体孵育1 h。PBST洗涤3次后,加50 μl TMB-H2O2于37℃显色10 min 后,用50 μl 20%H2SO4终止反应。使用酶标仪于450 nm测量OD值。用于检测小肽活性的ELISA竞争实验按如下方法操作:酶标条包被BAFF、洗涤、封闭如上述。在每孔中加入50 μl不同浓度的小肽和融合蛋白混合液(150 μg/ml的BR3-1-Fc),37℃孵育1 h,PBST洗涤后加入1∶5 000稀释的辣根过氧化酶标记的山羊抗人IgG抗体,按照上述步骤进行显色和终止反应,测定450 nm测量OD值,并计算小肽的抑制率。抑制率(%)=(ABR3-Fc-ABR3-Fc+肽)/ABR3-Fc×100%。
1.3统计学分析 本研究中,数据处理均采用Graphpad Pism 6.07系统软件进行,涉及小肽竞争间的数据比较采用t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1重组质粒的构建 通过引物退火的方法获得目的基因片段,将目的基因和双酶切后的pET30a-Fc连接导入DH5α感受态细胞中后。挑取菌落做PCR,阳性菌落过夜培养并提取质粒,质粒PCR产物用1%的琼脂糖凝胶电泳检测(图1),在750 bp左右出现目的条带。取PCR阳性的质粒10 μg用HindⅢ单酶切鉴定,发现没有重组目的片段的质粒pET-30a-Fc酶切后片段位置明显低于重组质粒(图2),选取阳性重组质粒进行基因测序,结果显示BR3-1-Fc和BR3-2-Fc基因构建正确。
2.2BR3-1-Fc和BR3-2-Fc融合蛋白的表达纯化 将测序正确的重组质粒导入BL21感受态细胞中,然后小样诱导筛选高表达菌株。将高表达菌株进行扩培和蛋白A凝胶亲和色谱柱纯化获得目的蛋白。根据预测,纯化的融合蛋白的大小约为28 kD,与纯化蛋白位置相符(图3)。纯化的BR3-1-Fc和BR3-2-Fc融合蛋白的产量分别为每升培养物约2.5 mg和5 mg,纯度约为90%。
2.3BR3-1-Fc和BR3-2-Fc融合蛋白结合BAFF的生物学活性 在低浓度(100 μg/ml和200 μg/ml)下,BR3-1-Fc结合BAFF的能力与BR3-2-Fc相近,但随着其浓度的增加,结合能力快速增加。当浓度达到300 μg/ml时,BR3-2-Fc的结合约为BR3-1-Fc对BAFF的57%。而作为阴性对照的IgG1Fc虽在高浓度下也具有轻微的结合活性,但OD值始终低于0.2,明显低于在相同浓度下BR3-1-Fc和BR3-2-Fc的吸光度(图4)。
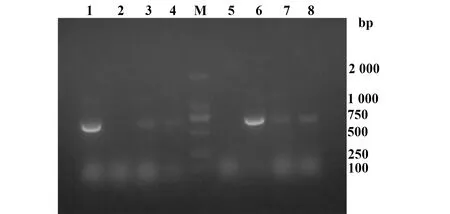
图1 BR3-1-Fc和BR3-2-Fc质粒PCRFig.1 Plasmid PCR products of BR3-1-Fc and BR3-2-FcNote: 1-4.BR3-1-Fc;M.DNA marker;5-8.BR3-2-Fc.
2.4肽抑制/增加BR3-1-Fc和BAFF的相互作用 ELISA竞争实验表明,BR3-2肽对BR3-1-Fc和BAFF结合的竞争与BR3-1、BCMA1和BCMA2小肽明显不同。BR3-1和BCMA1肽的抑制率相似,随着浓度的增加,抑制率也增加。在200 μg/ml时,BR3-1肽的抑制率达到35%,BCMA1肽的抑制率为30%。当BCMA1肽浓度增加至300 μg/ml时,抑制率达到32%高于BR3-1。BCMA2肽的抑制率始终低于10%,并且与NP没有显著差异。BR3-2在较高浓度下可以增加BR3-1-Fc与BAFF的结合,虽然NP对BR3-1-Fc的结合也存在这促进作用,但促进比率始终低于8%。且在300 μg/ml时BR3-2肽的促进比例可达20%,并与NP出现显著差异(图5)。
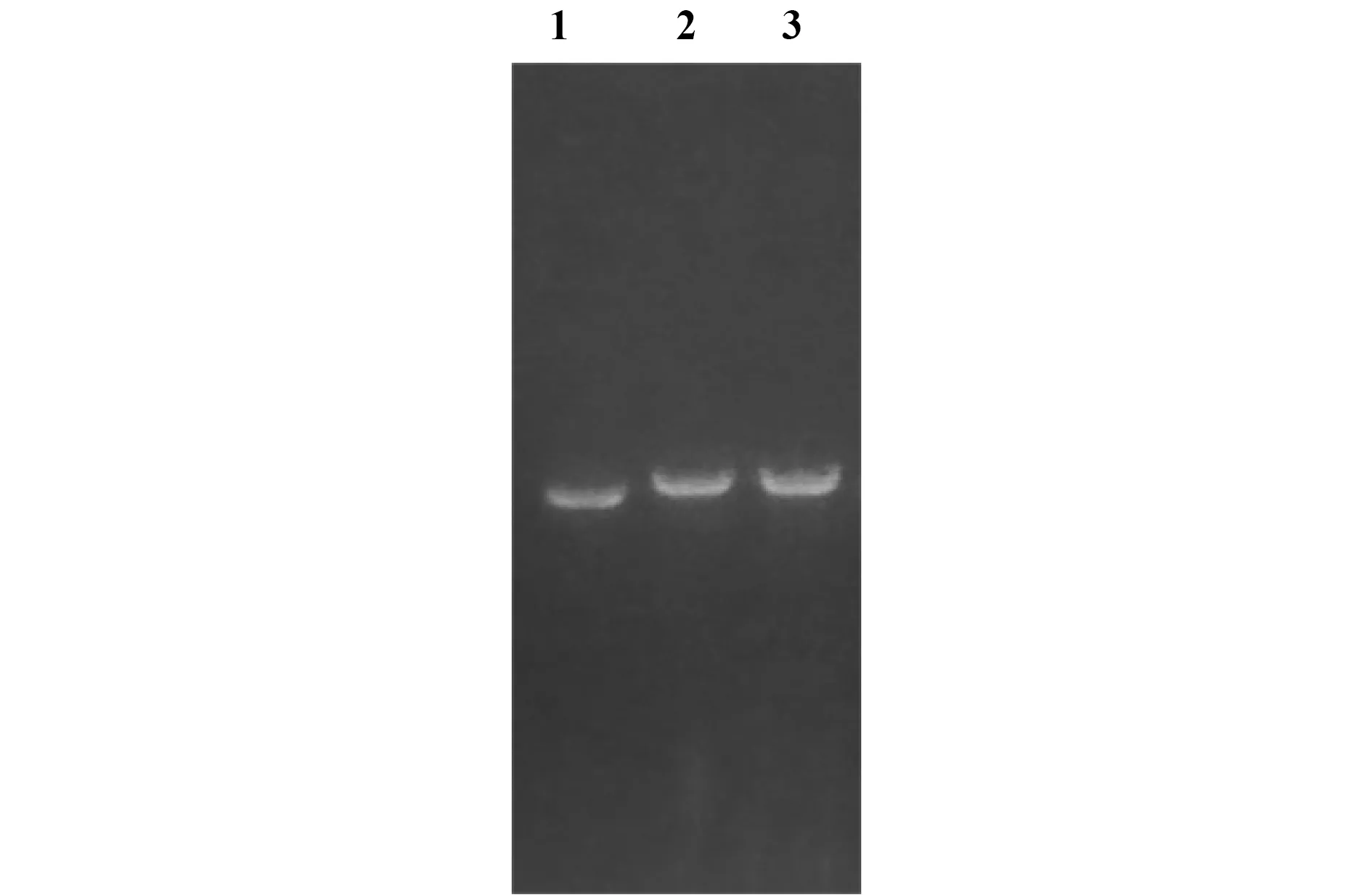
图2 BR3-1-Fc和BR3-2-Fc融合质粒单酶切Fig.2 Single restriction digestion analysisNote: 1.Fc-pET30a;2.BR3-1-Fc;3.BR3-2-Fc.

图3 SDS-PAGE鉴定BR3-1-Fc,BR3-2-Fc纯化蛋白Fig.3 Identification for purified fusion proteins by SDS-PAGENote: 1.BR3-1-Fc;2.BR3-2-Fc;M.Proteins marker.

图4 ELISA鉴定BR3-1-Fc/BR3-2-Fc与BAFF的亲和力Fig.4 Binding activity analysis of BR3-1-Fc/BR3-2-Fc to BAFF

图5 BR3-1-Fc结合BAFF的小肽竞争实验Fig.5 Peptide competitive analysis for BR3-1-Fc to BAFF bindingNote: Compare with NP group,*.P<0.05,* *.P<0.01.
3 讨论
越来越多的研究发现,外周单核细胞、树突状细胞、巨噬细胞和中性粒细胞等免疫细胞分泌表达的BAFF及其受体在部分成熟B细胞的选择和存活中发挥重要作用,BAFF结合受体后可通过诱导B细胞的增殖分化,抑制B细胞的凋亡而影响B细胞的数量和抗体表达水平。BAFF在T淋巴细胞激活等免疫过程中还可与Anti-TCR共刺激T细胞而促进T细胞增殖分化,也可以诱导T细胞分泌IL-2和INF-γ,上调活化T细胞中抗凋亡因子Bcl-2的表达量,而促进Th1细胞的功能[11]。随着BAFF研究的深入,BAFF表达水平与很多疾病的关系也逐渐被揭示。高水平的BAFF会引发一系列的自身免疫疾病,B细胞肿瘤等[12]。其他疾病如EB病毒患者,HIV患者血清中BAFF也有较高水平表达,并伴有大量的自身抗体。而低水平的BAFF则会降低抗体的表达,提高感染效率。B细胞数量的调节对免疫系统的正常运作极其重要。目前全球大约有20%的人深受各种自身免疫疾病的困扰,B细胞肿瘤和HIV患病人数也在逐年增加。因此BAFF系统相关免疫系统的探究认识对B细胞相关疾病治疗尤为重要。
当前BAFF拮抗药物的开发是一些B细胞相关自身免疫疾病最为关注的焦点。然而除2011年FDA批准Belimumab成为SLE临床治疗药物外,目前研究开发的BAFF拮抗药物如Atacicept等[13-16],普遍存在着治疗效果达不到预期等问题而被终止[17]。且大多数的这类药物只能起到缓解作用,患者关节疼痛,疲劳,风湿等症状并不能根除,10年以上的SLE患者的死亡率也仍无明显改变[18,19]。另外,目前BAFF抑制剂更倾向于清除表达BR3和TACI受体的幼稚期和过渡期B细胞。对表面广泛表达BCMA的抗体分泌细胞和记忆性B细胞影响不大。但在某些疾病中这后两种细胞的清除更加重要。因此,对于BAFF拮抗药物研究的总体趋势并不乐观,对BAFF功能和机理探究对全球疾病卫生发展仍至关重要。且研究表明BR3结合BAFF和所引发的下游细胞内信号通路不同于BCMA和TACI。BR3和BAFF结合后TRAF3被降解,释放NIK,磷酸化IKKα激活p100发生磷酸化依赖性切割以产生活性p52-Rel B复合物。而且,BAFF还通过c-myb抑制PKCδ的核移位,从而保护B细胞免于凋亡[20,21]。但对于BR3结构是如何在BR3结合BAFF后传导特异性信号还未进一步阐明。因此本实验对于BAFF特异受体BR3胞外区结构的分析,不仅可以探究BR3结构对其高亲和原因,还可以为探究BAFF结合BR3后的特异信号转导机制奠定基础。
本实验中,BR3-1-Fc和BR3-2-Fc融合蛋白与BAFF的结合活性分析实验表明BR3-1-Fc和BR3-2-Fc都能与BAFF结合,BR3-2-Fc的结合活性大约是BR3-1-Fc的一半。但二者结合活性均明显低于BR3-Fc与BAFF的结合(之前实验表明BR3-Fc融合蛋白在40 μg/ml时与BAFF结合达到饱和),BR3-1-Fc+BR3-2-Fc< 但从获得数据我们可以总结得出:BR3受体胞外区DxL 结构域附近的刚性结构区域BR3-2,在BR3高亲和性能中发挥重要作用,其结合BAFF后可能会引起BAFF的变构而增强其与受体DxL结构域的结合。据此我们可以根据BR3-2的结构探究高亲和作用机制,结合受体TACI的CRD结构域,设计出结合活性更高的选择性结合肽。为进一步加深对免疫系统中BAFF系统的认识,在生理和病理条件下更好地理解BAFF相关疾病的产生奠定基础。且实验构建纯化的BR3-1-Fc和BR3-2-Fc蛋白,为探究BR3特异性结合BAFF的研究提供了实验材料。