CRISPR-Cas9系统编辑DNA诱导基因敲除的发展及优缺点
2019-04-12张佳珊
张佳珊 谭 韬
(昆明理工大学灵长类转化医学研究院,昆明650500)
CRISPR(Clustered regularly interspaced short palindromic repeats)是一种特别的免疫系统,利用Cas9(CRISPR associated protein 9)蛋白酶进行切割,达到自身免疫的效果[1]。它是绝大部分细菌,以及一些古生菌的天然免疫系统。这篇综述分别从CRISPR-Cas9靶向敲除目的基因的原理,应用CRISPR相关的实验进行小鼠的基因编辑,CRISPR-Cas9与ZFN、TALEN、RNAi等几种不同的基因编辑技术相比的优缺点,以及如何改进CRISPR-Cas9靶向敲除的效率等五个方面论述了CRISPR-Cas9的近期状况。
1 CRISPR-Cas9靶向敲除目的基因原理
CRISPR(Clustered regularly interspaced short palindromic repeats)是古生菌等微生物本身处理外部DNA(Deoxyribonucleic acid)的系统,基本原理是由RNA(Ribonucleic acid)指导Cas9蛋白对靶向基因进行修饰。CRISPR是一种有趣的重复序列,存在于基因组中,CRISPR位点由一些较短的、高度保守的重复序列组成,重复序列之间会被长度为26~72 bp的间隔序列隔开,而序列长度通常为21~48 bp[2]。 CRISPR系统的基因识别功能,就是通过这些间隔序列实现的[3]。当CRISPR-Cas9系统去降解同源序列时,它是通过将DNA片段整理合并到CRISPR系统中,也就是降解了靶向序列,以此来实现靶向敲除等技术[4]。
CRISPR-Cas9系统的工作原理是Guide-RNA和Cas9蛋白结合形成复合体[5],简单来说,复合体担负着导向作用,引导蛋白酶在靶位点剪切目标DNA。应用特异性RNA将Cas9酶引导到基因组的靶位点上,该基因的靶位点即为需要敲除掉的基因位点,DNA的定点切割就是这样通过CRISPR系统完成的见图1。
2 CRISPR-Cas9编辑小鼠的免疫球蛋白基因
2016年,Cheong等[6]利用CRISPR-Cas9系统来编辑小鼠免疫球蛋白基因。其原理是通过Guide-RNA和Cas9结合来诱导免疫球蛋白重链(IgH)的类别转换重组(CSR),来得到需要的Ig亚型。
Cheong等[6]首先构建了一个以小鼠免疫球蛋白重链(IgH)为靶向目标的系统,利用有缺陷的小鼠B细胞,使用逆转录酶病毒载体表达Cas9。其中有缺陷的B细胞需要选择缺乏AID的B细胞[7]。AID,即活化诱导胞嘧啶脱氨酶,它是一种抗体变异蛋白,在缺乏AID小鼠的B细胞中,不能形成S区的双链DNA断裂(DSB)[8]。而CSR是须要通过DNA的切除和非同源末端连接实现的,而不能形成双链DNA断裂的B细胞无法实现非同源末端连接,也就是说缺乏AID的小鼠B细胞在自然条件下是不能完成类别转换重组的过程,所以选择了AID缺陷的B细胞来做。当Guide-RNA和Cas9结合之后,Cheong等[6]观察到一小部分B细胞从IgM转化成IgG1,生成了免疫球蛋白重链的亚型,说明CRISPR-Cas9在小鼠B细胞中进行类别转换重组成功了。
这个实验同样可以在小鼠杂交瘤细胞中重复,能够检测到IgM+,甚至水平比普通B细胞中检测到的CSR还要高[9]。结果是小鼠杂交瘤中分泌抗体ab片段,而不是完整的免疫球蛋白,这意味着,小鼠的免疫球蛋白基因可以通过CRISPR-Cas9进行基因编辑得到想要的IgH亚型或者片段[10]。
3 应用CRISPR-Cas9进行基因编辑治疗杜氏肌营养不良
2016年,Young等[11]应用CRISPR-Cas9技术成功的在小鼠身上找到了治疗人类杜氏肌营养不良的可能性。
杜氏肌营养不良(DMD)发病是由一个在人体
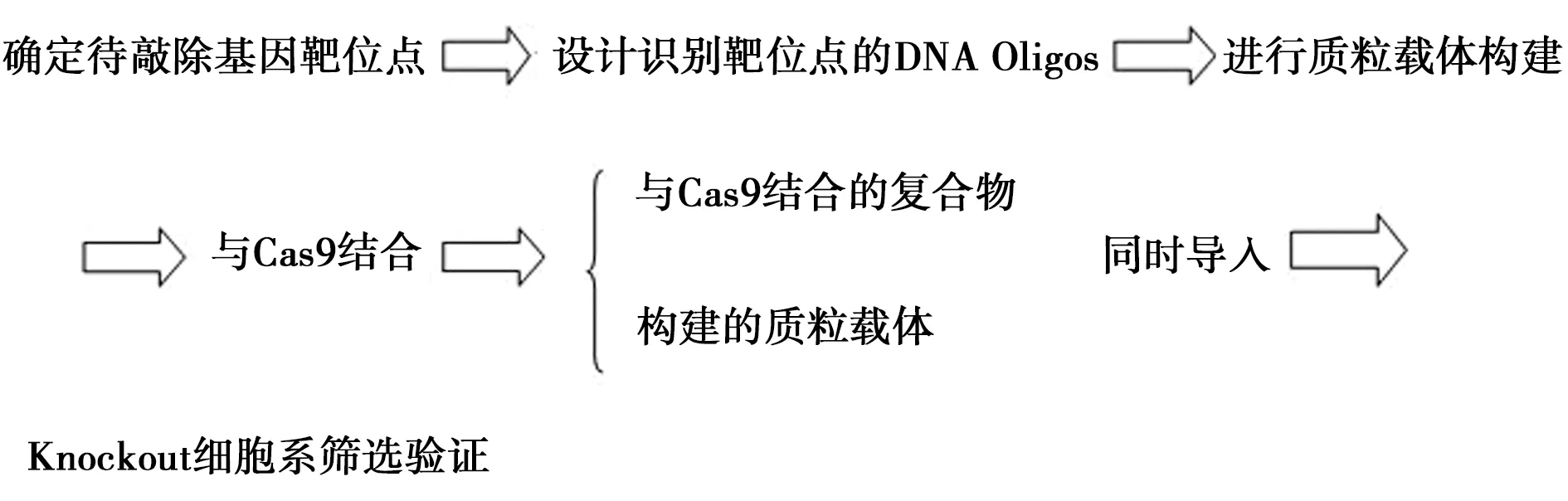
图1 CRISPR-Cas9靶向敲除目的基因的基本操作步骤Fig.1 Basic operation procedure of CRISPR-Cas9 target knockout gene
内调控肌纤维的基因突变引起的[12]。这个名为dystrophin基因的作用是帮助加强和连接肌肉纤维和细胞。
Young等[11]发现,当敲除突变基因后,母体小鼠能够生成人类dystrophin蛋白。也就是说,可以通过CRISPR技术进行基因编辑来逆转蛋白的表达,而后治疗杜氏肌营养不良患者。这个实验的成功进行,表明未来人类在治疗杜氏肌营养不良方面有所希望,可以说是应用CRISPR技术的一个最新成果,同时也是一个很大的突破。
4 经CRISPR-Cas9技术在母体小鼠体内形成嵌合体
将Cas9/sgRNA作用于受精卵的标记基因,体外发育为囊胚,注入大鼠的iPSCs,于小鼠体内培养,能够在母体内发现嵌合体[13]。基于这项技术的实验,分别敲除了小鼠的Pdx1、基因、Nkx2基因、Pax6基因(控制小鼠胰腺、心脏、眼的合成),囊胚内注入iPSCs后,母体小鼠体内形成的嵌合体分别检测到有胰腺、心脏和眼的形成[14,15]。见图2。
这项技术的成功应用,表明有基因缺陷的小鼠可以通过注射iPSCs 在母体内形成无基因缺陷的嵌合体,对于未来治疗人类由基因缺失引起的失明或者心脏病提供了一个新的思路[16]。
5 CRISPR-Cas9与不同的基因编辑方法相比的优势和不足以及发展前景
传统的基因编辑办法包括转录激活因子核效应物核酸酶(Transcription activator-like effector nuclea-ses,TALEN)、锌指核酸酶(Zinc-finger nucleases,IFN)以及RNAi等[17]。
5.1RNAi的作用机制 RNAi,即RNA干扰,是指双链RNA 被特异的核酸酶降解,产生小干扰RNA(siRNA),siRNA与同源的靶RNA互补结合,能够特异性降解靶RNA,以此达到抑制或下调基因的表达目的。但这种基因编辑方法的缺点是存在不可预知的脱靶情况[18]。
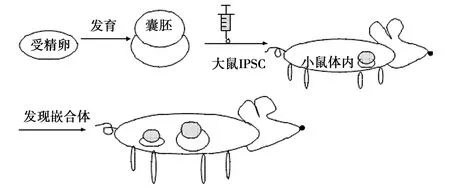
图2 经过体外培育的基因缺失囊胚,通过注射大鼠iPSCs,在母体内形成无基因缺失的嵌合体Fig.2 Gene-deficient blastocyst was cultured in vitro,by injecting iPSCs of rats,forming normal chimera in mother
5.2TALEN的作用机制 TALEN的工作原理相比RNA干扰来说更加简便可行,具体来说,是结合特定的一段DNA序列,通过切割这一序列的特定位点来造成DNA双链断裂(DSB)。在DNA的双链断裂后,通过DNA自我修复,来完成多种基因编辑功能[19]。这种技术能够广泛应用于植物、哺乳动物、人类、大鼠等多种研究对象,甚至于在CRISPR问世前,它是最主要的编辑技术。
5.3ZFN的工作原理 ZFN与TALEN类似,仍然先对DNA双链分子进行切割,形成DSB,通过应用细胞的自我修复机制来完成DNA的基因修复。
5.4CRISPR-Cas9的作用机制和原理 CRISPR-Cas9则是Guide-RNA和Cas蛋白结合形成复合体,复合体起导向作用,引导核酸酶 Cas9 蛋白在靶位点上剪切双链脱氧核糖核酸,从而完成通过CRISPR技术对 DNA 的定点切割。CRISPR作为一种新兴的基因组编辑技术,具有效率高、性价比高、敲除效果好等优点[20]。
5.5TALEN和CRISPR-Cas9的效率比较 Ding等[21]人分别利用TALEN和CRISPR-Cas9两种方法对同一基因进行了修饰,实验结果表明效率分别是0%~34%和51%~79%,通过这个结果,Ding等[21]人充分验证了CRISPR的高效性。此外从实验角度看来,CRISPR比TALEN更容易操作,因为每一对TALEN都需要重新合成,但是CRISPR技术应用中的Guide-RNA的设计则简便许多。
在另一个关于TALEN和CRISPR的效率比较的实验中,结果相差不多。Li等[22]人分别使用CRISPR和TALEN来修复DMD患者的肌营养不良基因。结果二者敲除的效率都差不多,使用T7EI酶检测脱靶,其中CRISPR包含5个脱靶位点,最高包含三对错配。在这个实验中,脱靶的效率是在可接受的范围之内的。
6 如何实现高效率的靶向敲除
CRISPR技术问世不久,就显示出其各方面的优点,比如敲除效率高、操作简便等,但同时脱靶效率很高也是CRISPR不可忽视的缺点,其中最为明显的就是Cas9会在基因组的一些脱靶位点进行剪切,脱靶的影响不容忽视[23]。Kuscu等[24]经过研究发现,CRISPR技术脱靶位点的多少主要取决于gRNA,假如Cas酶失活,那么脱靶率将大大增加。Wiles等[25]则认为CRISPR-Cas9靶向特异性是由5′端的序列以及PAM序列综合决定的。由此推断,sgRNA应当选用与基因组位点不同或不相似的序列。由此,Wiles等[25]人指出了一些可以与某些软件联合使用,来减少脱靶效应的方法:①全基因组同源性检索。但很多时候由于条件所限,全基因组测序存在一定的不可行性,此方法的实际操作性还有待考证。②在导向序列的长短上进行改进,试着将序列长度变短。③对Cas9进行基因工程改造。
7 讨论
CRISPR-Cas9能够高效发挥识别和降解入侵的外源DNA功能[26],同时,CRISPR-Cas9具有以下几个优点:①构建方便,简单快捷。②高效的介导基因定点敲入,能同时沉默任意数量基因。③前景广阔,能应用于临床医学。④价格便宜,性价比高。
众所周知,CRISPR-Cas9目前最大的缺点就是严重的脱靶性。除此之外,Cas9酶导入目的基因后的残留也是个大问题。目前并没有有效的手段在Cas9-sgRNA奏效后去除Cas9[27]。就像人会有免疫反应,如果在实验对象体内存留时间过久,可能会出现不可预知的结果。另外,CRISPR敲除的效率虽然比较高,但传代后的稳定性却不是很确定。CRISPR的修饰同时还受到PAM位点+sgRNA的限制[28]。
2017年5月,发表在Nature Methods的一篇文章,提出了CRISPR基因编辑方法的一个致命缺点:引起基因突变[29],该研究成果显示应用CRISPR-Cas9基因编辑技术可以对基因组引进很多意想不到的错误,数量上甚至可以达到数百个,其中包括基因组单核苷酸突变和基因组的非编码区域突变。正如上文提及的cas9导入后的残留可能是影响基因突变的一个重要原因,而在其他实验中没有出现如此严重的突变情况,可能的原因之一是gRNA的设计略有偏差,造成细胞分泌过量的Cas9,以至于造成了重大脱靶效应。此外,另一个可能的原因则是小鼠体内的DNA本身发生的变异,并不能完全归结到CRISPR-Cas9应用的后果上。
这项研究同时也表明,一直以来所使用的普通测序可能没有办法发现一些潜在的、重要的突变。但同时,全基因组的测序过于耗时耗力,在普通的研究和实验中是难以实现的。
总的来说,CRISPR-Cas9系统的应用范围是十分广泛的,包括基因敲除、修饰、治疗等。还可以在临床上对疾病修饰和病毒修饰做出贡献[30]。虽然伴随着一些脱靶效应的出现,但目前研究成果尚不完善,也许是由于小鼠体内细胞的一些未知变化导致的,而这些变化或许日后可以通过修改gRNA或是使用其他品系的小鼠进行改变。此外,这种大范围大规模的突变也许存在很多潜在的风险,然而在没有进行全基因组的测序发现这个问题之前,我们可以大胆假设在应用CRISPR/Cas9编辑基因后,某些点突变(Single-nucleotide variant)已经存在,更加重要的是这些突变是否影响了生物体的机能。每一种新技术的产生和应用都是一把双刃剑,必然伴随着或多或少的副作用,所以可以预测未来CRISPR-Cas9基因编辑系统仍然会对基因治疗、人类遗传病、肿瘤、癌症等的治疗做出非常大的贡献,但在进行实验研究的过程中,具体的测序方法还值得进行进一步改进。