铵(氨)循环工艺-碳氨法制备碳酸钙的研究
2019-04-12徐梓淮NafiuSadiBature范天博刘云义郭洪范
徐梓淮,Nafiu Sadi Bature,范天博,丁 杨,刘云义,郭洪范
(沈阳化工大学化学工程学院,辽宁沈阳110142)
含钙碳酸盐矿物(如方解石、石灰岩和白云石)分布广泛,储量巨大。含钙碳酸盐矿物是碳酸钙生产的核心原材料[1]。目前碳酸钙的制备方法有碳化法、纯碱法、索尔维法、尿素水解法等[2]。其中碳化法和纯碱法是传统工业常用的量产方法;索尔维法是在生产纯碱过程中,向副产物氯化铵溶液中加入氢氧化钙得到氯化钙溶液,然后用二氧化碳对其进行碳化便得到碳酸钙沉淀[3];尿素水解法是采用尿素与可溶性钙盐体系反应,利用尿素水解产生二氧化碳作为碳源来制备晶须[4]。
传统的碳酸钙工业生产方法都是利用煅烧获得的生石灰作为钙源,即使与其他化工生产过程相结合,利用其副产物进行碳酸钙的合成,也不可避免地会产生一些无经济价值的副产物和大量的温室气体。本文针对上述传统工业生产碳酸钙的特点,参考索尔维法和尿素水解法,提出一种以氯化钙为钙源、无晶形控制剂、反应条件温和的新方法,即碳氨法。本文旨在利用碳氨法,简单快速地可控合成多种形貌的碳酸钙颗粒,并讨论反应过程中碳酸钙晶体生长机理,为持续优化反应工艺和改良碳酸钙晶体性能提供基础实验数据和理论依据。
1 实验部分
1.1 试剂和仪器
试剂:无水氯化钙(分析纯);25%~28%氨水(分析纯);高纯二氧化碳气体。仪器:DF-101S型集热式恒温加热磁力搅拌器;51K60RA-CF高压反应釜。
1.2 碳酸钙的制备
配制一定浓度的氨水和氯化钙溶液,取等体积两种溶液,将两溶液同时加入密封反应器中,在200 r/min的机械搅拌下,以100 mL/min的速率通入二氧化碳气体,反应一定时间。待反应结束后,将沉淀物过滤、洗涤,置于真空干燥箱内100℃下干燥24h,然后进行表征处理。
2 结果与讨论
2.1 温度的影响
考虑到反应物浓度较高时,会因反应速率过快而难以考察温度对反应的实际影响,因此本文先在较低浓度[c(Ca2+)=0.05 mol/L,c(NH4OH)=0.4 mol/L]下,探究温度对反应产物碳酸钙结构形貌的影响。获得反应产物的SEM图如图1、2所示。从图1可看到,在40℃时形成了形貌非常规整的粒径为10~15 μm的立方型方解石,其分散性较好,且无团聚现象;从图2可以看到,在80℃时形成了长径比约为10的较为规整的棒状中石,且无明显团聚现象。对比两图所示晶体形貌,还可以得出低温利于方解石的生成,而高温利于中石的生成,且在较低浓度的前提下,40℃与80℃反应生成的碳酸钙晶体形貌更趋向于稳定的方解石和中石,而不是极不稳定的球霰石。

图1 40 ℃、c(Ca2+)=0.05 mol/L 合成的碳酸钙产品SEM图

图2 80 ℃、c(Ca2+)=0.05 mol/L 合成的碳酸钙产品SEM图
对比杨亚囡等[5]的研究,本文所用方法无明显碳酸钙团聚现象;对比许兢等[4]利用尿素水解法,在高压条件下、无晶型控制剂、反应6 h制得长径比为10~15的碳酸钙晶须的研究,本文仅在80℃、常压条件下反应1 h获得相同反应产物。
2.2 浓度的影响
为了能够与上文反应做对比实验,选择在相同温度条件下(40℃和 80℃),改变反应物浓度[c(Ca2+)=0.5 mol/L,c(NH4OH)=4 mol/L],获得反应产物的 SEM图如图3、4所示。分别将图3、图4与图1、图2对比,显示出碳酸钙形貌的变化情况。从图1和图3可知,形成的碳酸钙晶体形貌由规整的立方形方解石变成了球形的球霰石,球霰石晶体的粒径为5~10 μm,且有小范围聚集现象,从图3b可以看出,球形晶体颗粒是由小粒子堆叠形成的;从图2和图4可知,形成的碳酸钙晶体形貌由棒状中石变成了树枝状的中石。可以得出,在浓度较低时,碳酸钙晶体的生长速度较慢,更趋向于形成立方形和长棒状的晶体形貌;而在浓度较高时,碳酸钙晶体的生长速度较快,更容易发生团聚和自组装,如形成树枝状中石。且已知碳酸钙的形成是一个放热的过程,因此根据勒夏特列原理,温度的升高将使反应平衡转向反应物,同时降低二氧化碳浓度,使得反应过程更倾向于粒子生长而不是成核与转化,因此形成的碳酸钙粒子粒径都较大。

图3 40 ℃、c(Ca2+)=0.5 mol/L 合成的碳酸钙产品SEM图

图4 80 ℃、c(Ca2+)=0.5 mol/L 合成的碳酸钙产品SEM图
对比 T.J.Lee 等[6]和李丽匣等[7]的研究,本文所用碳氨法在无晶型控制剂的条件下,可以获得同种晶型碳酸钙结晶,且长径比更高,粒径更小。
2.3 晶体生长机理的研究
2.3.1 pH的变化
图5为不同反应条件下pH随时间的变化。由图5看出,随着反应的进行,溶液的pH先迅速下降,其下降趋势逐渐变缓,直到最后pH趋于不变。
对于图5 pH下降段,可以作如下解释:碳化过程开始时溶液中含有和由于氨水的存在,溶液呈现强碱性。随着越来越多的CO2溶入水中产生H+与其中与Ca2+迅速生成CaCO3并沉淀,H+会与溶液中 OH-中和而使溶液pH下降。

图5 不同反应条件下pH随时间的变化
2.3.2 3种晶型含量的变化
已知碳酸钙有3种晶体形态,方解石、中石和球霰石[8],其中方解石常温下热力学稳定性最好,在自然界中其他两种都是亚稳态,球霰石尤其不稳定[9];在25℃时,球霰石、中石和方解石的溶度积分别为1.22×10-8、4.61×10-9、3.31×10-9mol/L。固相晶体晶型转化的方式有两种,一种是固态转化[10],另一种是溶解再结晶的转化[11]。为了探究晶体生长的过程以研究反应机理,分别在反应进行的不同时间取样表征,获得反应产物的XRD图如图6、7所示。
从图6可以看出,在反应温度为40℃、反应物Ca2+浓度为0.05 mol/L的条件下,反应开始10 min时(见图6a),产品中含有大量的方解石和小部分的球霰石,而反应进行到60 min时(见图6b),产品中全部都是方解石。根据奥斯特瓦尔德定律,可以判断反应前期生成的球霰石都转化成了方解石。由图6可知,在低温低浓度的温和条件下,产物晶粒最终都将转变为方解石,因为方解石有最稳定的晶体结构,这与Q.L.Feng等[12]的研究结果相一致。
从图7可以看出,在反应温度为40℃、反应物Ca2+浓度为0.5 mol/L的条件下,反应开始10 min时(见图7a),产品中含有大量球霰石,而反应进行到60 min时(见图7b),产品中大部分仍为球霰石。可以得出较低温度和较高浓度利于球霰石的生长和稳定存在。对比图6、图7可知,球霰石晶粒的生成更主要的是由球晶型晶体作为前驱体生长所致,而不是由纳米前驱体晶体的聚集造成的,这也与J.A.Juhasz-Bortuzzo 等[13]的研究结果相一致。

图6 40 ℃、c(Ca2+)=0.05 mol/L 时,10 min(a)、60 min(b)合成的碳酸钙产品的XRD图
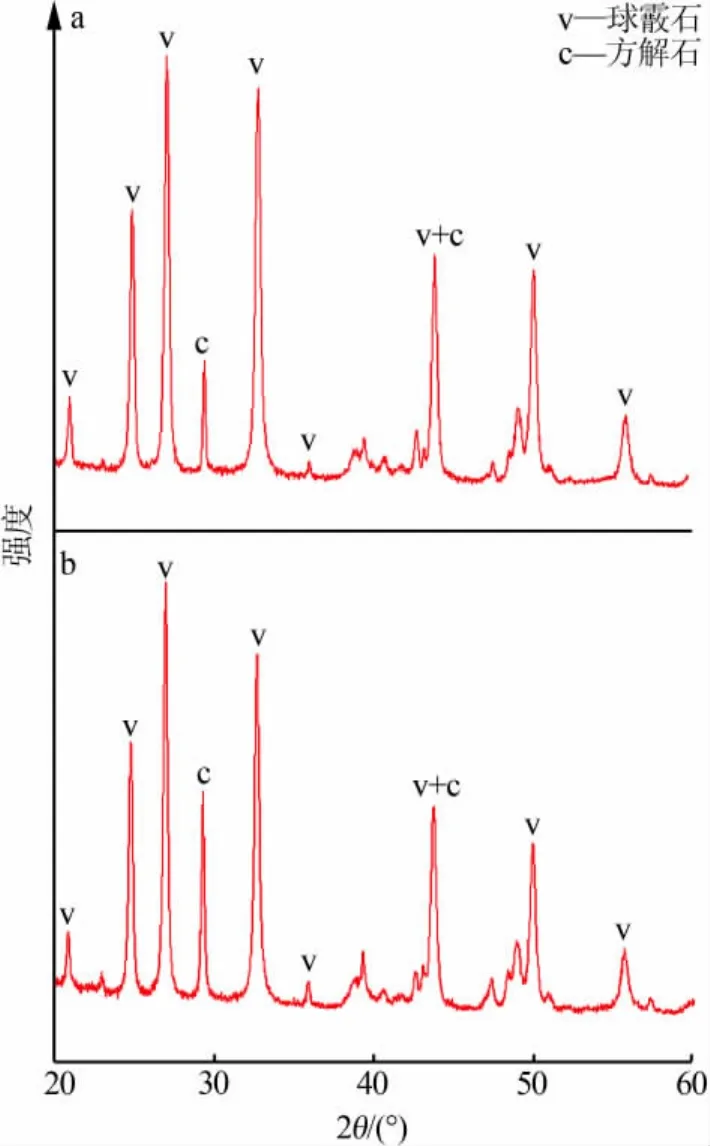
图7 40 ℃、c(Ca2+)=0.5 mol/L 时,10 min(a)、60 min(b)合成的碳酸钙产品的XRD图
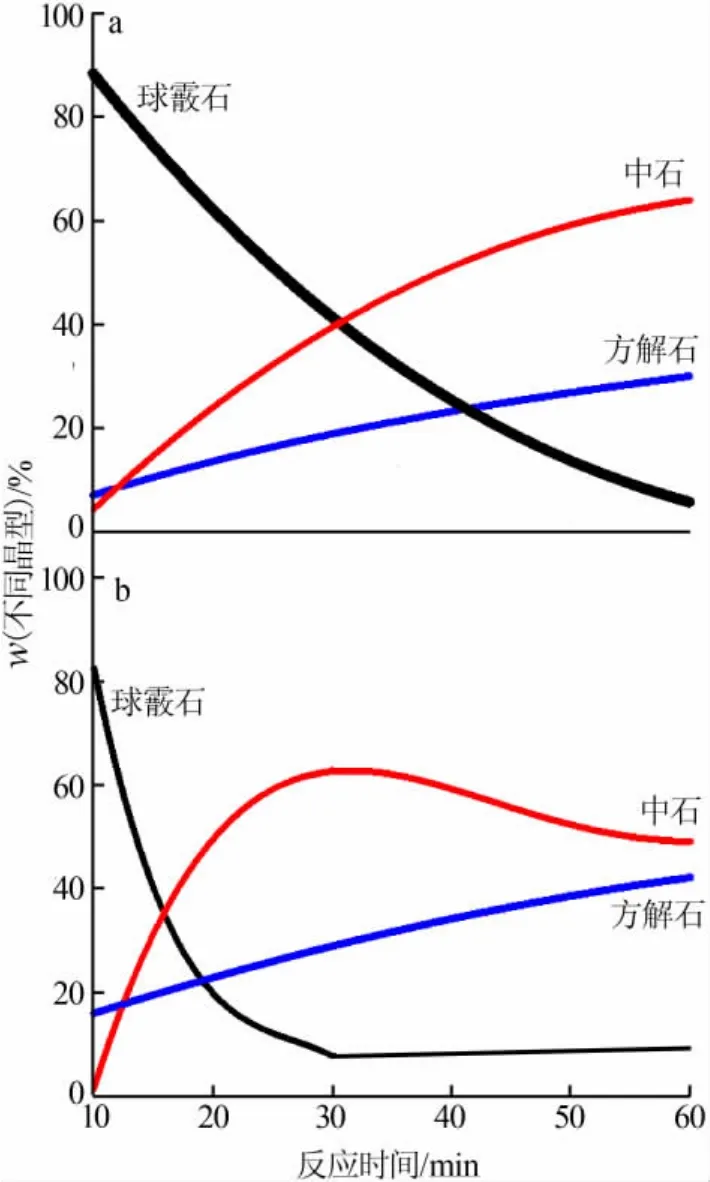
图8 80 ℃,c(Ca2+)=0.05 mol/L(a)、c(Ca2+)=0.5 mol/L(b)时合成的碳酸钙产品各晶型含量图
进而,在反应温度为80℃的条件下,对不同反应物浓度的反应进行研究,将各时间获得产物的组成测试结果以曲线图拟合的形式表现出来,如图8所示。从图8a看出,当反应物Ca2+浓度为0.05mol/L,反应开始时产物中含有大量球霰石(质量分数约为90%)和微量中石与方解石;随着反应时间的增加,中石所占的比例明显上升,与此同时球霰石所占比例同步下降,且二者含量变化速率随时间无明显改变;直到反应进行到60 min时,产物中球霰石基本消失,剩余大部分为中石(质量分数约为65%)。且在整个反应过程中方解石所占比例增长不明显且极为缓慢(质量分数从10%增加到30%)。从图8b可以看出,当反应物Ca2+浓度为0.5 mol/L,反应开始时产物中含有少量方解石和大量球霰石(质量分数约为80%)而没有中石;随着反应时间的增加,产物中球霰石所占比例迅速下降,与此同时出现大量中石,反应前20 min二者含量变化速率较高;当反应进行到30 min时,二者含量趋于稳定,球霰石基本消失,反应产物中大部分为中石(约为60%);当反应进行到60 min时,球霰石含量仍然极少,中石含量较之30 min时的峰值有所下降,与此同时,方解石含量不断增加,可以得出在这段时间里有部分中石转化成为方解石。在整个反应过程中方解石所占比例增长不明显且极为缓慢 (质量分数从20%增加到40%)。结合前人的研究结果,即中石在高温中更容易生成[14],因此可以很好地证明当温度为80℃时,球霰石转化成了中石,而不是稳定性最好的方解石。
由图8所示的两组反应分别与图6、图7所示的两组反应对比可知,在浓度相同的条件下,在较高的反应温度下,晶体结构最不稳定的球霰石更趋向于转变为棒状晶体结构的中石,而不是晶体结构最稳定的方解石。这可做出如下解释:碳酸钙的溶解度由大到小分别为球霰石、中石、方解石,它们的表面能和成核势垒必是反序的,因此亚稳结构比稳定结构具有更小的内聚能,这意味着它的表面能较低,在碳酸钙的几种晶体结构中,各亚稳结构的表面能均低于稳定结构,正符合奥斯特瓦尔德定律。同时较高的反应温度增加了反应环境的能量,有利于球霰石转化形成表面能较高的中石晶体[15]。从不稳定态到稳定态的转化方式有两种,一种是固态转化,另一种是溶解再结晶的转化。根据以上分析,在碳酸钙晶体生长过程中,晶体转化方式为溶解再结晶过程。
3 结论
本文利用碳氨法,在无晶型控制剂、反应时间为1 h的条件下,通过调控反应温度与反应物浓度,得到不同形貌的碳酸钙产品,例如形貌非常规整的立方体型碳酸钙、长径比为10~15的棒状碳酸钙和球状碳酸钙。与其他合成方法对比可发现,碳氨法制备碳酸钙工艺更加简单,反应更加迅速,无其他杂质引入,后续处理更加简单,无副产物。通过XRD和SEM分析深入探讨反应机理,得出如下结论:1)从热力学的角度分析,在较高温度条件下,由于勒夏特列原理和该反应为放热反应,反应过程更倾向于粒子生长而不是成核与转化,因此形成了较大粒径的粒子。2)球霰石晶体颗粒的产生与生长,是由球晶型前驱体生长而成,并不是纳米前驱体晶体的聚集造成的。得出矿化反应前期的结晶过程对产品晶型的选择具有明显的决定性作用。3)在反应过程中,一方面根据奥斯特瓦尔德定律和3种碳酸钙的溶解度,晶体会从亚稳态的球霰石转化到稳定态中石与方解石,另一方面根据勒夏特列原理和温度的影响,在较高的反应温度下,亚稳态的球霰石会转化成更高温下容易形成的中石,而常温下球霰石会转化成结构最稳定的方解石。综上所述,可以得出在碳酸钙晶体生长过程中,从不稳定态到稳定态的转化方式为溶解再结晶,而不是固体转化。对于不同形貌的碳酸钙的成核过程,其受温度与浓度影响极大,且随时间推移有大幅度转化。即随着时间的延长,粒径相应地变大;随着温度的升高,最终产物由方解石变为中石;随着浓度的增加,初期产物更多地为球霰石与中石。因此要想获得不同晶体形貌和不同产品特性的碳酸钙产物,应对温度、浓度和反应时间进行严格控制,并且严格控制反应初期的体系参数。
