遗传算法优化CGXII培养基提高谷氨酸棒状杆菌产L-精氨酸
2019-04-09郑穗平
王 震,张 豪,郑穗平*
(华南理工大学 生物科学与工程学院,广东 广州 510006)
L-精氨酸是一种重要的半必需氨基酸,广泛应用于食品、保健和医药工业。L-精氨酸参与多种生理过程,包括刺激激素的分泌,增强伤口愈合和参与一氧化氮的合成[1]。近20年来,提高微生物如谷氨酸棒状杆菌生产L-精氨酸的能力的方法被广泛的研究。如利用代谢工程在分子水平对菌株进行通路改造[2]和优化菌株生产环境如培养基、溶氧及pH等[3-4]。
作为菌体生长的介质,培养基的组成对于L-精氨酸的积累有着最基本、不可替代的重要作用,CGXII培养基是一种不含有机氮源的培养基[5]。有机氮源如蛋白胨、酵母膏和黄豆饼中的成分分解可以产生氨基酸等小分子,在谷氨酸棒状杆菌的生产L-精氨酸的过程中,利用不含有有机氮源的CGXII培养基可以排除有机氮源的干扰。在之前的工作中,以谷氨酸棒状杆菌(Corynebacterium glutamicum)ATCC14067为出发菌株,通过改造argB基因(268为组氨酸突变为谷氨酸)和过表达基因argG和argH得到了一株有L-精氨酸生产潜力的菌株ATCC14067-Peftu-argBH268E-argGH(BGH)[6-7]。然而谷氨酸棒状杆菌BGH在CGXII培养基摇瓶发酵72 h之后,L-精氨酸的积累量仅为0.6 g/L。因此需要进一步优化CGXII培养基的成分配比来提高谷氨酸棒状杆菌的L-精氨酸积累。
遗传算法是一种借鉴自然界生物选择进化思想的优化算法,其应用广泛,不仅可以求取目标函数的极值[8],还可以优化水中有毒物质的生物降解过程[9]。遗传算法也可以应用在培养基优化,其相较于常规培养基优化方法如单因素分析[10]、正交试验[11]、均匀设计[12]及响应面分析[13],具有优化范围广、优化参数多和搜索速度快的优点[14],在相同优化水平下,遗传算法所需的试验次数可以极大的减少,缩短优化时间,提高优化效率[15]。本试验通过遗传算法不断优化CGXII培养基组分配比,以快速提高谷氨酸棒状杆菌产L-精氨酸积累。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
谷氨酸棒状杆菌ATCC14067-Peftu-argBH268E-argGH(BGH):本实验室保藏。
1.1.2 试剂
葡萄糖、硫酸铵、尿素、磷酸二氢钾、磷酸氢二钾、七水硫酸镁、氯化钙、七水硫酸铁、一水硫酸锰、七水硫酸锌、无水硫酸铜、六水氯化镍、原儿茶酸、3-玛琳丙磺酸(3-morpholinopropanesulfonic acid,MOPs)、碳酸氢钠、琼脂糖:广州普博仪器(纽普诺博生物制品)有限公司;脑心浸液:美国BD公司;2,4-二硝基氟苯(dinitrofluorobenzene,DNFB):上海阿拉丁生化科技股份有限公司。
1.1.3 培养基
CGXII初始培养基:葡萄糖40 g/L,硫酸铵20 g/L,尿素5 g/L,磷酸二氢钾1 g/L,磷酸氢二钾1 g/L,七水硫酸镁0.25 g/L,氯化钙10 mg/L,七水硫酸铁10 mg/L,一水硫酸锰10 mg/L,七水硫酸锌1 mg/L,无水硫酸铜0.2 mg/L,六水氯化镍0.02 mg/L,原儿茶酸30 mg/L,MOPs 42 g/L。
脑心浸液琼脂(brain heart infusion,BHI)固体培养基:脑心浸液37 g/L,琼脂糖2 g/L。
BHI液体培养基:脑心浸液37 g/L。
1.2 仪器与设备
UV2350型紫外分光光度仪:尤尼柯(上海)仪器有限公司;SBA-40E生物传感分析仪:济南柏盛生物科技有限公司;5430R离心机:德国Eppendorf公司;Waters e2695高效液相色谱(配备有Waters 2489紫外分光光度计):沃特世科技(上海)有限公司;GeminiNXC18色谱柱(5 μm×250mm):广州菲罗门科学仪器有限公司。
1.3 方法
1.3.1 遗传算法参数
CGXII培养基包含15种物质成分,其中作为唯一碳源的葡萄糖和作为pH缓冲试剂的MOPs不参与遗传算法优化。考虑到遗传算法优化过程中,培养基成分的不同配比会导致菌体新陈代谢速度的改变,进而引起碳源消耗速率的改变,为了避免作为唯一碳源的葡萄糖在发酵后期被消耗殆尽,干扰遗传算法优化的结果,因此在遗传优化的整个过程中,把培养基中的葡萄糖质量浓度固定为80 g/L。作为pH缓冲试剂的MOPs固定为42g/L,使用之前用4mol/L的氢氧化钠调节pH至6.8。
遗传算法优化中,染色体代表培养基,位于染色体上的基因代表相对应的培养基组分的浓度。遗传算法优化CGXII培养基分为四个步骤,如图1所示,第一步是确定优化的培养基物质范围和优化水平,并随机创建初始种群,第二步根据初始种群的的适应度函数(本研究设定为72 h的L-精氨酸积累量),选择优良个体,第三步根据交叉规则,将初始种群所产生的优良个体进行随机交叉,第四步进行突变操作,增加基因的多样性。生成种群重复选择、交叉和突变,直到优化达到瓶颈。

图1 遗传算法流程图Fig.1 Flow chart of genetic algorithm
在本实验利用遗传算法优化培养基的设置中,种群大小固定为15,每个个体两次平行来减少误差。染色体编码采用二进制编码,每个基因的编码的长度为6位,即染色体总长度为78位。选择算法采用轮盘赌算法[16]。交叉方式为4基因的异步独立交叉,交叉概率0.8。突变方式为单点突变,突变概率0.19。
1.3.2 发酵方法
将保存的菌体BGH在BHI固体培养基平板上划线(根据需要添加25 mg/L的卡那霉素(kanamycin,Kan)抗性),30℃恒温培养36 h。挑取单菌落,接种至BHI液体培养基,30℃、250r/min培养至OD600nm≈10,转接至装有50mLCGXII培养基(遗传算法生成)的250 mL锥形瓶中,初始OD600nm控制在0.2,为避免BHI培养基干扰试验结果,转接之前4 000 r/min离心5 min并弃去上清。在30℃、250 r/min的条件下培养72 h,每隔24 h取样测量细胞干质量和残糖,72 h测量L-精氨酸产量。每种培养基两次平行,减少试验的随机误差。
1.3.3 测定方法
细胞干质量测定:取不同时期的发酵液利用分光光度仪在波长600 nm处检测吸光度值,同时取10 mL发酵液14 000 r/min离心5 min,弃上清,用0.5 mol/L(NH4)HCO3溶液重选洗涤3次[17],在110℃烘干至质量恒定并检测质量,回归拟合得到细胞干质量(cell dry mass,CDM)与发酵液OD600nm的换算关系,如公式所示:
CDM=0.306 2×OD600nm
残留葡萄糖浓度测定:利用SBA-40E生物传感分析仪进行测定残糖。
氨基酸含量测定:氨基酸的测定依据DNFB衍生法[18]。将菌液离心取上清,样品稀释5倍,之后去稀释后的液体150 μL,加入0.5 mol/L的NaHCO(3pH 9.07)150 μL,再加入DNFB溶液(准确吸取1 mL 2,4-二硝基氟苯,用乙腈定容至100 mL)150 μL。混匀,在暗处60 ℃水浴反应1 h,反应完成后暗处冷却至室温,加入1 050 μL的PBS缓冲溶液(pH7.0),暗处静置10 min,然后14 000 r/min离心10 min以去除杂质,最后用有机滤膜过滤转移至进样瓶。标准氨基酸溶液的处理同上。流动相A溶液为0.05 mol/L的乙酸钠溶液。称取无水乙酸钠4.1 g,加入超纯水990 mL,调节pH至6.8,再加入N,N-二甲基甲酰胺10 mL。有机滤膜过滤,然后超声30 min排除气泡。流动相B溶液是乙腈与水按55∶45(V/V)的体积比配制,流速1 mL/min,检测温度30℃,检测波长360 nm。
2 结果与分析
2.1 遗传算法的培养基成分优化
CGXII培养基中包含有15种成分,除去作为唯一碳源的葡萄糖和作为pH缓冲试剂的MOPs,剩余的13种培养基成分都参与了本次的遗传算法优化。在参与遗传算法优化的13种培养基成分,根据用量的多少,可以划分为大量成分和微量成分,其中硫酸铵、尿素、磷酸氢二钾、磷酸二氢钾和七水硫酸镁为大量成分,剩余8种为微量成分。在划定遗传算法对于不同的培养基成分的优化范围时,为了提高优化效率,减少优化步骤,13种培养基成分的优化范围都依据CGXII初始培养基中各个培养基成分的浓度进行划定,每种培养基成分的具体优化范围见表1。优化步长的设置与遗传算法中个体染色体上的基因长度相关,在表1中同时也给出了遗传算法的优化步长。本研究中,代表每种培养基的基因长度为6位二进制数字,即个体的染色体(包含参与优化的13种培养基基因)为78位二进制数字。

表1 CGXII培养基成分优化范围与步长Table1 Range and step size of CGXII medium components optimization
种群大小固定为15,初始种群的生成采用随机方式,通过1.3方式摇瓶发酵并检测72 h的L-精氨酸积累量,根据每个个体的精氨酸积累量进行评价并选择优良个体,常用的选择算法包括轮盘赌算法,锦标赛算法和随机遍历抽样法,本研究选用了简洁高效的轮盘赌算法。通过轮盘赌算法得到的优良个体,需进行交叉操作,来混合组成新的个体。交叉操作涉及到交叉概率和交叉基因个数[19-20],因为本次优化的培养基成分多达13种,为保证基因混合充分,交叉基因个数设定为4,并且4基因的交叉方式为异步独立交叉,交叉概率设定为0.8。通过选择和交叉操作所得的新个体,其基因都来自于初始种群,因此初始种群即限定了最终的优化结果,为了增加种群基因的多样性,引入突变操作,突变概率控制基因多样性的程度,本研究的突变概率为0.19。通过选择、交叉和突变生成新一代种群,之后不断的重复上述过程,直到新生成个体的L-精氨酸产量提升很低或者L-精氨酸积累量减少。

图2 遗传算法优化谷氨酸棒状杆菌发酵过程中L-精氨酸积累情况Fig.2 L-arginine accumulation in the fermentation process byCorynebacterium glutamicumoptimized by genetic algorithm
遗传算法生成的四代种群摇瓶发酵72 h的L-精氨酸积累值见图2。精氨酸生产过程中每代种群L-精氨酸产量的平均值和最优值对比见图3。从图2可以看出,菌株BGH在CGXII初始培养基(gen_(1~4)-0)发酵72 h后,精L-精氨酸的积累值仅为0.61g/L。而BGH菌株在初代种群的最优个体gen_1-11培养基发酵72h的L-精氨酸积累值达到了1.68g/L,第二代、第三代和第四代种群的最优个体(gen_2-13、gen_3-14、gen_4-7)在同样条件下的L-精氨酸积累值分别为1.94g/L、2.37g/L、2.12g/L。经过四代遗传算法优化,得到的最优个体为gen_3-14,BGH在gen_3-14培养基中发酵72 h,L-精氨酸积累值达到2.37 g/L,相较于CGXII初始培养基提高了288.5%。
由图3可知,虽然在最优个体上第四代种群表现不如第三代种群,但从种群整体来考虑,第四代种群L-精氨酸的平均积累值(1.60 g/L)高于第三代种群L-精氨酸的平均积累值(1.46 g/L)。说明遗传算法仍在继续富集优良基因并传递到下一代种群。

图3 发酵过程中每代种群L-精氨酸产量的平均值和最优值对比Fig.3 Comparison of the average and optimal L-arginine production of each generation population in the fermentation process
2.2 遗传算法优化过程中的生长与碳源消耗分析

图4 发酵过程中每代种群生物量的平均值和L-精氨酸积累最多个体的生物量对比Fig.4 Comparison of average biomass of each generation population and biomass of the individuals with the highest L-arginine accumulation in the fermentation process
由图4可知,在0~24 h的时间段内,随着优化的进行,种群的平均细胞干质量整体为一个下降趋势,而相对应的24~48h和48~72h的时间段内,种群的平均细胞干质量呈现一种上升趋势。具体到每代种群的最优个体(图4中的点线图),也有类似的生长模式的变化趋势。
由图5可知,在0~24 h时间段,葡萄糖的消耗量随着优化的进行而逐渐降低,24~48 h的时间段内则为增加的趋势。因为相较于积累代谢产物,菌体快速的生长繁殖过程所消耗的能量更大,图5的变化趋势进一步佐证了图4所示的生长模式的变化趋势。
这一现象说明,经过遗传算法优化之后,培养基的组成在发酵的整个过程中,都更有利于菌体保持正常的生理状态,不会因为代谢副产物的积累影响代谢功能的紊乱进而产生菌体死亡的现象。
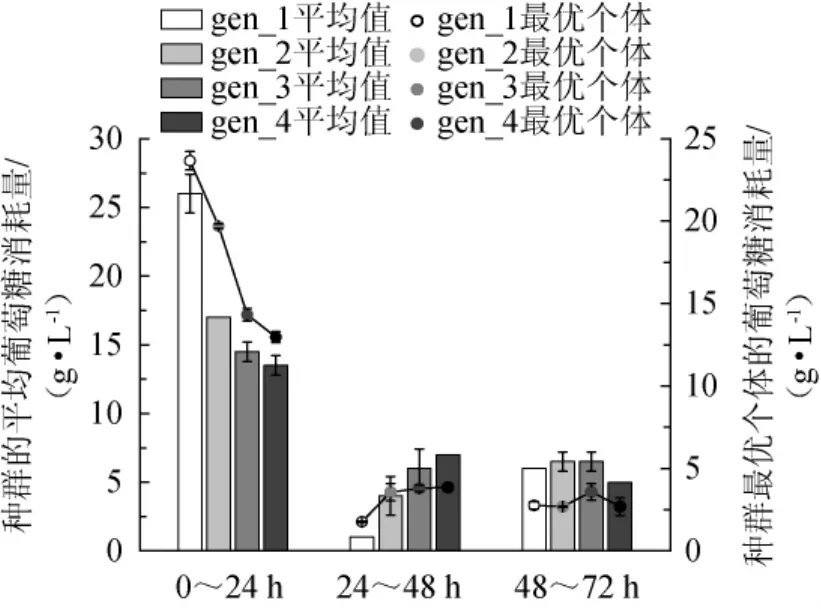
图5 发酵过程中每代种群的葡萄糖消耗量平均值和L-精氨酸积累最多个体葡萄糖消耗量的对比Fig.5 Comparison of average glucose consumption of each generation population and the glucose consumption of individuals with the highest L-arginine accumulation in the fermentation process
2.3 遗传算法优化过程中优良个体的代谢分析
谷氨酸棒状杆菌的L-精氨酸代谢简图见图6。代谢图涉及到了TCA循环上的α-酮戊二酸和草酰乙酸两个节点(即A、B框)以及糖酵解途径末端的丙酮酸节点(C框)。谷氨酸棒状杆菌BGH在遗传算法所涉及的有代表性4个培养基中分别发酵72 h后的氨基酸对比结果见图7(a、b和c分别对应代谢简图中的A、B和C框内的氨基酸)。
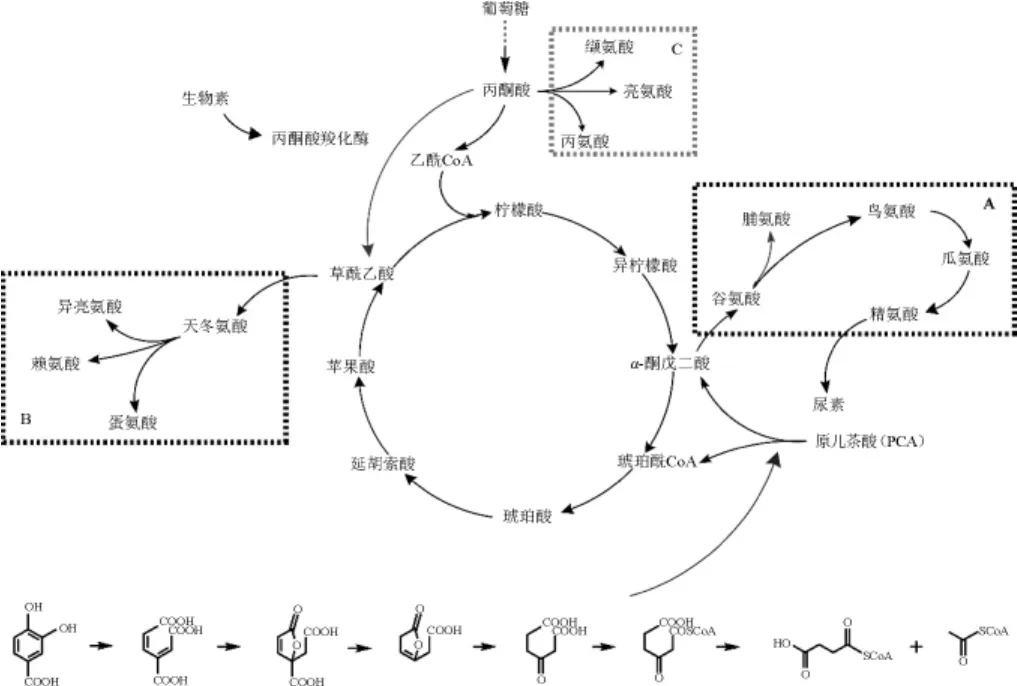
图6 谷氨酸棒状杆菌中L-精氨酸的代谢图Fig.6 Metabolic map of L-arginine inCorynebacterium glutamicum
由图7a可知,α-酮戊二酸节点上,相较于CGXII-0培养基,谷氨酸棒状杆菌BGH在另外3种培养基中发酵72 h后的谷氨酸、鸟氨酸、瓜氨酸和L-精氨酸的积累量都提高了,说明CGXII培养基的改变,增强了α-酮戊二酸转化为L-精氨酸的代谢途径。另外,培养基优化前后的脯氨酸产量都为0,谷氨酸积累速度的提高对于脯氨酸的代谢并未产生任何影响。由图7b可知,谷氨酸棒状杆菌BGH在遗传算法优化之后的培养基中发酵72 h后,草酸乙酰节点下的天冬氨酸以及以草酸乙酰为前提的赖氨酸,蛋氨酸和异亮氨酸,相较于优化前培养基CGXII-0都有不同程度的提高。然而,在糖酵解途径末端的丙酮酸节点下的丙氨酸。缬氨酸和亮氨酸,相较于CGXII优化之前,积累量都明显下降。

图7 四种培养基的氨基酸代谢对比Fig.7 Comparison of amino acid metabolism in four kinds of media
通过遗传算法的培养基优化,TCA循环上的α-酮戊二酸和草酰乙酸这两个节点下的氨基酸的积累量都有所提高,丙酮酸作为糖酵解末端的生成物质,也是TCA循环上的乙酰辅酶A的前提物质,其节点下的氨基酸的积累量都明显减少。可见,对于谷氨酸棒状杆菌BGH,遗传算法优化之后的培养基相较于初始CGXII培养基CGXII-0,可以促进丙酮酸转化为乙酰辅酶A,抑制丙酮酸转化为丙氨酸、缬氨酸和亮氨酸,增强了TCA循环及相关代谢支路。糖酵解的丙酮酸节点的氨基酸分流减弱和TCA循环增强的代谢水平改变规律,或许可以为L-精氨酸以及其他氨基酸的基因工程育种提供一个很有潜力的方向。
3 结论
通过遗传算法优化CGXII培养基,得到更有利于谷氨酸棒状杆菌BGH积累精氨酸的新培养基CGXII-gen_3-14,L-精氨酸产量从0.61g/L提升至2.37g/L。遗传算法优化之后的培养基,更有利于谷氨酸棒状杆菌的生长。通过进一步的代谢分析发现,遗传算法优化的培养基减少丙酮酸支路氨基酸的积累,增强TCA循环的流量,从而使L-精氨酸的产量提高。
