一株猪肺炎支原体的分离鉴定
2019-04-09潘建刚陈波周明光徐高原
潘建刚,陈波,周明光,徐高原
(武汉科前生物股份有限公司,武汉 430070)
猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)是引起猪气喘病的主要病原[1],该病在世界范围内广泛流行,我国地方猪种和杂交猪种尤为易感,几乎普遍存在,造成了重大损失。猪群一旦感染Mhp,便难以清除[2],可继发感染PRRSV、PCV2 等[3-4],从而导致多种疫苗接种失败。由于猪肺炎支原体对营养要求苛刻,使得其体外分离培养难度很大[5-6];同时在分离过程中还易受猪鼻支原体(Mycoplasmahyorhinis,Mhr)的影响[7],给本病的研究工作带来了困难。本试验从全国部分猪场采集到的疑似猪支原体肺炎病变肺脏中成功分离获得1株猪肺炎支原体,以期为猪支原体肺炎疫苗的研究提供必要条件和有利数据。
1 材料与方法
1.1 材料
1.1.1 病料来源 疑似猪支原体肺炎的发病猪肺脏采集自全国部分猪场,肺脏的尖叶、心叶、中间叶或膈叶前缘有不同程度的对称性病变,呈“肉样变”、“胰样变”,共12 份。
1.1.2 猪肺炎支原体培养基 由武汉科前生物股份有限公司制备。
1.1.3 细菌基因组DNA提取试剂盒 购于北京庄盟国际生物基因科技有限公司。
1.1.4 试验动物 3周龄仔猪,购自华农试验种猪场,母猪未注射猪支原体肺炎疫苗,经IDEXX试剂盒检测仔猪血清中猪肺炎支原体(Mhp)、猪圆环病毒( PCV2)、猪繁殖与呼吸障碍综合征病毒( PRRSV) 抗体阴性。
1.1.5 猪肺炎支原体阳性血清 本实验室从北京生泰尔生物科技有限公司购进的猪肺炎支原体J株制备兔抗猪肺炎支原体特异性血清,琼扩效价为1∶32,批号为170502。
1.1.6 猪鼻支原体阳性血清 从中国兽医药品监察所菌种保藏中心购进的猪鼻支原体BTS-7株制备兔抗猪鼻支原体特异性血清,琼扩效价为1∶16,批号为170301。
1.1.7 攻毒用强毒株 猪肺炎支原体(济南系强毒CVCC354株),F3代,由武汉科前股份有限公司复壮、保管和供应。
1.2 方法
1.2.1 病料采集 将采集的12份病料分别用含800 U/mL青霉素的PBS洗去血液和组织碎片,无菌操作剪取有猪喘气病特征病变和将健康交界处的肺组织进行PCR鉴定和供分离培养。
1.2.2 病料PCR鉴定
1.2.2.1 病料DNA提取 取约0.5 g病料,剪碎后匀浆器加2.0 mL水研磨成糊状,先3000 r/min离心5 min,上清再以13000 r/min离心20 min,弃上清,沉淀用250 μL PBS重悬。用细菌基因组DNA提取试剂盒提取重悬液DNA,-20 ℃以下保存备用。
1.2.2.2 PCR鉴定 PCR引物按参考文献方法进行合成[8]。猪肺炎支原体引物序列:P1:5'- TTACAGCGGGAAGACC-3';P2:5'-CGGCGAGAAACTGGATA-3';PCR扩增体系:10×buffer 5.0 μL,dNTP(2.5 mmol/L)4.0 μL,引物P1(10 μM)1.0 μL,引物P2(10 μmol/L)1.0 μL,模板DNA 2.0 μL,Taq酶(5 U/μL)0.25 μL,加注射用水至50 μL;反应条件为:95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,30个循环,72 ℃终延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳。预计扩增片段长度约为427 bp。
1.2.2.3 多重PCR鉴定 多重PCR引物按参考文献方法进行合成[9-10],引物序列:Mhp-f:5'-TTCAAAGGAGCCTTCAAGCTTC-3';Mhr-f:5'-CGGGATGTAGCAATACATTCAG-3';M-r:5'-AGAGGCATGATGATTTGACGTC-3';多重扩增体系:10×buffer 5.0 μL,dNTP(2.5 mmol/L)4.0 μL,上游引物均为(10 μmol/L)0.8 μL,下游引物为(10 μmol/L)1.2 μL,模板DNA 2.0 μL,Taq酶(5 U/μL)0.25 μL,加注射用水至50 μL;反应条件为:95 ℃预变性2 min,94 ℃变性30 s,55 ℃ 退火50 s,72 ℃ 延伸1 min,35个循环,72 ℃终延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳。预计猪肺炎支原体扩增片段长度约为1000 bp;猪鼻支原体扩增片段长度约为1129 bp。
1.2.3 病原的分离 将病料研磨后过滤,接入含10%猪鼻支原体特异性血清、800 U/mL青霉素的猪肺炎支原体液体培养基中,置37 ℃培养。每间隔7日盲传1次,每天观察培养基颜色变化,前3代均加入10%猪鼻支原体特异性血清。在培养时,将培养基颜色发生改变,传代可出现pH规律性下降的培养菌液进行鉴定,剩余培养菌液于-20 ℃以下冻存。
1.2.4 病原的PCR鉴定及测序 将经培养传代分离的菌株提取基因组DNA,按1.2.2.2方法进行PCR 扩增,扩增产物经1%琼脂糖凝胶电泳。回收产物送往擎科公司测序。
1.2.5 形态观察 按常规方法对分离菌株进行瑞氏染色,普通光学显微镜下观察菌体形态特征。
1.2.6 生化特性 将临床分离株进行尿素酶活性测定;葡萄糖分解试验;精氨酸水解试验;三苯基氯化四氮唑( TTC)试验;七叶苷水解试验;甘露醇分解试验;膜和斑形成试验。生化实验按参考文献[11]方法进行。
1.2.7 血清学特性 生长抑制试验:将直径为6 mm的圆形滤纸片用未经稀释的抗血清浸泡后放入无菌平板内,4 ℃干燥待用。吸取待检菌株的菌液0.1 mL涂布于固体平皿中,放置37 ℃使琼脂表面稍干燥,无菌夹取抗血清滤纸片贴于琼脂表面,37 ℃培养10日。在低倍显微镜下观察,当滤纸片周围无菌落生长,出现抑制带大于1.0 mm时,判为猪肺炎支原体阳性。
1.2.8 致病性分析 将分离菌株菌液分别经气管注射3周龄仔猪4头,5 mL/头(109CCU)。另设4 头条件相同的对照猪,各气管注射培养基5 mL,作为对照。试验猪、对照猪隔离饲养。每天观察发病情况,并于注射后28 d全部剖杀,观察肺部病变,根据Goodwin氏55分评分法对试验仔猪的肺脏病变进行打分[12]。取部分病变组织置于10%的甲醛溶液固定,随后进行石蜡包埋、切片和HE 染色等一系列病理切片制作流程后,在显微镜下读片,观察组织病理变化,了解菌株对仔猪的毒力,记录试验结果。
1.2.9 免疫原性试验 将分离株菌株浓缩纯化、灭活后与佐剂混合制备灭活疫苗,将疫苗分别颈部肌肉注射3周龄仔猪4头,2.0 mL/头(109CCU),接种后21 d,按相同途径、相同剂量二免。另外4头不接种作为对照,同条件下饲养。二免14 d,连同对照猪4头,各气管注射猪肺炎支原体(济南系强毒CVCC354株)冻干肺组织毒5 mL(含0.5 g病肺组织),每日观察仔猪临床症状,攻毒后28 d,扑杀全部仔猪。按55分法对各仔猪的肺部喘气病病变进行评分,计算肺炎病变减少率。
2 结 果
2.1 病料PCR鉴定 12份病料,其中4份病料检测出有猪肺炎支原体(图1)。
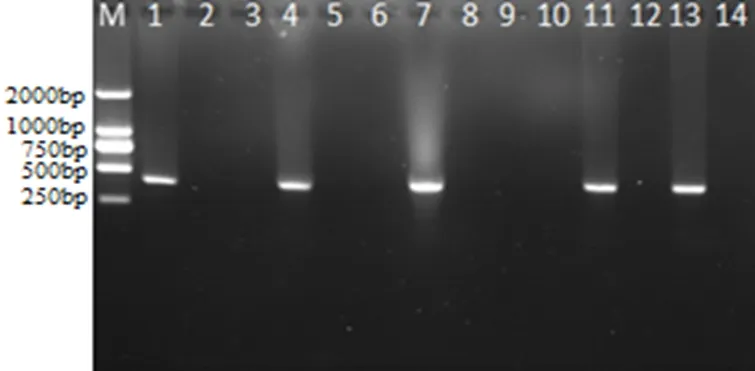
M: DL2000 DNA Marker; 1: 阳性对照;2: 阴性对照; 3-14: 病料样品M: DL2000 DNA Marker; 1: Positive control;2: Negative control; 3-14: Tissue samples图1 肺组织PCR检测结果Fig 1 PCR results for the lung tissues
2.2 病料多重PCR鉴定 4份阳性病料经过多重PCR检测都能扩增出长度约为1000 bp猪肺炎支原体目的片段,但其中有3份阳性病料还扩增出长度约为1129 bp猪鼻支原体目的片段(图2)。
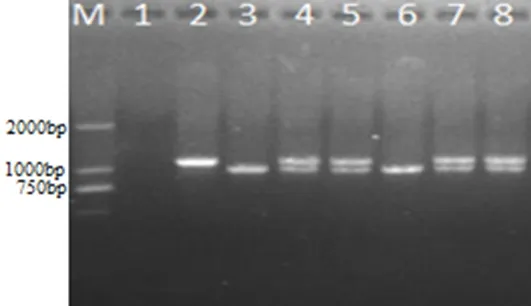
M: DL2000 DNA Marker; 1: 阴性对照;2: 猪鼻支原体阳性对照; 3: 猪肺炎支原体阳性对照; 4: 猪鼻支原体阳性对照、猪肺炎支原体阳性对照; 5-8: 病料样品M: DL2000 DNA Marker; 1: Negative control; 2: Positive control(Mhr); 3: Positive control (Mhp); 4: Positive control (Mhr、Mhp); 5-8: Tissue samples图2 阳性病料多重PCR检测结果Fig 2 Multiple PCR results for the positive samples
2.3 病原分离 取只含有猪肺炎支原体的1份病料,研磨后进行分离、培养传代,传至第3代时,培养基颜色发生改变,接着传至第8代,菌种能在培养基上稳定生长,pH规律性下降,生长时间稳定在3~4 d,活菌滴度可达109CCU/mL。
2.4 病原PCR鉴定 菌株扩增结果与预期片段427 bp大小一致(图3)。测序结果通过NCBI BLAST比对,分离株P36基因序列与猪肺炎支原体J株和168株同源性分别达99%以上,从分子水平上证明了分离的菌株为猪肺炎支原体。
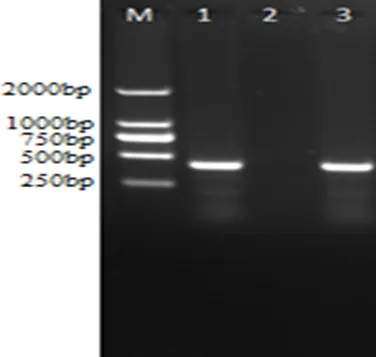
M: DL2000 DNA Marker; 1: 阳性对照; 2: 阴性对照; 3: 分离菌株M: DL2000 DNA Marker; 1: Positive control; 2: Negative control; 3: Isolated strain图3 菌液PCR检测结果Fig 3 PCR results for the bacterial fluid
2.5 形态学特性 分离猪肺炎支原体菌株经过瑞士染色,镜检,观察到特征性的多形态,有点状、环状、球状和两极状(图4)。
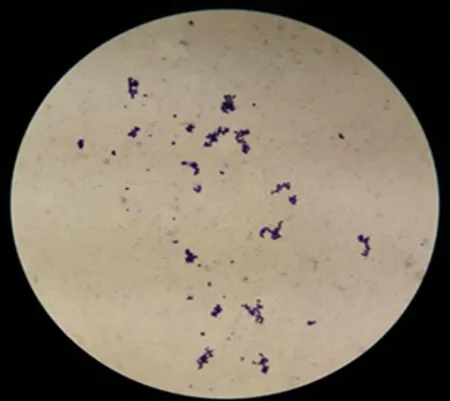
图4 瑞士染色结果(100×)Fig 4 The results of wright's stain(100×)
2.6 生化特性 分离菌株生化反应与猪肺炎支原体生化特性相符(表1)。

表1 分离菌株生化试验Tab 1 The biochemical tests of isolated strain
“ +” 阳性; “ -” 阴性
“ +” Positive; “ -” Negative
2.7 生长抑制 吸有抗血清的滤纸片周围出现了直径为2.6 mm的抑菌圈,验证分离的菌株为猪肺炎支原体。
2.8 致病性 攻毒组猪气管内注射5 mL分离株菌液后,大部分猪出现咳嗽、喘气等临床症状,对照组无症状(表2);剖检攻毒猪,发现肺脏的尖叶、心叶前端有部分对称性的肉样变化(02号和04号攻毒猪肺脏如图5所示);攻毒组猪肺脏病变组织制片经过HE染色后,在显微镜下观察,肺间质增宽、增厚,肺泡内有大量炎性细胞浸润(02号和04号攻毒猪肺脏病变组织切片如图6所示),以上说明分离的猪肺炎支原体具有一定的致病性。
2.9 免疫原性 免疫组猪临床观察基本正常,对照组猪有支原体肺炎典型咳嗽、喘气的临床症状,根据肺炎病变打分,免疫组平均肺炎病变减少74.51%(表3);剖检试验猪,免疫组和对照组肺部有明显差异,免疫组猪肺组织病变不明显,对照组病变严重,肺脏的尖叶、心叶前缘有严重的对称性病变,呈“肉样变”、“胰样变”(12号免疫组猪,18号对照组猪肺脏如图7),以上说明分离的猪肺炎支原体具有很好的免疫原性。

表2 临床症状和肺病变得分结果Tab 2 The clinical manifestation and score of pathologe variation of piglets lung

图5 肺脏临床解剖图Fig 5 Clinical anatomy of lung

图6 肺脏病理切片观察(HE 40×)Fig 6 Observed of pathophysiology of lung(HE 40×)
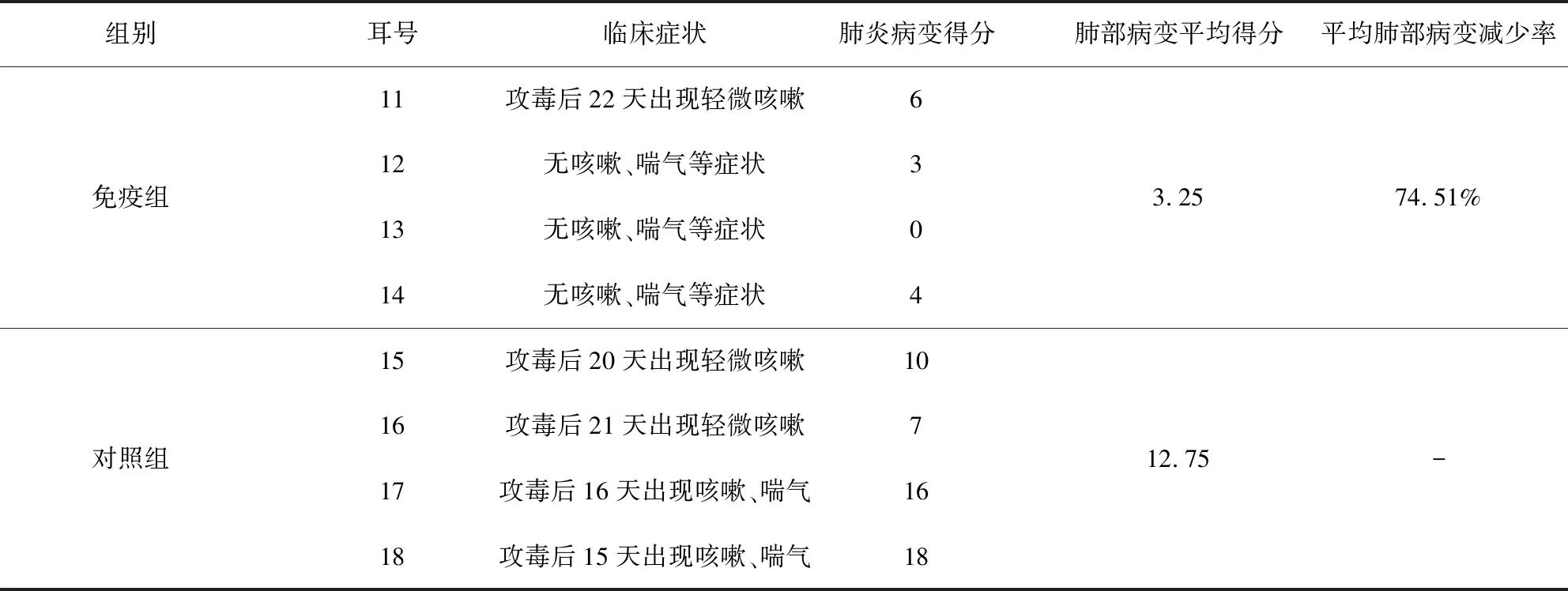
组别耳号 临床症状肺炎病变得分肺部病变平均得分平均肺部病变减少率免疫组11攻毒后22天出现轻微咳嗽612无咳嗽、喘气等症状313无咳嗽、喘气等症状014无咳嗽、喘气等症状43.2574.51%对照组15攻毒后20天出现轻微咳嗽1016攻毒后21天出现轻微咳嗽717攻毒后16天出现咳嗽、喘气1618攻毒后15天出现咳嗽、喘气1812.75-

图7 肺脏临床解剖图Fig 7 Clinical anatomy of lung
3 讨论与结论
猪肺炎支原体感染猪时,常伴有猪鼻支原体混合感染,从猪体内进行猪肺炎支原体的分离非常困难。现有疫苗菌株分离年代都比较久远,保护效果有一定的降低。本研究通过采集疑似猪支原体感染的组织病料,经过PCR鉴定,多重PCR检测,将阳性病料接到猪肺炎支原体液体培养基进行分离,成功分离到一株菌株。分离的菌株经测序、形态观察、生化特性、血清学特性鉴定为猪肺炎支原体,此株猪肺炎支原体与常用的疫苗菌株同源性好,并且是从最近发病的猪场分离而来,为潜在的疫苗菌株。
在致病性试验中,分离菌株菌液进行攻毒,发现分离菌株经过传代仍具有一定的毒力,可致仔猪产生咳嗽等支原体肺炎典型的临床症状,剖检能观察到肺部肉变,病理切片显示感染猪均表现不同程度的间质性肺炎;在免疫原性试验中,分离株制备灭活疫苗免疫仔猪后攻毒,免疫组肺炎病变平均减少74.51%,分离菌株免疫原性良好。对仔猪的致病性试验和免疫原性试验可以证明,分离株适合作为灭活疫苗的制苗用菌株。
